對於患有罕見遺傳病的人們來說——其中許多疾病可能會使人衰弱或危及生命——對創新療法的需求迫在眉睫。在 7,000 種已知的罕見病中,只有 5% 有獲批的療法,這使得罕見病患者群體成為當今醫學界最缺乏服務的群體之一。最終,充分發揮基因療法治療罕見遺傳病潛力的能力取決於傾聽和解決患者的需求。輝瑞旨在建立一種新的範例;透過在創新的每個階段都納入患者的聲音,並利用公司在罕見病研究方面的專業知識來開發一系列可能具有變革性的基於重組腺相關病毒 (rAAV) 的基因療法,從而引領將新藥帶給罕見病患者的道路。
罕見病的全球集體影響
在美國,罕見病被定義為影響人數少於 20 萬人的疾病,在歐盟,罕見病被定義為影響人數不超過 2000 分之一的疾病,其中約 80% 是由基因突變引起的。大約一半的罕見病主要影響嬰幼兒和兒童,並可能導致嚴重的疾病和過早死亡。雖然每種遺傳病可能發生在少數患者群體中,但總體而言,罕見病影響著全球約 4 億人,並造成嚴重的健康、生命和經濟潛力損失。少數可用的治療方法通常側重於疾病症狀,而沒有糾正疾病的根本原因。
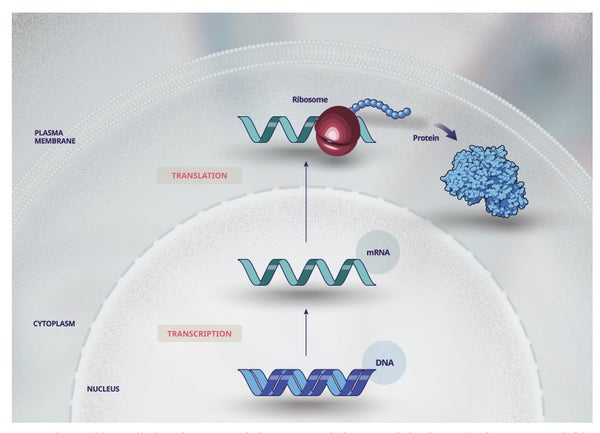
罕見遺傳病的症狀和健康影響各不相同,但大多數疾病會導致細胞和器官正常功能所需的蛋白質丟失或改變。我們的基因編碼在染色體的 DNA(脫氧核糖核酸)中,染色體位於細胞核內(圖 1),包含製造我們身體保持健康所需的所有蛋白質的指令。DNA 被複制(轉錄)成 RNA(核糖核酸),RNA 離開細胞核並將這些指令傳遞給細胞核外的蛋白質製造機制(核糖體)。
遺傳性疾病是由 DNA 程式碼(突變)的遺傳性或自發性變化引起的。這些變化可能導致蛋白質功能喪失或獲得毒性功能,並隨後改變細胞功能。恢復蛋白質表達功能模式的基因藥物在治療罕見病方面具有廣闊的前景。治療方法包括基因療法(美國基因和細胞治療協會將其定義為將遺傳物質——特別是 DNA 或 RNA——引入、移除或改變到患者的細胞中以治療特定疾病,儘管其他來源可能使用不同的定義)、基因編輯(永久性糾正、阻止或改變患者自身 DNA 內的突變)和基因調控(改變基因轉錄為 RNA 或 RNA 翻譯為蛋白質)。
基因療法有可能解決罕見病的根本原因
基因療法代表了治療藥物開發的下一步發展,它始於治療症狀的化合物(例如,阿司匹林治療疼痛),然後發展到改變疾病的生物療法(可能包括蛋白質和抗體)(例如,酶替代療法治療某些先天性代謝缺陷,如戈謝病)。現在,基因療法提供瞭解決罕見遺傳病潛在生物學問題的潛力,這可以減少持續治療的需求,從而減輕患者的治療負擔並降低醫療系統的需求。它還可以提高護理人員,尤其是父母的生活質量,他們今天面臨著巨大的情感、身體和經濟挑戰。使患者能夠活得更長壽、更健康、更有效率,可能會進一步提高他們為社會和經濟做出積極貢獻的能力。
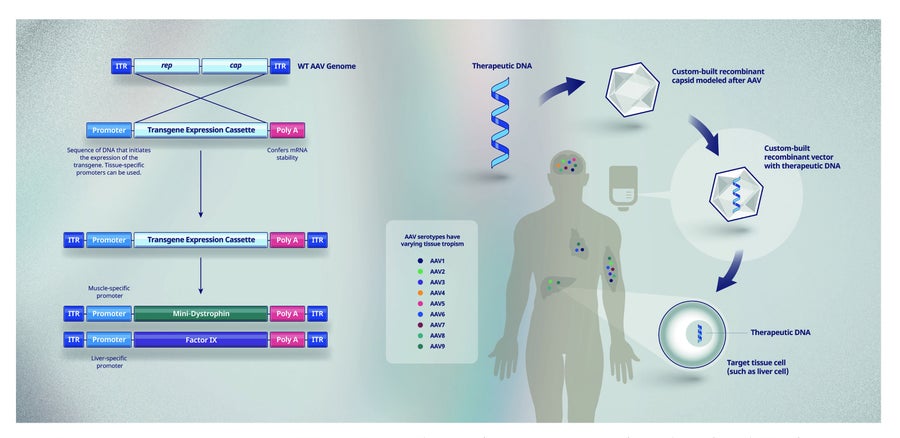
圖 2. 使用體內 rAAV 基因療法從基因到蛋白質。從野生型 (WT) 腺相關病毒 (AAV) 基因組中移除 rep 和 cap 基因,並替換為表達盒,該表達盒包括治療性轉基因、在靶細胞型別中開啟基因所需的啟動子序列以及賦予 mRNA 穩定性的 Poly A 序列。杜氏肌營養不良症和血友病 B 的基因療法分別使用編碼微型肌營養不良蛋白和 IX 因子的轉基因。然後將這些治療性 DNA 與 rAAV 衣殼結合,以建立 rAAV 載體,該載體透過輸注或注射(取決於靶組織)遞送給患者。ITR - 野生型 AAV 基因組的倒末端重複序列,允許轉基因在生產過程中複製。
創新對於實現基因療法的承諾至關重要
我們的身體有多種系統來阻止外來物質和 DNA 進入我們的細胞。安全有效地將健康基因轉移到細胞(圖 2)需要能夠繞過這些系統並使健康基因在受疾病影響的特定細胞中長期表達的遞送方法。
將無害病毒變成基因療法的強大載體
腺相關病毒 (AAV) 可以被改造,使其自身的病毒基因組被 DNA 取代,DNA 包含基因的功能性複製(稱為轉基因)和一個在特定型別的細胞中開啟基因的開關(稱為啟動子),這些細胞是治療特定疾病所必需的。AAV 外殼(衣殼)內部的工程 DNA 組合稱為載體(圖 2)。
工程重組 AAV 載體是目前研究性基因治療臨床試驗中最常見的遞送系統,原因有幾個。從安全形度來看,AAV 不會引起人類疾病,並且在沒有其他病毒的幫助下無法自我複製。這意味著 rAAV 載體無法在人體內複製。rAAV 載體遞送的健康基因也主要與患者自身的 DNA 分開,這有助於防止產生額外的突變,如果突變插入患者染色體的某些位置,可能會發生這種情況。rAAV 載體有可能提供健康基因的長期表達,並且多種 AAV 毒株(稱為血清型)能夠開發 rAAV 載體,這些載體旨在優先靶向治療特定疾病所需的細胞(圖 2)。此外,rAAV 載體可以透過輸注或注射(稱為體內基因療法)直接遞送給患者。重要的是,rAAV 載體已用於美國和歐洲批准使用的基因療法中,證明了它們的可行性。由於所有這些原因,輝瑞將 rAAV 載體用於體內基因療法,作為其罕見病基因療法的主要方法。
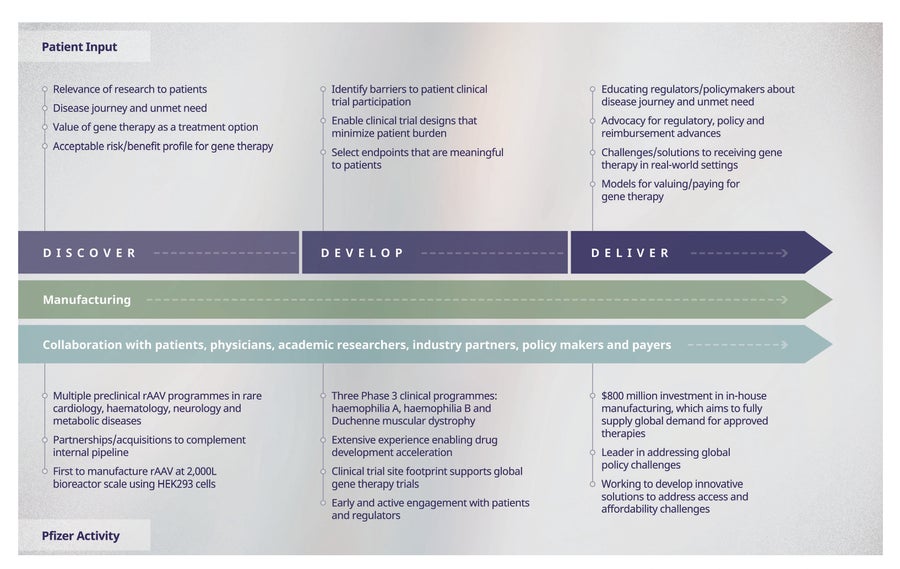
圖 3. 輝瑞端到端、以患者為中心的基因療法開發方法。輝瑞的基因療法方法涵蓋發現、開發和交付。各階段的患者參與;輝瑞各階段的活動;生產和合作是端到端關鍵。
輝瑞的端到端 rAAV 基因療法平臺
輝瑞已建立我們認為是行業領先的端到端(從發現到開發和交付)基因療法平臺,以幫助實現基因療法在治療各種罕見遺傳疾病方面的潛力,並確保在開發的每個階段都考慮到患者的需求和觀點(圖 3)。這個端到端平臺利用輝瑞廣泛的罕見病藥物開發專業知識來推進基因療法的開發時間表,支援全球基因療法試驗,並儘早與患者互動以瞭解他們的需求。這種方法促成了業內最大的 3 期基因療法專案產品線之一(血友病 A、血友病 B 和杜氏肌營養不良症)以及罕見血液學、神經病學、心臟病學和內分泌/代謝疾病的多個臨床前專案。
發現
在發現階段,輝瑞科學家評估特定基因突變在疾病中所起的作用。然後,他們確定將健康基因複製傳遞到正確細胞以治療疾病的最佳方法。他們還確定是否存在年齡或疾病階段,在此之前或之後基因療法不太可能有效。例如,杜氏肌營養不良症早期出現,進展迅速,並隨著時間的推移導致肌肉損傷和衰竭。在這種和其他進行性疾病中,基因療法在兒童時期給藥可能預防嚴重的和不可逆轉的損傷,在老年患者給藥可能預防進一步的衰退。
在開發階段會發生各種活動,包括進行臨床試驗,這些試驗優先考慮參與患者的安全,並提供患者、醫生、監管機構和其他利益相關者做出知情批准和治療決策所需的安全性和有效性資料。在設計實現這些目標的試驗時,需要考慮幾個重要因素。一個考慮因素是確定哪些患者最有可能從正在測試的基因療法中獲益,如上所述,這可能取決於多種因素。另一個考慮因素是針對可能已經對 AAV 產生抗體的患者的方法。由於 AAV 是一種天然存在的病毒,許多人已經接觸過它,他們的免疫系統已經被啟動以阻止 AAV(和相關的 rAAV 載體)進入細胞。其中一些抗體可以阻止 rAAV 載體進入細胞(稱為中和抗體或 NAbs)。顯著水平的 NAbs 可能會阻止 rAAV 基因療法進入足夠的細胞以產生治療效果。因此,許多 rAAV 臨床試驗目前排除 NAbs 水平高於一定值的患者。從安全形度來看,對 AAV 的免疫反應可能會導致與 rAAV 載體相關的不良反應。為了降低這種風險,rAAV 基因療法臨床試驗通常包括臨時使用減少宿主免疫反應的藥物,並制定了監測和應對這些事件(如果發生)的流程。
對潛在療法是否提供益處的評估是透過測量特定臨床試驗評估的變化來確定的,這些評估被稱為終點。終點可以包括遞送基因產生的治療性蛋白質水平的變化(例如,血友病 A 和 B 的 VIII 因子或 IX 因子,或杜氏肌營養不良症的微型肌營養不良蛋白)、身體功能的變化,如步行速度或爬樓梯能力(杜氏肌營養不良症)、血友病出血率以及患者自身對疾病生活如何因治療而改變的看法。選擇對患者重要且可以一致且可重複測量的終點可能具有挑戰性,特別是對於尚未就如何定義“益處”達成共識的疾病。因此,與患者、臨床醫生和監管機構協商對於選擇對患者有意義、可以在臨床實踐中一致使用併為監管機構提供評估和可能批准新療法所需資訊的終點至關重要。最後,建立登錄檔以收集接受新基因療法(一旦獲得批准)的患者的長期資料,對於多年來持續評估安全性和有效性非常重要。
開發
開發階段還包括與監管機構合作,以建立潛在產品批准的途徑,該途徑在強大的安全性和有效性資料需求與通常迫切需要的新療法之間取得平衡。這是一個複雜的過程,需要監管機構、患者、患者權益倡導團體、行業和學術界之間的有效合作。全面的監管策略還需要反映不同全球監管機構的優先事項和流程。作為一家在發現、開發和向全球患者交付療法方面擁有 170 多年成功經驗的公司,輝瑞正在利用其監管專業知識來支援其罕見病基因療法產品線。它還參與合作努力,以協調不同國家和地區的監管要求,從而簡化罕見病基因療法的批准,並確保儘可能快速和廣泛地獲得批准的療法。
交付
交付階段包括旨在確保批准的基因療法能夠惠及可能從中受益的患者的活動。這包括與付款人和政策制定者進行創新性合作,以開發新穎的解決方案,確保患者獲得可能提供多年或患者終生益處的潛在的一次性療法。管理供應鏈物流和教育醫療從業人員對於促進基因療法交付到患者的社群護理機構至關重要,並使患者免受長途跋涉到專門治療中心的負擔。擴大基因檢測的範圍以實現罕見遺傳病的早期診斷對於基因療法的交付也很重要。對於早期治療可能提供最大益處的快速進展性疾病尤其如此。
在整個發現、開發和交付過程中,輝瑞積極與患者互動。在發現階段,患者的見解闡明瞭科學家對罕見遺傳病如何影響他們日常生活的理解,他們疾病症狀的哪些型別的變化或改善對他們最有意義,以及他們願意接受或不接受哪些風險以實現這些變化。在整個臨床和監管開發過程中,患者的意見可以透過識別參與障礙並確定哪些測量被認為是重要的並且應該用於確定新療法是否有效,從而幫助最佳化臨床試驗設計。患者在確保批准的療法能夠輕鬆交付方面也發揮著重要作用,他們可以幫助教育監管機構、政策制定者和付款人瞭解他們的需求以及新療法可能為他們及其護理人員提供的潛在價值。
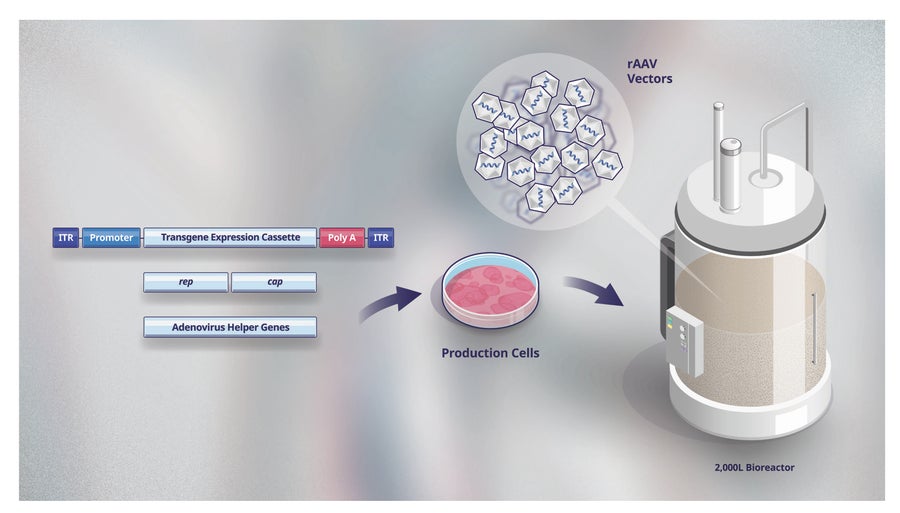
圖 4. 輝瑞 rAAV 三重轉染生產工藝的組成部分。輝瑞生產其每種 rAAV 基因療法候選藥物的工藝需要生產細胞系和三種不同的組分(稱為三重轉染):載體攜帶的遺傳物質(轉基因)、載體的關鍵複製和結構蛋白 (rep 和 cap) 以及輔助複製和組裝過程的其他(輔助)蛋白。所有三種組分都被引入生產細胞系(如 HEK293 或其他已建立的細胞系)。轉染的細胞在生物反應器中培養,在那裡進行 rAAV 載體生產。
卓越的生產支援成功
研究性罕見病療法的臨床試驗通常包括比大型疾病適應症更少的患者數量,這可能會導致臨床開發時間表縮短。因此,這些療法的生產工藝需要比其他型別的療法更短的時間內建立和批准。這可能會導致監管機構對基因療法生產規範的疑問多於對其他型別的在研藥物的疑問。基因療法生產的監管環境也因關鍵監管要求的許多方面仍在不斷完善而變得複雜。此外,監管要求可能因監管機構而異,這增加了嘗試使這些新型療法(如果獲得批准)在全球範圍內廣泛可用的複雜性。
與其他生物製品的生產一樣,此過程的第一步是開發所謂的生產細胞系(圖 4)。生產細胞充當製造 rAAV 載體的微型工廠。一旦建立了生產細胞系,細胞就會在培養物中生長並轉染,以產生數萬億個 rAAV 載體,具體取決於疾病適應症。治療肌肉等組織所需的 rAAV 載體數量(遍佈全身)比治療視網膜疾病所需的數量大數萬倍,對於視網膜疾病,rAAV 載體可以直接注射到視網膜中。
輝瑞使用大型容器(也稱為生物反應器,圖 4),就像用於生產公司其他生物療法一樣。必須裂解生產細胞,以將 rAAV 載體釋放到細胞生長的生長培養基中。收集液體並在幾個步驟中進行處理,以去除任何細胞碎片或其他生產副產品或雜質。還使用其他步驟來減少不包含健康基因的“空”載體的數量。這些多重純化步驟(每個步驟都包括質量控制測試)產生高質量的 rAAV 載體產品,然後將其包裝用於冷鏈運輸和交付。隨著基因療法候選藥物從發現階段到臨床試驗的推進,以及已批准的基因療法產品(將需要能夠滿足全球患者需求的持續生產)的推進,生產需求增加。
輝瑞在支援其基因療法產品線方面開發的包裝和冷鏈供應鏈管理方面的專業知識,在其快速開發和部署冷鏈流程以在全球範圍內交付輝瑞-BioNTech COVID-19 疫苗的能力中發揮了關鍵作用。從疫苗部署中獲得的額外見解正在被納入其基因療法候選藥物的創新冷鏈管理流程中。有望實現比傳統生物療法方法更高效的 rAAV 基因療法交付流程(如果獲得批准)。
輝瑞的端到端 rAAV 生產工藝建立在公司生產其他生物療法的專業知識之上,以生產高質量的載體,這些載體可以擴充套件以滿足其基因療法候選藥物的開發階段和給藥要求。這種專業知識對於防止基因療法候選藥物從臨床試驗開發到全球交付以及跨越廣泛劑量範圍的監管延誤至關重要。該公司已建立多元化的生產基礎設施,以支援從端到端開發到未來交付其基因療法候選藥物,其中包括位於美國北卡羅來納州莫里斯維爾、達勒姆和桑福德的尖端生產設施。總而言之,這些設施以小規模(10-250 升)提供符合良好實驗室規範級別的材料,用於研究和開發活動,並以各種規模提供符合良好生產規範級別的材料,用於早期(500 升)和關鍵臨床(2,000 升)試驗,並最終滿足全球患者需求。每個規模生產的劑量數量取決於疾病適應症。
輝瑞實現 rAAV 基因療法治療罕見病潛力的道路
輝瑞正在進行多項內部和合作努力,以支援基因療法的發展。
推進科學
科學家們正在創新新型 rAAV 載體,這些載體可能更有效地進入靶細胞和/或產生更多這些載體編碼的健康蛋白質。研究人員還在探索多種方法來減少對 rAAV 載體的潛在免疫反應,這對於提高患者首次給藥的安全性和有效性,以及在未來需要時可能使患者能夠接受額外劑量非常重要。其中一種方法是血漿置換術,其中患者的血液透過外部裝置進行處理,以在施用 rAAV 基因療法之前去除 NAbs。預計這將防止免疫系統阻止 rAAV 載體進入靶細胞。另一種方法是施用暫時阻止免疫系統產生針對 rAAV 載體的新抗體的藥物。這也可能增加在初始給藥期間到達其靶細胞的 rAAV 載體的數量,同時阻止可能降低未來劑量效率(如果需要)的抗體的產生。目前用於降低某些移植患者抗體水平(包括 NAbs)的藥物的臨時使用也可能在降低基因療法患者對 rAAV 載體的抗體反應方面提供益處。
這些干預措施的可用性可能允許納入原本可能因對 AAV 載體存在高水平預先存在的 NAbs 而被排除在基因療法之外的患者。此外,雖然來自已批准和研究性 rAAV 基因療法的資料表明治療性蛋白質表達具有良好的永續性,從而具有作為一次性療法的潛力,但在某些疾病或某些患者中,理論上可能需要第二甚至第三劑。輝瑞正在探索多種方法,包括使用聯合干預措施,以減少對 rAAV 載體的免疫反應,這對於支援初始劑量的長期表達以及在必要時實現再次給藥至關重要。
擴大全球監管能力
目前的基因療法批准速度低於預期,在許多情況下是由於監管複雜性。減少監管延誤需要制定和實施關於臨床試驗設計和終點的一致和標準指南,以及基因療法生產所用化學、生產和控制指南的清晰性。確保全球患者都能獲得新的基因療法還需要全球整合和協調監管指南,以及監管機構和基因療法研究人員之間早期和富有成效的溝通。輝瑞正在利用其全球監管專業知識,並與科學組織、行業、監管機構以及全球其他機構合作,以應對基因療法面臨的監管挑戰。
開發創新的准入模式
罕見遺傳病的傳統療法在患者的一生中使用,目前的報銷政策和支付模式並非旨在適應可能僅給藥一次或幾次的基因療法。輝瑞正在與政府和付款人合作,開發創新的政策和准入模式,以承認基因療法在患者一生中可能提供的潛在健康、經濟和社會效益,並減少獲得潛在變革性療法的經濟和其他障礙。
rAAV 載體在實現患有罕見病患者的新型變革性療法方面的潛力已得到驗證。充分實現這一潛力需要在所有利益相關者之間持續推進和創新整個發現、開發和交付的連續過程。
有關輝瑞罕見病療法產品組合的更多資訊,請訪問 https://www.pfizer.com/science/rarediseases/;有關輝瑞基因療法專案的資訊,請訪問 https://www.pfizer.com/science/researchdevelopment/ gene-therapy。