本文發表於《大眾科學》的前部落格網路,反映了作者的觀點,不一定反映《大眾科學》的觀點
你是否曾經好奇過你服用的藥物——它們是如何被研發和生產出來的?我們將在“分子到藥物”系列中探索這些問題。這個新系列可以被看作是“面向普通人的醫學科普”,旨在揭開臨床研究和藥物研發的神秘面紗,並提供背景資訊,以便患者和醫生都能更明智地決定是否願意參與臨床試驗。
為什麼要關注?
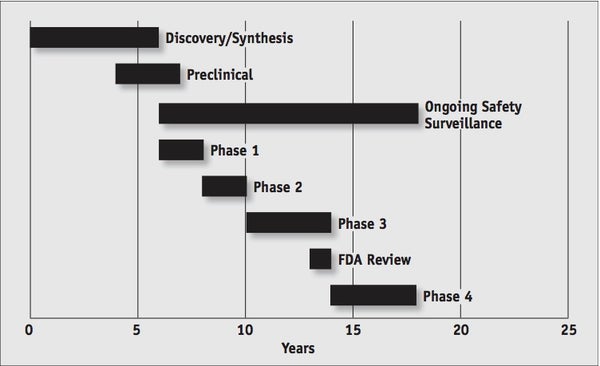
從化學物質被發現到最終進入藥店,一種藥物的研發平均需要 12-15 年,並且需要成千上萬的志願者參與臨床試驗過程(圖 1)。
關於支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道: 訂閱。透過購買訂閱,您將幫助確保有關塑造我們今天世界的發現和想法的具有影響力的故事的未來。
很少有人參與臨床試驗——癌症患者的參與率甚至低於 5%——原因是缺乏對該過程的認識或瞭解。我們將在後續文章中詳細介紹藥物是如何研發出來的。
志願者人數不足是藥物研發的主要瓶頸之一,延緩了產品的釋出和對公眾的用處。當然,如果許多人患有尚無其他治療方法的疾病,他們可能會在這個等待期間遭受痛苦甚至死亡。因此,如果您想要新藥,請了解——並決定您是否願意參與——這個過程。我曾以志願者、研究人員和倡導者的身份參與其中。
為什麼要進行臨床試驗?
人們自然而然地想要找到能讓他們感覺更好的東西。因此,人們調製了藥劑,有時被稱為“專利藥”。但後來有人問,這種藥是否真的有效,或者除了預期用途之外,這種藥還有什麼作用。後來問題變得更加複雜,詢問該藥物是否可能對患有特定疾病的人或正在服用其他藥物的人有害。或者藥物是如何起作用的?如果它透過特定的機制起作用,這是否表明它可能對另一種疾病有用?是否還有其他意想不到的後果?因此,這些以及更多問題,就是進行臨床試驗的原因。
臨床試驗是如何產生的
為了理解為什麼試驗以某些方式進行,瞭解它們是如何演變的會很有幫助——也很有趣。
早在聖經時代就有關於實驗的描述,丹尼爾以豆類和水為食,代替肉和酒。其他人也效仿,觀察接受治療組之間的差異。但首次已知的前瞻性對照臨床試驗發生在 1747 年,當時詹姆斯·林德給水手們提供了不同的膳食補充劑,以努力預防壞血病,這是一種因維生素 C 缺乏引起的疾病。雖然他證明了療效,但林德沒有獲得參與者的同意,導致他的研究也獲得了因倫理理由而受到批評的 dubious honor。
天花(一種現在已被消除的毀滅性病毒感染)的流行在 1700 年代和 1800 年代很常見。1796 年,愛德華·詹納證明,用牛痘(一種相關的但較溫和的疾病)製成的疫苗可以用來預防天花。在美國,人們試圖從英國進口的牛痘痂中開發疫苗。由於牛痘病毒無法在乾燥的痂中存活很長時間,因此透過連續的人與人之間的接種來繁殖病毒:刮取一個人身上的感染性疫苗接種病變,並用作接種下一個人的材料來源。
國會授權必須維持充足的未受汙染的牛痘供應,並向任何公民提供疫苗。根據 1813 年的《疫苗法案》,巴爾的摩醫生詹姆斯·史密斯博士透過每 8 天進行一次人與人之間的傳播,繁殖牛痘長達 20 年。不幸的是,1821 年,史密斯博士錯誤地將天花結痂而不是牛痘疫苗寄往北卡羅來納州,引發了天花疫情,以及隨後 1813 年《疫苗法案》的廢除。
除了用活天花病毒而不是減毒(弱化)牛痘疫苗接種人的這個離譜錯誤之外,人與人之間的接種也經常傳播其他傳染病以及牛痘疫苗,從而削弱了人們對疫苗接種工作的熱情。(這很好地說明了意外後果定律;幸運的是,這種人與人之間的傳播不再進行了)。
許多法律隨後都是被動地透過的,以應對悲劇,而不是主動地防止問題的發生。
例如,在墨西哥作戰的美國軍隊收到了無效的、偽造的瘧疾藥物後,1848 年通過了《進口藥品法案》,建立了海關實驗室,以驗證藥物的真偽。具有諷刺意味的是,假冒抗瘧藥再次成為東南亞和非洲的巨大問題——但那是以後的故事了。
1880 年,首次嘗試透過國家食品和藥品法——但失敗了,因為公眾眼中沒有迫在眉睫的危機。
在厄普頓·辛克萊對芝加哥肉類加工廠的揭露性作品《叢林》中令人毛骨悚然、令人作嘔的描述之後,國會在 1906 年通過了立法,禁止買賣不純和貼錯標籤的食品和藥品——儘管沒有要求療效。但這項立法實際上並沒有牙齒,因為舉證責任在於 FDA,需要證明藥物的標籤是虛假和欺詐性的,才能將其從市場上撤下。” 同樣,也沒有要求披露藥物成分,因為它們被認為是商業秘密,因此得名“專利藥”。聽起來耳熟嗎?
在消費者保護方面進展甚微,1911 年,最高法院在“美國訴約翰遜案”中裁定,1906 年的 FDA 法案確實禁止對藥物的成分或身份做出虛假或誤導性陳述——但仍然沒有禁止謊報療效。
直到 1938 年,在發生 107 例因“磺胺酏劑”死亡事件後,FDA 才能夠要求“製造商在藥物上市前證明其安全性”。這確立了臨床試驗的必要性。
意外後果
臨床試驗旨在瞭解藥物(或器械)是否按預期發揮作用——在人體試驗之前,這是未知的。這就是為什麼早期階段的試驗只使用少數人,並且隨著經驗的積累而增加人數。有時會在過程中做出意想不到的發現。例如,米諾地爾是 Rogaine 的成分,是一位精明的臨床研究人員在高血壓臨床試驗中發現的。最初作為抗高血壓藥物進行研究的藥物米諾地爾,意外地被發現具有刺激頭髮生長的副作用,從而催生了一整條針對禿頂的產品線。
同樣,偉哥也是意外發現的。西地那非(通用名)正在作為治療心絞痛的藥物進行研究,因為它透過阻斷一種酶——磷酸二酯酶 (PDE) 來擴張血管。雖然對心絞痛不是很有效,但發現它可以延長勃起時間,從而刺激了整個“生活方式藥物”行業。幸運的是,現在發現 PDE 抑制劑對一系列重要的醫療狀況都有用,從肺動脈高壓到哮喘和肌肉萎縮症。
當然,並非所有意外發現都有如此美好的結果。
例如,己烯雌酚 (DES) 是一種合成雌激素,在美國 1938-1971 年間被普遍處方,以幫助預防流產。多年後才發現 DES 會導致暴露婦女的女兒患上一種罕見的陰道癌。後來,也出現了其他型別的癌症,但數量很少。
沙利度胺對發育中胚胎的悲劇性影響可能是藥物研發史上最臭名昭著和最可怕的意外後果。沙利度胺於 1957 年首次上市,在德國可以非處方購買,用於治療妊娠反應。幾年後,人們才清楚地將孕早期使用沙利度胺與大量出生時肢體像海豹鰭狀肢而不是肢體(海豹肢畸形)的兒童聯絡起來。然後,沙利度胺從市場上撤下。人們對該藥物的興趣再次引起爭議,FDA 於 1998 年批准沙利度胺用於多發性骨髓瘤;目前正在探索其在其他嚴重疾病中的用途。
善與惡——倫理標準
1928 年,透過一次偶然的發現,亞歷山大·弗萊明在一個“黴菌汁”中發現了青黴素,這種“黴菌汁”抑制了培養皿上細菌的生長。直到 1939 年,青黴素的潛在價值才被人們認識到,當時它的純化和開發開始認真進行,作為戰時努力的一部分。戰爭(以及國家之間更友好的競爭)往往是研究的動力,並導致了許多有用的發明。血管外科、區域麻醉和骨科,以及不太明顯的免疫療法以及瘧疾和其他感染的治療都自然而然地取得了進步。
例如,1940 年的動物研究表明,小鼠可以有效地用青黴素治療鏈球菌。第一位患者於 1941 年接受了青黴素治療,這在現在將被稱為“同情用藥”。不幸的是,雖然他最初對治療有反應,但可用的藥物不足,他後來死於鏈球菌感染。
然而,這個“概念驗證”足以刺激英國和美國之間的發展和廣泛合作,這是由於希望獲得該藥物來治療二戰中的軍事傷亡。在科學研究與發展辦公室 (OSRD) 的推動下,製藥公司加入了這項愛國的戰時努力;默克公司是第一家開發出用於臨床的抗生素的公司,隨後是施貴寶、輝瑞和禮來。1943 年,戰爭生產委員會 (WPB) 承擔了增加產量以滿足軍隊需求的責任。國家研究委員會主席切斯特·基弗博士擔任著令人吃力不討好的職位,即定量配給向軍隊以外的人員提供的有限的青黴素庫存。雖然不是透過正式的臨床試驗,但基弗博士也收集了關於平民反應的資料。今天,當患者在試驗方案之外接受實驗性藥物時,也會遵循相同的流程。
截至 1945 年 3 月 15 日,青黴素的定量配給停止了,因為有充足的供應可以滿足軍事和公眾的需求。不幸的是,“奇蹟藥物”被浪費了,現在它與許多其他抗生素一樣,用途有限——細菌的進化變得更成功地產生了耐藥性,而藥物開發卻未能跟上步伐。我們許多人擔心我們正在進入後抗生素時代——美國傳染病學會自 2004 年開始的“壞細菌,無藥物”運動以來,一直試圖呼籲人們關注這個嚴重的問題。在似曾相識的時刻,澳大利亞新聞剛剛報道說,國際短缺再次導致那裡不得不定量配給青黴素。
規範化、標準化的臨床試驗正式開始於對二戰暴行濫用的回應,世界共識確立了人體研究的倫理要求。
大多數藥物試驗都受到嚴格監管,參與是安全的。那些不安全的試驗會成為頭條新聞,因為它們能吸引眼球。麗貝卡·斯克魯特的精彩、引人入勝的故事《永生的海瑞塔·拉克斯》是醫學研究誤入歧途以及我們對故事陰暗面著迷的極好例子。但是,如果沒有臨床試驗,我們任何人都不會有任何處方藥可用。
正如我們所見,藥物研發的歷史有時是曲折的。臨床研究既不完美,也並非沒有一定程度的風險,但這些風險可以降到最低,而且現在比過去任何時候都有更多的保障措施。近幾十年來,藥物、醫療器械、疫苗和新型療法的開發取得了巨大進步。每一種都經過了類似的廣泛測試過程,然後才被批准供公眾使用。但是,由於這些早期階段的測試最多隻涉及幾千名志願者,因此新藥被數百萬人服用後,市場上出現意想不到的結果是不可避免和無法避免的。
在未來的文章中,我將更詳細地解釋臨床試驗是如何進行的,以及如果您曾經考慮自願參加,您應該問哪些問題。我還將介紹藥物研發中的障礙、與婦女和少數族裔相關的問題,以及倫理問題,包括我們在藥物研發中的優先事項。也非常歡迎您提出您可能想討論的建議。
這篇文章改編自我的書《進行臨床研究:醫生、護士、研究協調員和研究人員的實用指南》。