每隔兩週,一位護士都會拜訪住在科羅拉多州丹佛市的 43 歲馬蒂·雷斯維格,並給他注射一種名為 gantenerumab 的實驗性藥物。每個月,雷斯維格都會開車進城進行腦部掃描,以確保該藥物沒有引起任何出血。每年,他都會飛往密蘇里州聖路易斯市,進行為期四天的腦部掃描、脊髓穿刺、血液分析以及詳盡的記憶力和推理能力測試。
雷斯維格身體健康,經營著兩家當地企業。他經歷這一切,是因為他有一種罕見的基因突變,幾乎可以肯定他會患上早發性阿爾茨海默病。他希望他參與了九年的國際臨床試驗可能預防,或至少延緩症狀的發作,否則這些症狀將在幾年內出現。
“我總是盡我所能為研究人員提供儘可能多的幫助——即使結果證明對我沒有幫助,也可能會幫助我的孩子們,”他說。
關於支援科學新聞業
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞業 訂閱。透過購買訂閱,您正在幫助確保未來能夠繼續講述關於塑造我們當今世界的發現和想法的有影響力的故事。
這項試驗是試圖瞭解在症狀開始之前治療阿爾茨海默病的根本原因是否可能是應對這種造成巨大損失的疾病的最佳方法之一。正在接受審查的藥物都是抗體,這些抗體被開發出來用於靶向和清除大腦中的澱粉樣蛋白 β 蛋白,這些蛋白會聚集在一起形成稱為斑塊的毒性團塊(參見“抗澱粉樣蛋白抗體”)。這些藥物與 Biogen 公司在馬薩諸塞州劍橋市生產的 aducanumab 屬於同一型別,後者去年獲得了美國食品和藥物管理局 (FDA) 的臨時批准,用於治療輕度阿爾茨海默病,這在很大程度上歸功於其去除澱粉樣蛋白 β 的能力。
神經學家保羅·艾森說,由於這種毒性蛋白質是幾種痴呆症的特徵,這些抗體研究也可能為如何治療全球 5500 萬患有這些疾病的人提供線索。艾森是位於聖地亞哥的南加州大學的神經學家,也是美國阿爾茨海默病臨床試驗聯盟的負責人。大多數痴呆症發生在 65 歲之後;所有這些都被證明是頑固不治的。在全球 100 多項試驗中,大多數旨在治療疾病的症狀,而不是其根本原因。
但艾森預見到一個未來——也許就在十年左右之後——阿爾茨海默病的大部分負擔實際上可能會被預防。“我們正朝著從中年開始對人們進行血液測試的方向發展,並用藥物治療那些顯示出澱粉樣蛋白異常的人,這些藥物可以減少澱粉樣蛋白斑塊的生成,”他說。“我對此感到樂觀。”
要使這種充滿希望的觀點成為現實,還需要很多事情步入正軌。大型臨床試驗必須證明這些療法有效,並且必須證明清除澱粉樣蛋白的藥物是安全且負擔得起的。在經歷了數十年的挫折和失敗的臨床試驗之後,一些痴呆症研究人員更傾向於表示謹慎。“該領域正在冒險進行可能耗資數十億美元的研究,”明尼蘇達州羅切斯特市梅奧診所的神經學家大衛·克諾普曼說。
答案需要一段時間才能出現。一些阿爾茨海默病預防試驗才剛剛開始,一些正在進行的試驗可能會持續到下一個十年。
.jpeg?w=900)
阿爾茨海默病患者的大腦 PET(正電子發射斷層掃描)顯示澱粉樣蛋白斑塊的積聚(圈出),這在健康大腦中不存在。圖片來源:Science History Images/Alamy Stock Photo
儘早介入
1986 年,英國諾丁漢的卡羅爾·詹寧斯寫信給遺傳學家約翰·哈迪,詢問她是否可以在他的研究中發揮作用。就像雷斯維格一樣,詹寧斯也有許多親戚死於早發性痴呆症。哈迪的團隊當時在倫敦大學學院,對阿爾茨海默病的遺傳學很感興趣,並邀請詹寧斯一家捐獻血液給他們的專案。
幾年後,該團隊確定了受影響家庭成員共有的突變。它位於一個基因中,該基因編碼一種位於神經元膜中的大型蛋白質,即澱粉樣前體蛋白 (APP)。
大腦中的 APP 被一組酶切割成澱粉樣蛋白 β 和其他短鏈澱粉樣蛋白。在健康的大腦中,這些澱粉樣蛋白肽可能具有有用的功能,但隨著時間的推移,它們會積累——可能是因為大腦清除它們的分子系統效率降低——並聚集在一起形成斑塊。在 APP 編碼基因發生突變的人中,澱粉樣蛋白 β 蛋白更具粘性或更豐富,並且疾病的發生早於沒有該突變的人。
這是阿爾茨海默病澱粉樣蛋白假說的基礎,該假說由哈迪及其同事在發現致病性 APP 突變後首次提出。根據該理論,預防澱粉樣蛋白 β 積累的觸發事件可能會減緩疾病程序——甚至從一開始就阻止其發生。
製藥和生物技術公司著手靶向澱粉樣蛋白系統,開發阻止切割 APP 的酶的藥物,或建立針對澱粉樣蛋白 β 肽的抗體。但他們的藥物在臨床試驗中不斷失敗。五項針對阻斷澱粉樣蛋白切割酶 β-分泌酶的藥物的 III 期臨床試驗因副作用而中止,這些副作用使認知能力暫時惡化。另一種酶 γ-分泌酶的阻斷劑也遭遇了同樣的命運。一次又一次,旨在附著和結合澱粉樣蛋白 β 的抗體試驗未能改善人們的臨床症狀。至少有一家主要的製藥公司輝瑞公司於 2018 年退出了阿爾茨海默病領域。
一連串的失敗使研究界分裂成不同的陣營。一個陣營認為,如果靶向澱粉樣蛋白不起作用,那麼澱粉樣蛋白假說一定是錯誤的。克諾普曼接受 APP 加工是疾病啟動過程的一部分,但他說澱粉樣蛋白 β 的作用尚未得到證實。“例如,其他 APP 切割產物可能對疾病過程更重要,”他說。
另一個陣營認為,試驗設計不佳,特別是由於他們招募了已經開始表現出阿爾茨海默病早期跡象的人。
“事實是,為了最佳化去除澱粉樣蛋白的潛在影響,你需要儘早這樣做,”艾森說。澱粉樣蛋白 β 的積累早在其損害足以引起症狀的許多年前就開始了其緩慢而無聲的破壞活動,他說。“阿爾茨海默病的總持續時間超過 25 年,而試驗僅在神經退行性變不斷惡化的最後十年進行。”
動物研究支援了這一見解。在基因改造為過度表達 APP 的小鼠中,在檢測到澱粉樣蛋白 β 沉積物之前用 aducanumab 治療幼鼠,導致沉積物顯著減少,並且六個月後大腦中疾病跡象減少。
當 FDA 去年 6 月做出有爭議的決定批准 Biogen 的 aducanumab 時,它認識到了這種長期前景:該藥物去除澱粉樣蛋白 β 的能力使其有可能減少阿爾茨海默病的症狀。Biogen 對患有輕度阿爾茨海默病的人進行的 aducanumab 大型安慰劑對照試驗並未明確改善他們的臨床症狀,但該藥物在清除他們大腦中的澱粉樣蛋白斑塊方面做得很好。該機構宣佈 aducanumab 是第一個影響該疾病生物學原因的治療方法。
該決定激怒了許多研究人員,他們聲稱 FDA 降低了其標準。(克諾普曼因此問題辭去了 FDA 諮詢委員會的職務。)但在接下來的幾個月中,來自其他藥物試驗的更多資料出現,顯示隨著澱粉樣蛋白 β 的清除,認知能力下降的趨勢略有減緩,以及阿爾茨海默病進展的其他生物標誌物(例如稱為 tau 蛋白的蛋白質的積累)的減少。當年晚些時候,該機構將另外三種抗體納入快速通道審查程式:Genentech-Roche 的 gantenerumab、Biogen-Eisai 的 lecanemab 和 Eli Lilly 的 donanemab。與 aducanumab 類似,所有三種藥物都在早期試驗中被證明可以清除斑塊。
“這些藥物是重大的、重大的遊戲規則改變者,”倫敦大學學院英國痴呆症研究所所長、神經科學家巴特·德·斯特魯珀說。“它們將使澱粉樣蛋白假說得到明確的檢驗。”
許多研究人員一致認為,檢驗該假說的最佳方法——也是阻止疾病發展的最佳方法——是儘早給人們服用這些藥物,而無需等待阿爾茨海默病症狀首先出現。
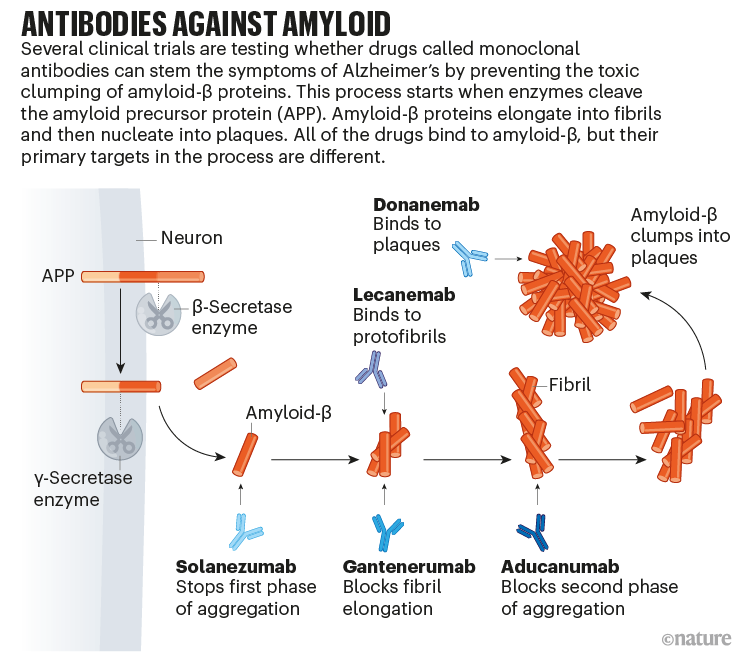
圖片來源:Nik Spencer/《自然》
時機至關重要
哈迪認為,即使是最早的試驗的設計者也可能意識到他們招募患者的時間太晚了。“透過回顧鏡來看,這一點很清楚——資料已經存在,”他說。在 1980 年代,加利福尼亞大學聖地亞哥分校的病理學家喬治·格倫納和他的同事發現,唐氏綜合徵患者相對年輕時就會患上痴呆症。他們認為,這是因為唐氏綜合徵患者多了一條 21 號染色體(APP 基因位於該染色體上)。他們的屍檢研究表明,斑塊在認知症狀出現前多年就已形成。
艾森說,該領域並沒有忽視尋找治療有症狀阿爾茨海默病的方法的重要性。但臨床研究人員現在正將更多注意力轉向治療症狀前阿爾茨海默病的藥物試驗。然而,為這些試驗尋找參與者並不容易。人們需要沒有症狀,但極有可能在可測量的時限內開始出現症狀。識別這些個體有兩種方法:找到像雷斯維格這樣具有罕見遺傳易感性的人,或者在普通人群中找到因大腦中存在澱粉樣蛋白 β 而患阿爾茨海默病風險較高的人。
為了識別罕見的遺傳病例,美國國家老齡研究所 (NIA) 於 2008 年在馬里蘭州貝塞斯達資助啟動了顯性遺傳阿爾茨海默病網路 (DIAN)。它現在包括來自 20 個國家的 600 多人,代表大約 300 個家庭,這些家庭攜帶與早發性阿爾茨海默病相關的三個基因之一的突變。每個家庭成員有 50% 的機會遺傳突變。
該網路迅速聚集了更多資金和研究合作伙伴,並開始招募家庭(包括雷斯維格的家庭)參與觀察計劃。研究人員定期進行腦部正電子發射斷層掃描 (PET) 以檢查澱粉樣蛋白 β 和其他阿爾茨海默病生物標誌物,並將攜帶基因的家庭成員與不攜帶基因的家庭成員進行比較。他們還記錄了每個家庭中症狀開始出現的時間。該網路 2018 年的報告證實,澱粉樣蛋白異常的最初跡象在症狀開始前長達 25 年就會出現。
DIAN 聯盟於 2012 年開始了一項為期七年的澱粉樣蛋白結合抗體試驗。該試驗旨在延緩那些沒有認知症狀但已開始在其大腦中出現阿爾茨海默病主要標誌物——澱粉樣蛋白斑塊——的人的疾病進展。該試驗招募了 194 名處於不同疾病階段的參與者,並將他們分成幾組,分別接受兩種抗體之一 gantenerumab 或 solanezumab,或安慰劑。
但 2020 年公佈的試驗結果令人失望。該試驗未能證明這些藥物可以減緩認知能力下降——儘管接受治療的症狀前參與者的認知能力下降很少,但安慰劑組的認知能力下降也很少。“這意味著我們根本無法說這些藥物最終是否會對無症狀人群有所幫助,”聖路易斯華盛頓大學醫學院的蘭德爾·貝特曼說,他領導著進行這項研究的 DIAN 試驗部門。
儘管如此,其中一種抗體 gantenerumab 對該疾病的生物標誌物產生了顯著影響。它不僅減少了澱粉樣蛋白斑塊,還降低了 tau 蛋白的水平和另一種神經退行性變標誌物(一種在血液中出現的神經元蛋白)的水平。
這些結果鼓勵貝特曼和 DIAN 聯盟繼續研究 gantenerumab 另外三年,放棄 solanezumab 和安慰劑組,但允許這些組中的參與者轉換為 gantenerumab,並讓他們知道他們正在服用哪種藥物。
這給雷斯維格帶來了兩難境地。當他最初接受基因突變檢測時,他選擇不被告知結果。但該研究的擴充套件僅適用於突變攜帶者,因此參與請求將自動揭示他的基因狀況。“我決定是時候讓我知道了,但我仔細計劃了一切,”他說。他與妻子一起退居到科羅拉多州的一個度假租賃屋,接聽來自他的遺傳諮詢師的電話。“我不想在自己家裡知道結果——這至少是我想要控制的事情。”當雷斯維格得知自己攜帶突變時哭了,並決定他唯一的機會是繼續參加試驗。
去年,該聯盟決定嘗試治療大腦中沒有認知症狀也沒有斑塊的人。“這將真正成為阿爾茨海默病預防的終極試驗,”貝特曼說。在接下來的幾個月中,該團隊計劃開始招募 160 名突變攜帶者,其中一些人年僅 18 歲,預計在未來 11-25 年內不會出現症狀。安慰劑對照試驗將持續四年,定期監測人們的澱粉樣蛋白狀況。然後,它將進入為期數年的“開放標籤研究”:安慰劑組將被取消,所有參與者都將接受試驗藥物。屆時,它還將測量疾病進展的其他生物標誌物。
華盛頓大學聖路易斯分校的試驗首席研究員埃裡克·麥克戴德說,對於參與者來說,要執行數十年才能出現症狀的試驗是不切實際的。相反,該團隊將監測生物標誌物的變化,例如澱粉樣蛋白 β 和 tau 蛋白,這些生物標誌物現在已知可以預測該疾病漫長沉默期內的症狀發作。“我們可以改變的這些其他生物標誌物越多,我們抵消或至少顯著延遲發作的可能性就越高。”他說,研究人員將在試驗的第二階段之後繼續監測儘可能多的參與者。
在 DIAN 聯盟之外,其他針對早發性阿爾茨海默病的試驗正在進行中,在已經有一些澱粉樣蛋白積聚的人身上測試藥物。Genentech-Roche 正在研究哥倫比亞一個大家庭的成員,其中一半人攜帶一個基因的病理性突變,該基因編碼一種澱粉樣蛋白切割分泌酶的一部分。其藥物 crenezumab 的試驗將於今年完成。在唐氏綜合徵患者中測試阿爾茨海默病藥物的研究也在準備中。
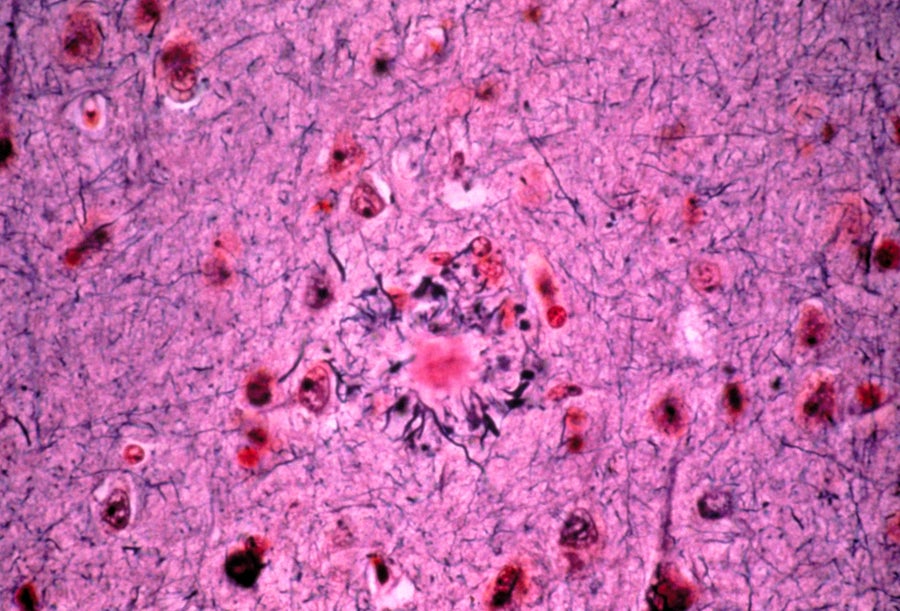
澱粉樣蛋白斑塊(中心)顯示在患有阿爾茨海默病的人的腦組織中。圖片來源:Martin M. Rotker/SPL
阻止症狀
預防性試驗的第二種方法是識別普通人群中患晚發性阿爾茨海默病的高危人群。國際阿爾茨海默病神經影像學倡議是一項總部位於加利福尼亞大學舊金山分校的公私合作專案,透過正常衰老和疾病的各個階段追蹤數百人的阿爾茨海默病生物標誌物。其資料顯示,大約三分之一 65 歲以上認知正常的人的大腦中都有澱粉樣蛋白斑塊,其中超過 85% 的人將在 10 年內發展出阿爾茨海默病症狀。
在此基礎上,正在進行三項大型安慰劑對照臨床試驗,每項試驗招募 1000 多名認知能力良好但透過 PET 掃描發現大腦斑塊的人。每項試驗都在測試一種不同的抗體。所有三項試驗都將持續四年,到那時,在斑塊開始積累後,通常可以測量到認知能力下降。
艾森的研究所正在協調 A4 試驗——無症狀阿爾茨海默病中的抗澱粉樣蛋白治療——該試驗正在測試禮來公司的藥物 solanezumab。預計明年公佈結果。艾森還共同領導了 AHEAD 3-45 試驗,該試驗於 2020 年開始,正在測試 lecanemab。同年,禮來公司啟動了一項名為-Alz 2 的 donanemab 試驗。今年,羅氏公司將啟動其自身的 gantenerumab III 期試驗,該試驗將持續六年。
艾森說,此類試驗的成本“通常高達數億美元”。僅招募 A4 試驗中的 1,169 名參與者就需要大約 4,500 次 PET 掃描,每次掃描的平均成本為 7,000 美元。“但是,這種疾病給社會帶來的痛苦、死亡率和經濟影響方面的成本證明了對有效治療進行鉅額投資是合理的,”他說。
近年來,在開發更簡單的、基於血液的阿爾茨海默病生物標誌物方面取得了重大進展。其中兩項預防試驗正在使用此類生物標誌物來幫助選擇進行 PET 篩查的人員,從而降低 PET 掃描的成本和參與者的不便。一種生物標誌物測量兩種略有不同的澱粉樣蛋白 β 形式的比率,另一種生物標誌物測量一種與 tau 相關的分子。
到目前為止,預防性試驗都使用針對澱粉樣蛋白 β 的抗體。這些藥物有兩個缺點。它們可能會產生副作用:少量腦出血或腫脹,這些大多是無害的,但也可能是嚴重的。而且它們很昂貴。Biogen 最初將其 aducanumab 一年治療的定價定為 56,000 美元,儘管它在 2021 年 12 月將其減半。
但該領域正在考慮重新審視更簡單的小分子藥物,這種藥物的生產成本遠低於基於抗體的療法。艾森說,一些公司正開始考慮重新審視分泌酶,也許會調整早期試驗中失敗的酶阻斷分子的結構,或者找到更好的給藥方法。
複雜的原因
該領域的研究人員意識到,解決痴呆症問題還需要付出超出澱粉樣蛋白 β 的努力。“阿爾茨海默病更復雜,”瑞士蘇黎世大學 aducanumab 的原始開發者之一、神經生物學家羅傑·尼奇說。“澱粉樣蛋白是一種非常緩慢燃燒的神經毒素,它會引發疾病,但腦細胞——包括連線血管和免疫系統細胞的腦細胞——會反擊。”他說,將會有更多方法來靶向已確立的疾病。此外,所有痴呆症中只有大約三分之二屬於阿爾茨海默病型別,屍檢研究表明,其中一半具有混合病理——大腦除了澱粉樣蛋白和 tau 蛋白外,還含有其他毒性蛋白質,或血管損傷的跡象。
NIA 主任理查德·霍德斯說,預防性試驗非常重要且前景廣闊,“但我們不會放棄已經患病的人”。他說,因為即使在同一個人身上,也可能有多種因素導致痴呆症——因此需要一系列治療方法。美國國家老齡研究所正在資助 72 項痴呆症臨床試驗,試驗針對各種靶點的藥物。例如,一些旨在降低血壓以減少大腦中小血管破裂的風險;另一些則靶向 tau 蛋白。只有 20 項靶向澱粉樣蛋白。美國國家老齡研究所還支援至少 120 項試驗,以研究非藥物干預措施的影響,例如認知訓練、鍛鍊和飲食。
研究人員估計,2021 年,全球臨床試驗中正在研究至少 126 種不同的製劑——包括 NIA 研究中的製劑。
作為一名志願者,雷斯維格不得不接受他的特殊試驗帶來的特殊負擔——不僅是時間投入,還有不斷提醒他,如果試驗藥物不起作用,等待他的命運。他說,DIAN 聯盟每年將來自世界各地的參與者聚集在一起分享他們的經驗,這對他們有所幫助。“我們建立了一個美好的社群,我們知道我們為科學做出了巨大貢獻。”
本文經許可轉載,並於 2022 年 3 月 9 日首次發表。
