編者注(2021年10月8日):David Julius,本文2006年的作者之一,是2021年諾貝爾生理學或醫學獎的共同獲得者,以表彰其在人體感知溫度和觸覺方面的發現。
搏動、瘙癢、痠痛、刺痛、灼痛、重擊、穿刺。疼痛有各種令人不快的型別。但所有疼痛都有一個共同點:承受疼痛的人都希望它停止。
然而,當今最廣泛使用的鎮痛藥本質上是幾個世紀以來使用的民間療法:嗎啡和其他阿片類藥物來自罌粟,阿司匹林來自柳樹皮。雖然這些治療方法可以緩解疼痛,但每種方法都有其侷限性。阿司匹林和其他非甾體抗炎藥 (NSAIDs),如布洛芬,無法緩解最嚴重的疼痛。即使是通常是最強效的藥物阿片類藥物,也並非對所有人都有效。此外,它們可能有嚴重的副作用,患者往往會對它們產生耐受性,需要不斷增加劑量才能獲得任何緩解。
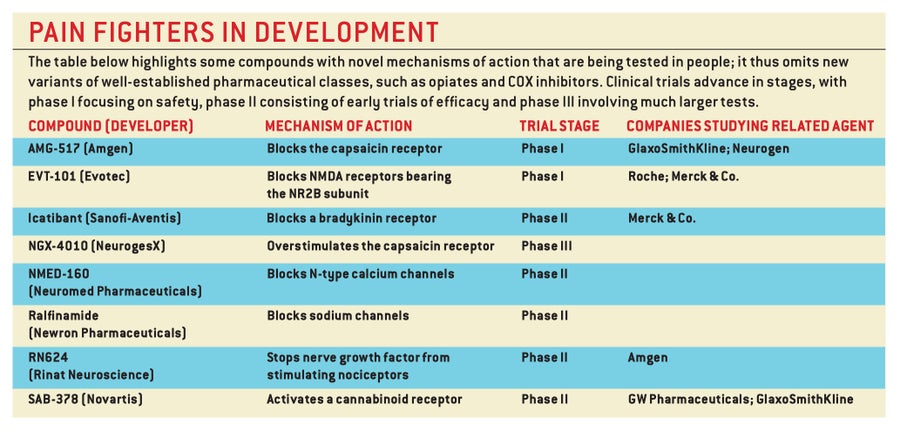
在過去的20年中,神經生物學家對細胞迴路和傳遞疼痛訊號的特殊分子有了深入的瞭解。今天,這些知識正被用於設計新的策略,以更好地管理疼痛並減少副作用。事實上,現在正在研究的方法比我們能討論的還要多。
火焰粒子
在17世紀,法國哲學家勒內·笛卡爾列舉了一種理論來解釋人們如何感知疼痛。他認為,捏、打或戳本質上是拉扯神經繩索,然後在大腦中敲響疼痛警報鈴。想象一下,例如,腳被燒傷。“快速移動的火焰粒子,”笛卡爾認為,會產生一種擾動,“沿著神經絲傳遞,直到到達大腦。”
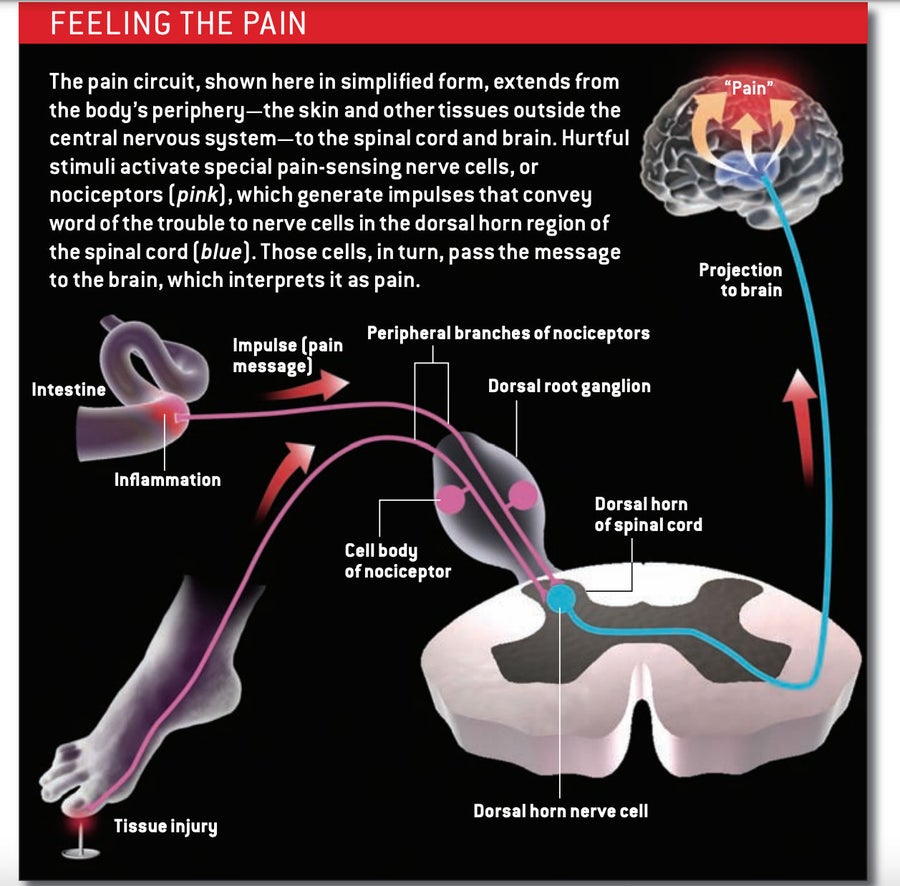
笛卡爾的觀點並沒有太離譜。疼痛通常始於外周:在皮膚、內臟或中樞神經系統 (CNS) 以外的任何其他部位——即大腦和脊髓之外。 碰到腳趾或靠在熱爐子上會啟用稱為傷害感受器的神經元(神經細胞),這些神經元專門響應有害刺激,例如極端溫度或機械壓力,或響應損傷或炎症而產生的化學物質。
傷害感受器有兩條臂:一條感覺檢測分支延伸到外周,在那裡支配小片組織;另一條分支延伸到脊髓[見下方方框]。神經元的細胞體位於脊柱外部的結構中,位於兩條臂之間。當外周分支上的特殊檢測分子在皮膚或器官中遇到有害物質時,它們會觸發一個衝動,該衝動沿著線路向上,沿著中央分支到達脊髓中稱為背角的區域。在那裡,傷害感受器釋放稱為神經遞質的訊號分子,這些分子啟用背角中的神經元,促使它們將警報資訊傳遞到大腦。雖然傷害感受器通常被稱為疼痛感應神經元,但它們僅僅表明可能存在有害刺激; 是大腦將訊號解釋為疼痛,並促使我們說“哎喲”。
並非所有疼痛都令人擔憂。例如,伴隨輕微組織損傷(如扭傷或擦傷)的急性疼痛具有保護作用:它鼓勵生物體避免進一步損傷。這種疼痛往往是暫時的,並且會隨著時間的推移而消退。
最困擾患者和醫生的是那些不會消失且難以治療的疼痛。在許多情況下,問題出現的原因是引發不適的損傷或炎症持續存在。關節炎的疼痛是持續炎症的結果,而侵襲性癌症可能伴隨的劇痛很大程度上源於組織損傷和炎症。
在其他情況下,持續性疼痛是神經性疼痛,是神經細胞本身受損造成的。當CNS中的神經元因多發性硬化症、中風或脊髓損傷等而持續受損時,可能會發生神經性疼痛。或者,它可能源於外周神經元的損傷。截肢者忍受不再存在的肢體的疼痛(幻肢痛)以及皰疹感染消退多年後皮膚仍有灼痛感的人(帶狀皰疹後神經痛)都患有神經性疼痛。當這種疼痛持續存在時,它不是某些持續性損傷或其他疾病的症狀; 它本身就是神經系統的疾病,需要疼痛專家的關注。
無休止的疼痛
那些患有難以控制的疼痛的人的一個主要共同點是對刺激異常敏感。這種敏感性可能表現為痛覺過敏(對通常的疼痛輸入的過度反應)或異痛症(對通常無害的輸入的疼痛反應)。在受異痛症影響的人中,即使是衣服對皮膚的輕柔壓力或彎曲關節也可能變得難以忍受。
生物學家現在瞭解到,這種增強的敏感性——或致敏作用——源於神經細胞中的分子或結構變化。例如,在外周,促進炎症的分子可能會導致檢測有害刺激的傷害感受器對這些輸入變得過度反應。炎症分子甚至可能導致傷害感受器在沒有任何環境輸入的情況下開始產生訊號。
致敏作用也可能源於導致疼痛傳遞通路過度活躍的CNS變化。這些變化可能會持續很長時間,可能包括顯示對傷害感受器釋放的神經遞質做出反應的受體數量增加,甚至可能包括連線的重新佈線和通常抑制疼痛訊號傳導的神經細胞的喪失。當CNS參與時,這種情況稱為中樞敏化。
無論具體是什麼過程導致,事實證明,持續性疼痛都可能導致致敏作用,從而加劇和延長不適。因此,許多研究人員在尋找新的鎮痛藥時,首先想到的是改善痛覺過敏和異痛症。與此同時,患者需要認識到,不應默默忍受持續性疼痛;它需要積極治療以防止進一步致敏。
從源頭開始
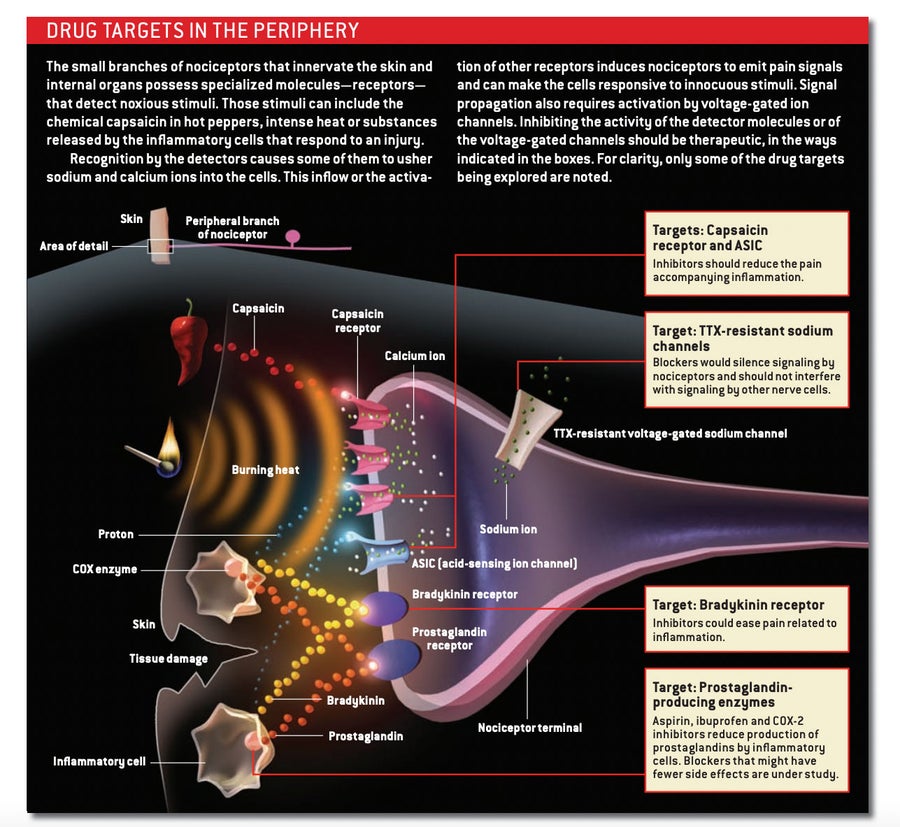
在尋找新的鎮痛藥的過程中,許多努力都集中在有害訊號通常起源的地方:外周。傷害感受器用於檢測有害刺激的某些特殊分子很少在身體的其他部位出現。阻斷這些分子大概可以關閉疼痛訊號傳導,而不會擾亂其他生理過程,從而不會引起不必要的副作用。
圖片來源:AMADEO BACHAR
當今最流行的療法——阿司匹林和其他NSAIDs——主要在外周發揮作用。當組織受傷時,該區域的各種細胞會泵出稱為前列腺素的化學物質,這些化學物質作用於傷害感受器的疼痛感應分支,降低其啟用閾值。阿司匹林和NSAIDs抑制細胞用於產生誘發疼痛的前列腺素的酶家族(環氧合酶)的活性。 這些非處方化合物可以緩解日常的疼痛。但它們也抑制身體其他部位的前列腺素產生,通常會導致胃痛、腹瀉和潰瘍等副作用。這些問題可能會阻止藥物的長期使用並限制可以給藥的劑量。
為了減少胃腸道後果,製藥公司開發了一系列靶向酶環氧合酶-2 (COX-2) 的藥物。由於COX-2通常不在胃或腸道中發揮作用,因此阻斷其活性不應引起與傳統NSAIDs相同的破壞。它們是否真的對胃溫和尚待確定。與此同時,這些藥物也有自身的問題。羅非昔布 (Vioxx) 是一種COX-2抑制劑,曾被處方用於緩解關節炎疼痛,但由於發現它會增加心臟病發作和中風的風險,因此已從市場上撤下。其他COX-2抑制劑也正在接受不良影響的審查。
送入辣椒醬
幾乎只存在於傷害感受器上的靶點的發現為開發選擇性緩解疼痛的藥物提供了機會。特別吸引人的靶點是辣椒素受體。這種離子通道存在於許多傷害感受器的膜中,不僅對辣椒素(辣椒中的刺激性成分)做出反應,而且對令人痛苦的熱量和質子(使物質呈酸性的氫離子)做出反應;質子在發炎的組織中異常豐富。在這些化學物質或高於 43 攝氏度的溫度存在下,該通道允許鈉離子和鈣離子湧入傷害感受器,刺激其產生訊號,轉化為由熱、炎症或辛辣食物引起的灼燒感。
因此,抑制辣椒素受體的物質應能減輕炎症性疼痛。事實上,在實驗動物中,這種“拮抗劑”已經能夠緩解由轉移並損害骨組織的腫瘤周圍的酸性環境引起的非常嚴重的疼痛。今天,許多製藥公司正在競相開發辣椒素受體拮抗劑。
操縱受體的可能性不止於此。具有諷刺意味的是,在某些情況下,有目的地刺激辣椒素受體可以減輕疼痛。含有辣椒素的外用霜劑被處方用於緩解術後傷口癒合或由艾滋病毒感染、皰疹發作和糖尿病引起的神經損傷可能伴隨的瘙癢、刺痛和刺痛感。儘管長期小劑量最終可能會使受體對通常的刺激不那麼敏感,或者可能導致傷害感受器釋放的神經遞質耗盡,但這些軟膏的確切作用機制尚不清楚。
阻斷其他通道
在傷害感受器的外週末梢發現的另一種分子也引起了人們對藥物靶點的興趣。 所有神經元都擁有鈉通道,這些通道響應神經細胞膜兩側電壓的變化而開啟,產生從一個神經元向另一個神經元傳遞資訊的衝動。 目前,暫時滅活這種電壓門控鈉通道的區域性麻醉劑用於治療各種不同的疼痛,特別是那些因牙醫就診引起的疼痛。 然而,問題在於這些麻醉劑必須應用於不適部位:在整個神經系統中停用鈉通道可能是致命的。
然而,疼痛感應神經元擁有一種電壓門控鈉通道亞類,稱為TTX耐受型,這種通道在中樞神經系統中不存在。 因此,研究人員希望能夠阻斷這種亞類的藥物可以全身給藥(全身),而不會產生不良影響。 此外,研究表明,此類藥物很可能能夠抑制受損外周神經的不適當的過度活躍,從而可能緩解某些神經性疼痛。 不幸的是,製藥行業迄今未能成功開發出此類通道的選擇性抑制劑,部分原因是它們與廣泛分佈於整個神經系統中的TTX敏感型鈉通道非常相似。
圖片來源:AMADEO BACHAR
然而,或許可以使用一種稱為RNA干擾的新技術選擇性地移除這些通道。 該方法依賴於將稱為小AMADEO BACHAR干擾RNA (siRNA) 的微小分子引入生物體。 這些siRNA透過誘導指導蛋白質合成的分子(信使RNA)的降解來阻止不需要的蛋白質的產生。 該技術正在人體中研究用於某些視網膜疾病,但將RNA干擾轉化為疼痛的藥理學干預將具有挑戰性。 與基因療法一樣,病毒很可能需要傳遞siRNA,而這方面引起了安全擔憂。 時間會證明該方法是否可以作為疼痛療法切實可行,但它仍然是一種令人興奮的可能性。
假設製藥公司確實開發出了一種所謂的“魔彈”鎮痛藥:一種能夠特異性且有效地消除傷害感受器上的一種疼痛轉導分子活性的化合物。 這種干預措施能否緩解頑固性疼痛? 也許不能,因為關閉通往疼痛通路的一個入口可能是不夠的。
例如,想象一下一種藥物可以敲除緩激肽受體——緩激肽是一種小蛋白質或肽,在外周炎症期間產生。 緩激肽有力地刺激傷害感受器,而阻斷其受體的拮抗劑肯定會阻止這些受體啟用傷害感受器。 但它不會阻止神經元識別和響應由損傷或炎症產生的其他誘發疼痛的分子——例如質子、前列腺素和一種稱為神經生長因子的蛋白質。 同樣,僅削弱辣椒素受體可能無法減輕所有質子介導的疼痛,因為在某些情況下,質子會啟用傷害感受器上稱為ASIC(酸敏感離子通道)的單獨的檢測器群。
專注於脊髓
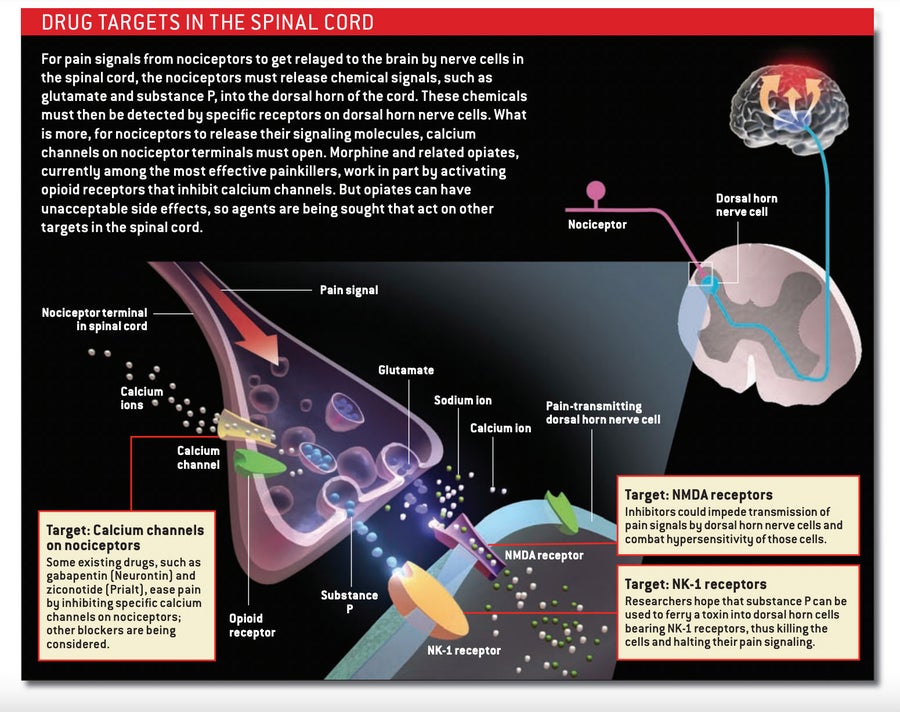
解決這種冗餘問題的一種方法是施用靶向多種疼痛機制的抑制分子混合物。 然而,另一種方法是靶向作用更集中的分子,阻止所有傷害感受器(無論最初啟用它們的刺激是什麼)將其疼痛訊號傳遞到脊髓神經元的能力。
嗎啡和其他阿片類藥物採用後一種策略,它們與到達脊髓的傷害感受器末梢上的阿片受體結合。 在啟用這些受體的過程中,阿片類藥物阻止神經遞質釋放,從而阻斷疼痛資訊向脊髓神經元的傳遞。 它們還使背角神經元不太可能對疼痛訊號做出反應。 由於這些藥物在脊髓中起作用,因此理論上它們應該能夠治療所有型別的疼痛,儘管它們往往對與炎症相關的疼痛最有效。
不幸的是,阿片受體存在於全身的神經元上,包括大腦和胃腸系統。 這種普遍存在解釋了為什麼嗎啡及其同類藥物會產生廣泛的不良副作用,包括嚴重的便秘和呼吸抑制。 這些問題可能會限制患者可以安全服用的藥物量或醫生會開的藥物量。 許多醫生不願處方阿片類藥物,擔心患者會上癮。 然而,成癮在僅因疼痛而服用阿片類藥物的人中並不常見。 為了部分避免某些不良影響,阿片類藥物通常直接輸送到脊髓周圍充滿液體的空間(鞘內)。 這些藥物也可以透過注射(用於術後疼痛)或透過留置泵(用於慢性疼痛)給藥。
阿片類藥物的替代品也可用。 干擾鈣通道的藥物可以阻止神經遞質從脊髓中的傷害感受器末梢釋放。 加巴噴丁 (Neurontin) 是一種抗驚厥藥,據信它透過與某些鈣通道的特定亞基相互作用來緩解某些形式的疼痛。 一種相對較新的藥物齊考諾肽 (Prialt)——源自太平洋芋螺的毒液——抑制一種不同型別的鈣通道,稱為N型。
與阿片受體一樣,N型鈣通道也存在於整個神經系統中。 如果齊考諾肽全身給藥,血壓會急劇下降。 因此,該化合物是鞘內給藥的。 儘管毒素可以阻斷疼痛,但其在中樞神經系統內的作用仍然可能產生令人不快的副作用,包括頭暈、噁心、頭痛和意識模糊。 因此,齊考諾肽主要用於晚期癌症患者,他們無法透過其他方式獲得緩解。
最近,作用於大麻素受體(介導大麻作用的受體)的藥物已在臨床試驗中取得進展。 這些藥物似乎透過多種方式緩解疼痛,包括干擾傷害感受器及其靶細胞之間的訊號傳遞,以及降低炎症細胞的活性。
關閉艙口
一些研究人員正專注於阻止脊髓神經元對傷害感受器釋放的神經遞質做出反應——特別是對氨基酸穀氨酸(疼痛資訊的主要載體)做出反應。 穀氨酸啟用脊髓背角的各種受體。 其中,NMDA類受體參與中樞敏化,這使其成為新鎮痛藥的合理靶點。
圖片來源:AMADEO BACHAR
身體中的每個神經元都擁有某種型別的NMDA受體。 因此,一次性抑制所有型別將引發災難性的影響,包括記憶喪失、癲癇發作和癱瘓。 為了避免此類反應,研究人員正試圖透過作用於主要在背角中發現的版本來削弱受體。 與含有稱為NR2B亞基的形式結合的化合物在動物研究中已產生令人鼓舞的結果。 例如,直接向脊髓液中輸送NR2B抑制劑的小鼠比未治療的動物對疼痛的敏感性更低。 該藥物還逆轉了外周神經損傷小鼠的異痛症。
許多傷害感受器還會釋放肽神經遞質,如P物質和降鈣素基因相關肽 (CGRP)。 這些肽透過作用於離散受體來啟用脊髓中的疼痛傳遞神經元,因此預期阻斷與這些受體相互作用的藥物會有所幫助。 遺憾的是,選擇性阻斷P物質使用的受體——神經激肽-1或NK-1受體——在疼痛的臨床試驗中失敗了,這可能是因為單獨阻斷該受體是不夠的。 抑制脊髓中的CGRP活性是否會關閉疼痛尚不清楚,儘管製藥行業正在開發旨在透過干擾CGRP釋放到大腦表面的血管上來緩解偏頭痛痛苦的拮抗劑。
殺死信使?
如果所有調節疼痛訊號傳導的嘗試都失敗了,可以考慮殺死信使。 然而,切斷傷害感受神經通常會適得其反,因為正如我們已經指出的,神經損傷會促進更頑固、永續性疼痛的發生。 切斷脊髓中將資訊傳遞到大腦的通路(脊髓切斷術)曾經很常見,但現在僅保留給對所有疼痛治療均無反應的晚期癌症患者。 這種最後一種手術的問題是,外科醫生無法選擇性地切斷“疼痛”通路。
一種可能的解決方案,由於其在動物身上的成功而現在引起了相當大的關注,是一種分子療法,它可以去除脊髓神經元的一個子集,這些神經元接收來自傷害感受器的輸入。 這種細胞殺傷療法將毒素皂草素與P物質結合。 結合物中的P物質與NK-1受體結合,導致整個化合物的內化,之後皂草素被釋放以殺死神經元。 由於結合物只能進入具有NK-1受體的細胞,因此研究人員希望副作用將受到限制。
來源:FRANZ F. HEFTI Rinat Neuroscience Corporation
然而,脊髓神經元的消融應被視為最後的手段:中樞神經系統中的神經元不會再生,因此由此產生的變化——無論是好是壞——都將是永久性的。 同樣的永久性在外周神經系統中不成立,在周圍神經系統中,切斷的纖維可以再生。 理想情況下,減少傷害感受器的訊號檢測分支的療法(例如高劑量的辣椒素)將停止疼痛,但允許分支最終再生,從而恢復之前支配組織片的正常疼痛檢測。
靶向神經元可能不是克服疼痛的唯一方法。 研究表明,神經膠質細胞(滋養中樞神經系統中神經元的細胞)在響應外周神經損傷時會發揮作用。 神經膠質細胞遷移到與受損神經相關的背角區域。 然後,神經膠質細胞釋放大量化學物質,這些化學物質促使傷害感受器末梢在脊髓中釋放神經遞質,從而使疼痛訊號持續存在。 其中一些物質,包括生長因子和稱為細胞因子的分子,也會使背角神經元過度興奮,而阻斷這種過度活躍的藥物應有助於削弱過度敏感性。 各個研究小組正在努力識別——並找到抑制方法——在神經受損時募集和啟用神經膠質細胞的分子。
有趣的是,前列腺素是脊髓中啟用的神經膠質細胞釋放的關鍵物質之一。 它們透過阻斷背角神經元上的甘氨酸受體來增強疼痛。 甘氨酸是一種抑制性神經遞質,通常會使這些神經元安靜下來。 因此,NSAIDs可能不僅透過干擾外周前列腺素的產生(熟悉的方式)發揮作用,而且還透過抑制神經膠質細胞中的COX酶發揮作用。 在這種情況下,將COX抑制劑直接輸送到脊髓液中可能會最大限度地減少全身輸送引起的副作用。 一種增強甘氨酸受體活性的藥物也有助於抑制疼痛資訊向大腦的傳遞。
感知問題
在本文中,我們討論了治療疼痛的實驗方法的一個子集,所有這些方法都在動物研究中顯示出前景。 那些引起最大興奮的方法在保持正常感覺完好無損的同時,減少了難以治療的炎症性和神經性疼痛的特徵性增強的敏感性,並具有可接受的副作用特徵。 但這些療法會幫助患者嗎? 它們對所有型別的疼痛都有效嗎? 這些問題仍未得到解答。
一種值得進一步探索的方法是使用行為、非藥物療法來治療頑固性疼痛——特別是那些與纖維肌痛和腸易激綜合徵等疾病相關的疼痛,對於這些疾病,沒有人最終確定器質性病因。 大約十年前,麥吉爾大學的研究人員證明,催眠可以改變大腦活動以及一個人對疼痛的感知。 科學家對志願者進行催眠,並向他們暗示,他們將手浸入的熱水浴比實際情況更令人不快或更令人愉快。
研究人員使用正電子發射斷層掃描監測大腦活動,發現軀體感覺皮層(對物理刺激的強度做出反應)在兩種情況下都同樣活躍。 但第二個大腦區域——扣帶回皮層——在受試者認為刺激更令人不快時更活躍,這表明催眠改變了這些人感知感覺的方式。 透過更多地瞭解大腦如何調節疼痛體驗,研究人員或許能夠開發出更好的認知療法來調節疼痛感知。
詩人艾米莉·狄金森經常思考痛苦。 在一部作品中,她寫道:
痛苦具有空白的元素;
它無法回憶
它何時開始,或者是否有
沒有痛苦的一天。
它沒有未來,只有自身。
我們只能希望對疼痛感覺機制的持續研究將帶來安全有效的治療方法,從而改變疼痛的未來,使其恢復到沒有疼痛的時代。