病毒像蜘蛛落在比自身大 1000 倍的氣球上一樣接觸細胞。它有六條細腿,展開在一個形似注射器的身體下方,頭部呈球狀。這是一個名叫 lambda 的捕食者,它的獵物是大腸桿菌。找到受害者後,lambda 現在做了自生命首次出現以來無數萬億病毒所做的事情:它用腿抓住細胞膜,將其注射器狀部分連線到孔隙並收縮,將 DNA 注射到內部。
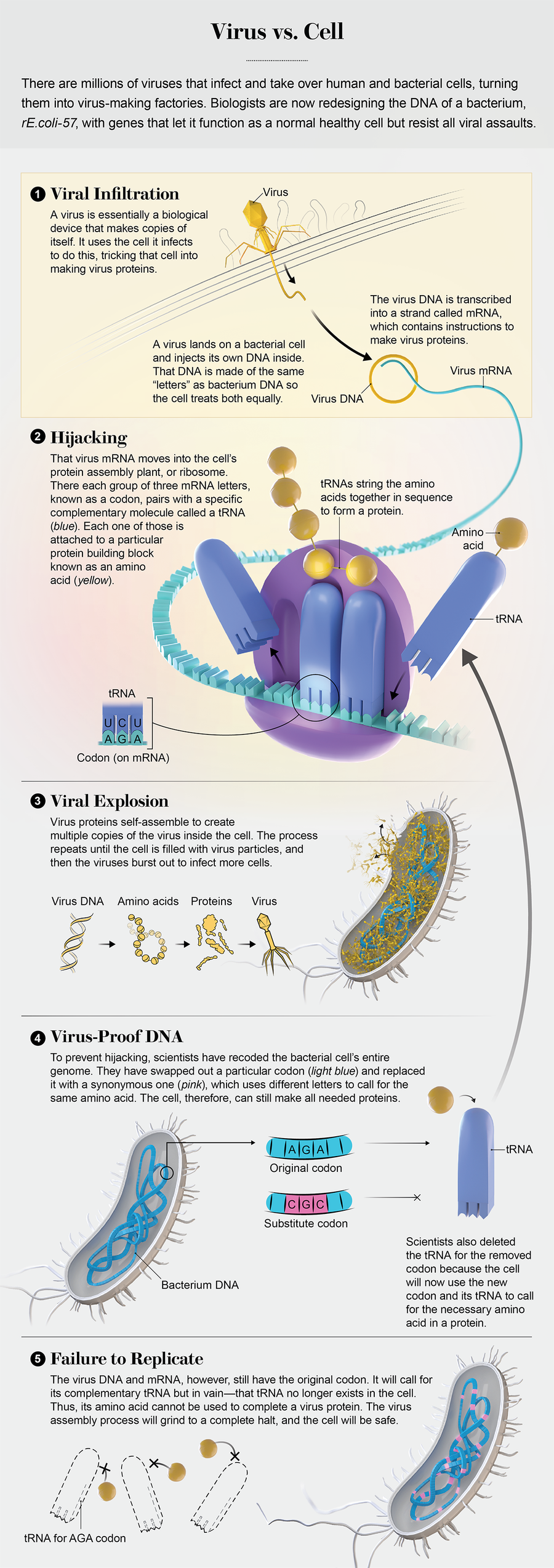
DNA 包含製造更多病毒的指令,這幾乎就是病毒的全部:一個蛋白質膠囊,裡面裝著構建自身更多副本的藍圖。病毒沒有構建新事物的分子機器。相反,它們闖入細胞並劫持細胞裝置,利用它進行復制,直到病毒數量過多,它們就會衝破細胞壁。它們可以做到這一點,因為從非洲平原上的犀牛到感染您鼻子的鼻病毒,所有生物都使用相同的編碼系統,該系統基於核酸,如 DNA。將程式碼輸入細胞,它將使用這些指令來構建蛋白質。
在受感染的細菌中,這個過程開始了。新的病毒蛋白成形。情況對 lambda 來說看起來不錯。幾分鐘之內,細胞就會充滿大量全新的病毒。當它們爆發時,每個病毒都會前往另一個細菌,旨在一次又一次地重複這個迴圈。
支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您正在幫助確保有關當今塑造我們世界的發現和想法的具有影響力的故事的未來。
然後細胞機器凍結了。它根本無法讀取病毒的 DNA。在病毒和細胞之間看似永恆的決鬥中,這種失敗從未發生過。現在這意味著 lambda 註定要失敗。
它滅亡的原因是這種大腸桿菌菌株已被重新程式設計為使用地球上從未存在過的 DNA 作業系統,而病毒程式碼與之不相容。這些差異使 lambda 像 Mac 中的 Windows 計算機病毒一樣無助。攻擊的其他病毒也會遭受同樣的命運。製造這種細菌及其新程式碼的人們相信,該功能將使其對所有病毒免疫。他們稱之為rE.coli-57。他們對此有宏偉的計劃。
rE.coli-57 正在哈佛醫學院的一個實驗室中由一位名叫尼莉·奧斯特羅夫的年輕生物學家領導的團隊構建。在過去的五年裡,奧斯特羅夫痴迷於細菌基因重建的每一個細節,在潮溼實驗室的熒光燈下投入了艱苦的工作時間。這是歷史上最精細的基因編輯專案,也是 2016 年科學雜誌一篇里程碑式論文的主題,該論文確定了使細胞具有抗病毒性所需的 148,955 個 DNA 變化。奧斯特羅夫的團隊已經完成了其中 63%,她和她的同事報告說,並且這個“野獸”表現良好。
三年後,重建的細胞幾乎準備就緒。不久之後,剛剛設想的場景將發生,不僅有一個,而是數百個病毒在一個培養皿中。如果 rE.coli-57 存活下來,它可能會永遠改變病毒與其獵物(包括我們)之間的關係。
病毒非常豐富,每平方米的地球表面都有 8 億個病毒覆蓋。它們用疾病困擾我們,但也折磨著使用細胞製造從酸奶到藥品等產品的行業。生物技術巨頭健贊(現為賽諾菲的一部分)使用細菌製造藥物分子,在 2009 年其位於馬薩諸塞州奧爾斯頓的工廠發生病毒感染破壞其生產線,引發關鍵藥物短缺後,市值損失了一半。病毒也是乳製品行業中代價高昂的禍害,該行業使用細菌發酵乳酪和酸奶——當細菌受到病毒汙染時,這些產品必須被傾倒。一種抗病毒細菌可能是一種價值數十億美元的“蟲子”。
這種細胞還可以開闢一個設計藥物的新世界。“如果我們想製造精美的抗體和精美的蛋白質藥物,我們需要將不同的化學物質融入其中,”奧斯特羅夫說。“這將是製藥公司的遊戲規則改變者。”所有天然蛋白質都由相同的 20 種氨基酸構成,但 rE.coli-57 的改變後的作業系統將允許它使用外來氨基酸構建新的蛋白質,就像新的樂高積木擴充套件了基本入門套裝可以構建的東西一樣。設計蛋白質可以以極高的精度靶向艾滋病或癌症等疾病。
更具爭議性的是,rE.coli-57 的成功可能是使人類細胞具有抗病毒性的第一步,方法是使其 DNA 不受病毒劫持。這項成就對醫學研究非常寶貴,醫學研究深受實驗室培養皿中用於開發和測試治療藥物的人類細胞系的病毒感染之苦。然而,懷疑論者懷疑重新編碼的細胞是否會像“正常”細胞一樣發揮作用,從而使它們成為不可靠的試驗平臺。這個想法也讓那些擔心這種重新編碼使我們離創造具有設計 DNA 的人類更近一步的人感到擔憂。(沒有人參與該專案提議設計人。)僅僅重新編碼一個人類實驗室培養皿細胞就會非常複雜,因為人類基因組長達 32 億個字母,比大腸桿菌大 800 倍。但 rE.coli 是至關重要且令人興奮的第一步。
程式碼破解者
重新編碼擊敗病毒入侵者的原因是它改變了細胞用來製造蛋白質的語言,蛋白質是所有生命用來完成世界上任何事情的分子。蛋白質由稱為氨基酸的較小單元組成,每個氨基酸都有一個三字母 DNA 程式碼,由四種 DNA 鹼基(A、C、G 和 T)的某種組合構成。例如,TGG 表示色氨酸,CAA 表示谷氨醯胺。這些三字母程式碼稱為密碼子,每個基因都只是它們的線性序列。
蛋白質的製造發生在序列被髮送到細胞工廠核糖體時,在那裡密碼子與稱為轉移 RNA (tRNA) 的分子配對。每個 tRNA 的一端與特定密碼子結合,另一端與一種且僅一種氨基酸結合。隨著密碼子序列在蛋白質組裝線上移動,tRNA 將氨基酸串在一起,直到蛋白質完成。
但是這個系統中有一個重要的特性:它有很多冗餘。有 64 個密碼子,因為 A、C、G 和 T 的三字母組合有 64 個。但只有 20 種氨基酸。這意味著大多數氨基酸都有多個程式碼。例如,AGG 代表精氨酸,CGA 也代表精氨酸。有些氨基酸有六個密碼子。
早在 2004 年,哈佛大學遺傳學家、奧斯特羅夫的老闆喬治·丘奇就開始懷疑所有這些密碼子是否絕對必要。如果將大腸桿菌基因組中的每個 AGG 都更改為 CGA 會怎樣?由於兩者都編碼精氨酸,細菌仍然會構建其所有正常蛋白質。但是——這是一個關鍵點——如果與 AGG 配對的 tRNA 也從細胞中消除,那麼 AGG 密碼子將成為蛋白質構建過程中的死衚衕。
當丘奇思考去除某些 tRNA 的影響時,他有了一個頓悟。“我意識到這將使細胞對所有病毒都具有抵抗力,”他說,“這將是一個潛在的巨大好處。” 諸如 lambda 之類的病毒透過讓細胞讀取病毒基因並使用這些序列構建蛋白質來繁殖。但是,如果從細胞中刪除 AGG 的 tRNA,那麼每個包含 AGG 密碼子的病毒基因都會卡住,等待不再存在的 tRNA,並且不會完成任何病毒蛋白。
病毒進化速度極快;丘奇懷疑它們會迅速繞過單個消失的 tRNA。但是,如果消除足夠的密碼子和 tRNA,病毒幾乎不可能自發地找到正確的突變組合來使用修改後的程式碼。大腸桿菌有七個相對罕見的密碼子。它們出現在其所有 3,548 個基因中,平均每個基因出現 17 次。如果消除所有相應的 tRNA,病毒將需要開發大約 60,000 個新序列,每個序列都要求在完全正確的位置使用正確的替代密碼子。這根本不可能發生。
2004 年,這種情況只是一種空想。在一個生物體中改變單個基因已經足夠困難了;編輯數千個基因以消除某些密碼子的每個例項是不可能的。但是到 2014 年,技術突破使這樣做剛剛處於可想象的邊緣。因此,丘奇開始尋找有動力和組織能力的人來承擔歷史上最大的基因編輯專案。
那時,奧斯特羅夫作為博士後研究員來到他的實驗室。如果說丘奇是 rE.coli-57 的架構師,那麼奧斯特羅夫就成了工程師和總承包商。奧斯特羅夫有很多分子構建經驗。她在以色列長大,就讀於特拉維夫大學,在那裡她透過新增幾個與金屬顆粒結合的氨基酸來修飾蛋白質。當幾個這些修飾的蛋白質結合在一起時,它們形成了一個可以導電的奈米線。“那太棒了,”奧斯特羅夫回憶道。“我想,哇,我們可以利用生物學來製造有用的東西。” 後來,在哥倫比亞大學,她透過工程改造麵包酵母以在檢測到致病微生物時產生紅色色素獲得了博士學位;該專案因其在霍亂檢測中的應用而獲得了比爾及梅琳達·蓋茨基金會的大挑戰探索獎。
這是一份令人印象深刻的簡歷,但丘奇的專案難度呈指數級增長。要消除的七個密碼子在大腸桿菌基因組中出現了 62,214 次。全部重新編碼需要對 DNA 進行 148,955 次更改。關於快速簡便的基因編輯有很多頭條新聞,但沒有基因編輯工具能夠進行接近那麼多更改。
然而,DNA 合成的突破指向了另一種解決方案:從頭開始構建重新編碼的大腸桿菌基因組。DNA 可以透過生物化學方法在特殊的 DNA 印表機中生產,DNA 印表機的工作原理類似於噴墨印表機噴射 A、C、G 和 T。今天的 DNA 合成公司可以可靠地製造長達約 4,000 個字母的 DNA 片段。
圖片來源:坎貝爾醫學插畫
大約在 2015 年,奧斯特羅夫的團隊從資料庫下載了標準大腸桿菌基因組(一長串四百萬個字母),並將其放在計算機上。然後研究人員瀏覽了整個序列,將所有 62,214 個罕見密碼子的例項更改為同義密碼子。(為了安全起見,他們還改變了基因,使細菌依賴於營養液中提供的合成氨基酸。這種合成分子在自然界中不存在,因此如果細菌逃出實驗室,就會死亡。)結果是新的 rE.coli-57 基因組在計算機螢幕上滾動。然後,科學家們將其四百萬個字母分成 4,000 個字母的片段,片段末端重疊,並將檔案傳送到 DNA 合成店。“我們在計算機上切割它,”奧斯特羅夫說,“就像 Word 文件一樣。” 該公司列印了 DNA 並透過聯邦快遞寄回。該團隊將這些 4,000 個字母的片段組裝成 87 個大的片段,每個片段 50,000 個字母,大約 40 個基因。
當然,這些片段只是 DNA,而 DNA 只是程式碼。需要一個細胞來將程式碼變為現實,沒有人知道如何完全從頭開始構建一個細胞。相反,奧斯特羅夫採取了分段式方法。她從正常大腸桿菌菌落開始,並緩慢地用重新編碼的片段逐個替換其基因組的每一部分,每次移植後都進行測試,以檢視患者是否存活。
重建細胞
在丘奇實驗室長長的黑色工作臺上,在離心機、渦旋混合器、移液器架和培養皿堆之間,奧斯特羅夫的團隊在宿舍冰箱大小的培養箱中培養了 87 個正常大腸桿菌菌落,將不同的 50,000 個字母的重新編碼片段插入到微生物群中,然後等待觀察它們是否會存活。她沒有抱太大希望。也許進化選擇其密碼子有其自身的原因,而這些原因逃脫了人類的理解。
令人驚訝的是,大多數菌落都表現良好。只有 20 個修訂後的片段阻止了微生物的生長。但 20 個片段還是太多了。為了使 rE.coli-57 具有抗病毒性,所有重新編碼的部分都必須工作。“首先,我們試圖縮小範圍,確定哪個特定基因不起作用,”奧斯特羅夫說。“我們將 40 個基因的片段分解為兩個 20 個基因的版本並進行了測試。然後我們縮小範圍到可能存在問題的四個基因。然後是一個基因。然後我們弄清楚哪個密碼子可能是問題所在。”
事實證明,大多數問題來自 DNA 列印錯誤。換句話說,奧斯特羅夫團隊收到的 DNA 序列與他們訂購的序列並不完全相同——直到最近,這在 DNA 合成中還是一個常見問題。奧斯特羅夫回到公司,獲得了新的無錯誤序列。在更換不良 DNA 後,超過 99% 的重新設計的基因都起作用了。看起來,重新編碼並不是一個瘋狂的想法。
但是,還有少數剩餘問題似乎是蛋白質或 DNA 功能的真正問題,而不是印表機上的質量控制。奧斯特羅夫必須弄清楚進化知道而她不知道的東西。為什麼改變為編碼完全相同氨基酸的同義密碼子會殺死或損害生物體?
排除這些點的故障就像在沒有地圖的荒野中開闢道路。例如,重新編碼的 21 區段細菌的繁殖速度慢得像爬行一樣。為什麼?因為沒有關於這些重新編碼的 DNA 片段的科學文獻來指導奧斯特羅夫——她的團隊是第一個重塑它們的團隊——她仔細分析了該區段中所有基因的效能,將它們的產品與正常細菌中的產品進行了比較。她發現五個相連的基因是完整的,但由於某種原因,它們沒有任何作用。

生物學家尼莉·奧斯特羅夫和她在哈佛大學的同事創造了 rE.coli-57,這是一種原本正常的大腸桿菌,在其基因組中進行了近 150,000 次 DNA 更改,旨在使其具有抗病毒性。圖片來源:斯蒂芬·史蒂文斯
事實證明,這是一個與基因等效於開關的問題。基因前面是稱為啟動子的 DNA 序列,啟動子控制基因是否活躍。在更高階的生命形式中,啟動子和基因被清晰地劃分,具有明顯的起點和終點,但有時細菌基因會重疊;一個基因末端的 DNA 序列實際上兼作下一個基因的開頭。奧斯特羅夫發現,基因 yceD 中的 DNA 序列兼作其後五個基因的啟動子(開關)。透過重新編碼 yceD,她不小心關閉了它們。她在 yceD 上更改了三個密碼子,使其 DNA 更接近已知強啟動子的設計。這五個基因的輸出激增,細菌開始正常繁殖。
奧斯特羅夫的團隊在重新編碼的 44 區段中遇到了更嚴峻的挑戰,該區段完全殺死了其菌落。研究人員將問題區域縮小到一個名為 accD 的基因,細菌使用該基因製造脂肪酸。重新編碼的細胞根本沒有製造任何 accD 蛋白質。奧斯特羅夫對重新編碼的基因進行了設計分析,並猜測問題出在其序列的開頭。在 DNA 中,A 和 T 自然結合,G 和 C 也自然結合。(在 mRNA 中,DNA 用來向蛋白質製造核糖體傳送程式碼的分子,縮寫為 U 的鹼基代替了 T,它以相同的特異性與 A 結合。)如果字母以某種順序排列——比如,很多 A,然後是很多 T——分子的末端會像不乾膠帶一樣自身摺疊,並堵塞細胞機器。在她的計算機上,奧斯特羅夫重新設計了該基因,將其 15 個重新編碼的密碼子中的 10 個修改為其他同義密碼子,這些密碼子似乎不太可能形成粘性摺疊。當她將新的 DNA 片段插入細菌中時,菌落又恢復了生機。
就這樣,一次又一次的故障排除練習,研究人員像機械師一樣思考,同時對生物學進行修補,始終遵循工程師的設計-構建-測試迴圈。值得注意的是,沒有出現任何交易破壞者。“到目前為止,我們還沒有遇到任何不可能的點,”奧斯特羅夫說。“程式碼給了我們很大的迴旋餘地。”
抗病毒
今年,在將一個菌株的工作基因片段新增到另一個菌株的工作片段後,奧斯特羅夫將最初的 87 個菌株變成了 8 個健康菌系,每個菌系都有完全重新編碼基因組的八分之一。每次科學家組合片段時,都會出現新的不相容性,並且必須進行故障排除。但在早春,八條菌系迅速合併為四條,朝著兩條前進。不久之後,將出現一種 100% 重新編碼的 rE.coli-57 菌株。
一旦該菌株啟動並執行,最後一步將是消除與缺失密碼子相關的 tRNA。細胞會很好,因為它的基因將使用仍然存在的同義 tRNA。但是,傳入的病毒應該不會好。其尚未經過重新設計的基因將具有一些密碼子,這些密碼子需要不再存在的 tRNA。沒有 tRNA 意味著在蛋白質構建序列的該點沒有氨基酸,這會停止組裝。沒有新的病毒蛋白,就沒有病毒的新副本。病毒 DNA 仍然被困在細胞內部,孤立無援,無法複製和造成任何傷害。
奧斯特羅夫計劃在一部微觀版本的舊電影《衝鋒飛車隊續集》中測試這種情況,在該電影中,一位英雄被困在一個競技場中,必須擊敗一系列攻擊者。這個競技場將是一個小型玻璃容器。生物學家會將 lambda 新增到裝有健康 rE.coli-57 菌落的培養皿中。然後他們會退後一步,讓生物體戰鬥至死。如果 rE.coli 存活下來,研究人員將新增另一種以細菌為食的病毒,然後再新增另一種。很難想象即使是最有天賦的病毒也能破解 rE.colts 經過精心修改的程式碼。但話又說回來,還沒有病毒被迫嘗試過。兩個生物將進入——一個將離開。
奧斯特羅夫太謹慎了,無法確定比賽的日期,因為她還沒有獲得單一完全重新編碼的菌株,但她相信她和她的團隊即將成功。“遲早會發生,”她說。“絕對會。” 她暗示,她喜歡的巴西雞尾酒慶祝活動可能很快就會到來。“完成時,我不會保持沉默。我會用一隻手拿著凱匹林納雞尾酒從海灘打電話。”
僅病毒免疫力就足以讓 rE.coli-57 值得慶祝,但正如奧斯特羅夫和她的同事在他們的科學論文中指出的那樣,這種細菌還將提供“一種獨特的底盤,具有擴充套件的合成功能,將廣泛適用於生物技術”。換句話說,這種微生物將成為組裝新型蛋白質的靈活平臺。
這可能是藥物開發的福音。許多癌症和免疫療法藥物是蛋白質,它們在體內會迅速分解,但用外來氨基酸重建它們可以大大延長其壽命。丘奇已經成立了一家名為 GRO Biosciences(首字母縮寫詞代表“基因組重新編碼的生物體”)的初創公司,以設計此類療法。
改變的生命
再過幾年,重新編碼的抗病毒人類細胞的願景就會出現。這些細胞可以解決整個醫學研究中使用的培養人類細胞系(例如著名的海拉細胞癌細胞)的病毒汙染這一長期存在的問題。在實驗室中,人類細胞系經常被用作開發新藥和治療想法的試驗平臺。但是,一旦病毒感染了這些細胞,就幾乎不可能擺脫它們,因此實驗被丟棄,科學家別無選擇,只能重新開始。如果療法能夠更快地開發出來,它們將挽救生命。卓越工程生物學中心是一個全球合作專案,丘奇是創始成員,已將重新編碼的人類細胞命名為其初始專案。rE.coli-57 顯然將是該道路上的墊腳石。
毫不奇怪,重新設計人類細胞作業系統的想法讓一些批評家感到擔憂。一方面,這些細胞可能不是天然細胞的可靠模仿。儘管該中心的科學家從未提議對培養細胞系以外的細胞做任何事情,但有可能創造出一個重新編碼的人類,他也可能具有抗病毒性。
哥倫比亞大學病毒學家文森特·拉卡涅洛說,這將是很糟糕的,他在他的科學部落格上批評了這個想法。“多種密碼子的存在是有原因的——其中之一是它們提供了對抗致命突變的緩衝,”他寫道。“以這種方式重新編碼人類基因組不太可能沒有嚴重的副作用。”
該專案的科學家都沒有建議魯莽地編輯嬰兒的 DNA 並觀察會發生什麼,就像去年在中國發生的那樣。他們所說的是,對重新編碼的人類細胞的行為進行仔細、透明的研究可以讓我們對我們與許多最有害疾病之間的關係有全新的認識。在我們地球上的所有時間裡,我們一直受困於 64 密碼子系統——以及利用它的致病病毒。幾年後,我們可能會知道我們是否必須接受這種情況。
奧斯特羅夫不是該中心專案的一部分——“澄清一下,我不重新編碼人類細胞”——但她說,安全地在實驗室培養皿中探索遺傳未知很重要。“顯然,進化選擇它所擁有的密碼子是有原因的。但我們知道還有其他可行的選擇,”她說。“透過改變它們,我們可以調查會發生什麼。我們將看到什麼有效,什麼無效,我們將更好地理解規則。” 瞭解這些原則可能會讓我們有機會改進一些使用它們的生物體。

