編者注(2017 年 10 月 2 日):在三位美國科學家因其在生物鐘方面的研究獲得諾貝爾生理學或醫學獎的十七年前,其中一位科學家邁克爾·W·楊在《大眾科學》雜誌上撰文,描述了鑑定出“分子時鐘”的遺傳學研究,這些“分子時鐘”在整個動物王國中無處不在。如果您有興趣瞭解晝夜節律的生物學——誰沒有遭受過時差之苦呢?——楊在此處或許提供了關於這些研究如何展開的最引人入勝且最易理解的故事。請閱讀這篇關於尋找分子時鐘的清晰描述,《大眾科學》早在三位研究人員前往斯德哥爾摩應對時差反應的二十年前就為您帶來了這篇描述。
您必須與晚上 7:00 昏昏欲睡的衝動作鬥爭。下午 3 點您飢腸轆轆,但晚餐時卻沒有食慾。您在凌晨 4:00 醒來,無法再次入睡。許多從美國東海岸飛往加利福尼亞州的人都熟悉這種情況,這次旅行需要跨越三個小時的時差。在為期一週的商務旅行或假期中,您的身體剛剛適應新的作息時間,就又要返回家鄉了,在那裡您必須再次適應舊的作息時間。幾乎每天,我的同事和我都會讓一批果蠅經歷從紐約到舊金山或返回的模擬旅行的時差。我們在實驗室裡有幾個冰箱大小的培養箱:一個標記為紐約,另一個標記為舊金山。這些培養箱內的燈光會隨著這兩個城市日出日落而亮起和熄滅。(為了保持一致性,我們將兩個地點的日出時間都安排在早上 6 點,日落時間都安排在下午 6 點。)兩個培養箱的溫度恆定,宜人的 77 華氏度。
果蠅在裝在特殊托盤中的小玻璃管中進行模擬旅行,這些托盤透過窄束紅外光監測它們的運動。每當果蠅進入光束時,它會在托盤中的光電電晶體上投下陰影,該光電電晶體連線到記錄活動的計算機。從紐約時間到舊金山時間並不需要我們的果蠅進行五個小時的飛行:我們只需斷開一個裝滿果蠅的托盤在一個培養箱中的連線,將其移動到另一個培養箱並插入即可。
支援科學新聞事業
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞事業 訂閱。 透過購買訂閱,您將有助於確保有關塑造我們當今世界的發現和想法的具有影響力的故事的未來。
我們已經使用我們的橫貫大陸特快列車來識別和研究幾種基因的功能,這些基因似乎是生物鐘運轉中的齒輪和輪子,生物鐘控制著包括果蠅在內的各種生物的晝夜節律,以及小鼠和人類。 識別基因使我們能夠確定它們編碼的蛋白質——這些蛋白質可能成為治療各種疾病的靶點,從睡眠障礙到季節性抑鬱症。
人類生物鐘的主要齒輪是視交叉上核 (SCN),它是位於大腦底部稱為下丘腦區域的一組神經細胞。 當每天早晨光線照射到眼睛的視網膜時,專門的神經會將訊號傳送到 SCN,SCN 反過來控制多種生物活性物質的生產週期。 例如,SCN 會刺激附近稱為松果體的腦區。 根據來自 SCN 的指令,松果體有節奏地產生褪黑激素,即所謂的睡眠激素,現在許多保健食品商店都有藥丸形式出售。 隨著白天進入夜晚,松果體逐漸開始產生更多的褪黑激素。 當血液中激素水平升高時,體溫會略有下降,並且入睡的傾向會增加。
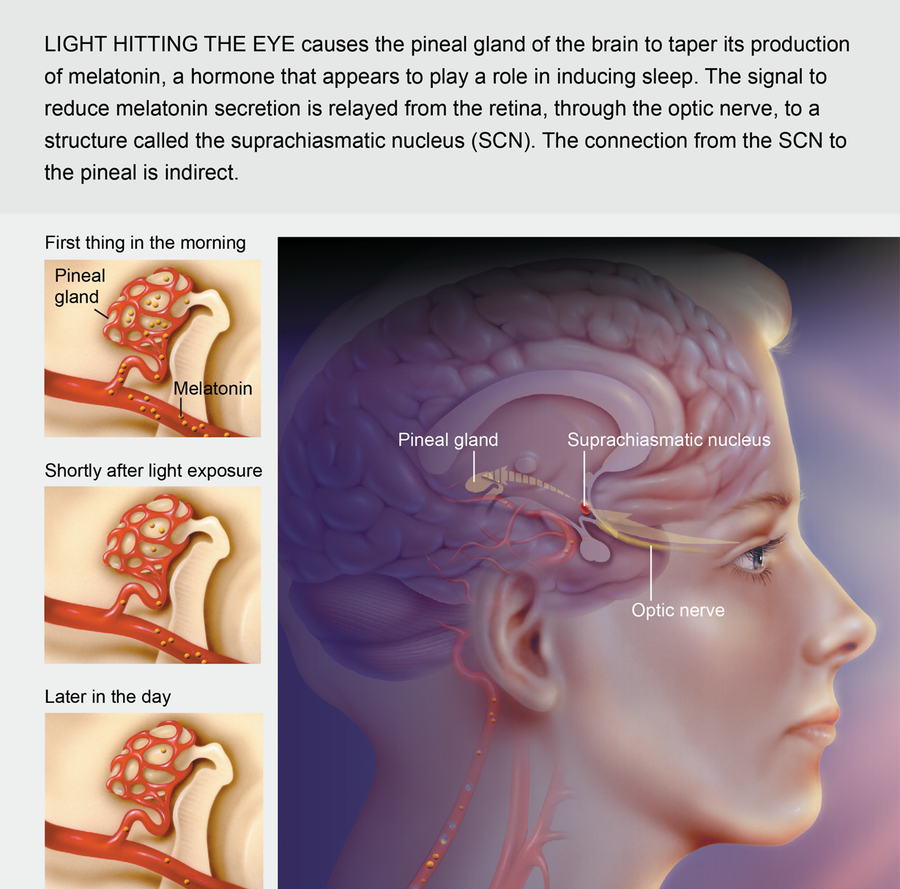
來源:Cynthia Turner
人類時鐘
儘管光線似乎每天都會重置生物鐘,但晝夜節律或晝夜節律即使在被剝奪光線的個體中也會繼續運作,這表明 SCN 的活動是天生的。 在 20 世紀 60 年代初期,當時在德國 Seewiesen 馬克斯·普朗克行為生理學研究所的 Jürgen Aschoff 及其同事表明,生活在隔離掩體中的志願者——沒有自然光、時鐘或其他關於時間的線索——仍然保持著大約 25 小時的正常睡眠-覺醒週期。
最近,哈佛大學的 Charles Czeisler、Richard E. Kronauer 及其同事確定,人類的晝夜節律實際上更接近 24 小時——確切地說是 24.18 小時。 科學家們研究了 24 名男性和女性(其中 11 人 20 多歲,13 人 60 多歲),他們在除了人為設定為 28 小時的微弱光暗迴圈之外沒有時間線索的環境中生活了三個多星期,該迴圈為受試者提供了就寢訊號。
他們測量了參與者的核心體溫,這通常在夜間下降,以及褪黑激素和一種稱為皮質醇的應激激素的血液濃度,皮質醇在傍晚下降。 研究人員觀察到,即使受試者的日子被異常延長了四個小時,他們的體溫和褪黑激素以及皮質醇水平仍繼續按照他們自己的內部 24 小時晝夜節律時鐘運作。 更重要的是,年齡似乎對時鐘的滴答聲沒有影響:與之前的研究結果(表明衰老會擾亂晝夜節律)不同,哈佛研究中老年受試者的體溫和激素波動與年輕組一樣規律。
儘管掩體研究提供了豐富的資訊,但為了研究生物鐘的基因,科學家們不得不轉向果蠅。 果蠅是基因研究的理想選擇,因為它們壽命短且體型小,這意味著研究人員可以在實驗室中繁殖和雜交數千只果蠅,直到出現有趣的突變。 為了加速突變過程,科學家通常會將果蠅暴露於稱為誘變劑的引起突變的化學物質。
最早顯示晝夜節律改變的果蠅突變體是在 20 世紀 70 年代早期由加州理工學院的 Ron Konopka 和 Seymour Benzer 鑑定的。 這些研究人員將誘變劑餵給一些果蠅,然後監測 2,000 只後代的運動,部分使用了與我們現在在紐約到舊金山實驗中使用的裝置形式相同的裝置。 大多數果蠅具有正常的 24 小時晝夜節律:昆蟲每天活動大約 12 小時,休息另外 12 小時。 但其中三隻果蠅發生了突變,導致它們打破了這種模式。 一隻果蠅的週期為 19 小時,一隻果蠅的週期為 28 小時,第三隻果蠅似乎根本沒有晝夜節律,休息和活動似乎是隨機的。
時光飛逝
1986 年,我在洛克菲勒大學的研究小組和由布蘭代斯大學的 Jeffrey Hall 和霍華德·休斯醫學研究所的 Michael Rosbash 領導的另一個研究小組發現,這三隻突變果蠅在單個基因period(或per)中具有三種不同的改變,我們每個團隊都在兩年前獨立分離出了該基因。 由於同一基因的不同突變導致了這三種行為,我們得出結論,per以某種方式積極參與了果蠅晝夜節律的產生以及節律速度的設定。
在分離出per後,我們開始質疑該基因是否單獨作用於控制晝夜節律。 為了找出答案,我在實驗室的兩名博士後研究員 Amita Sehgal 和 Jeffrey Price 篩選了 7,000 多隻果蠅,看看他們是否能識別出其他節律突變體。 他們最終發現了一隻果蠅,它像其中一隻per突變體一樣,沒有明顯的晝夜節律。 新的突變被證明發生在 2 號染色體上,而per已被定位到 X 染色體。 我們知道這必須是一個新基因,我們將其命名為timeless,或tim。
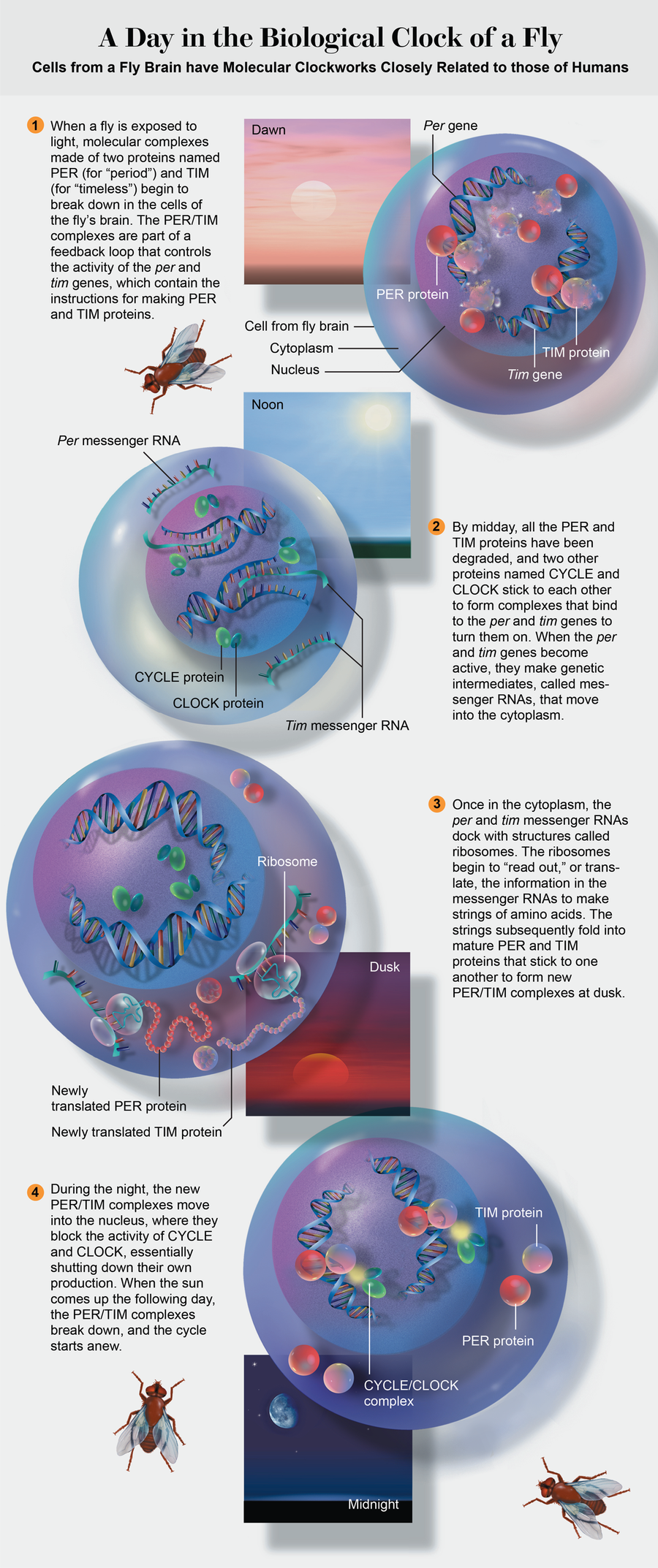
來源:Cynthia Turner
但是新基因與per有什麼關係呢? 基因由 DNA 組成,DNA 包含製造蛋白質的指令。 DNA 永遠不會離開細胞核; 它的分子配方以信使 RNA 的形式讀出,信使 RNA 離開細胞核並進入細胞質,在那裡製造蛋白質。 我們使用tim和per基因在實驗室中製造了 PER 和 TIM 蛋白。 與哈佛醫學院的 Charles Weitz 合作,我們觀察到,當我們混合這兩種蛋白質時,它們會粘在一起,這表明它們可能在細胞內相互作用。
在一系列實驗中,我們發現 PER 和 TIM 蛋白的產生涉及類似時鐘的反饋迴路參見左圖。 per和tim基因在它們的蛋白質濃度變得足夠高之前一直處於活躍狀態,以至於兩者開始相互結合。 當它們結合時,它們形成複合物,進入細胞核並關閉製造它們的基因。 幾個小時後,酶會降解複合物,基因再次啟動,迴圈重新開始。
撥動時間之手
一旦我們發現了兩個協同作用以製造分子時鐘的基因,我們就開始想知道如何重置時鐘。 畢竟,我們的睡眠-覺醒週期完全適應跨越任意數量時區的旅行,即使調整可能需要幾天或幾周的時間。
那時我們開始在紐約和舊金山培養箱之間來回穿梭果蠅托盤。 我們和其他人首先注意到的一件事是,每當將果蠅從黑暗的培養箱移到明亮的培養箱中以模擬日光時,果蠅大腦中的 TIM 蛋白就會在幾分鐘內消失。
更有趣的是,我們注意到果蠅旅行的方向會影響其 TIM 蛋白的水平。 如果我們在當地時間晚上 8 點(天黑時)將果蠅從紐約取出,然後將它們放入舊金山(當地時間下午 5 點仍然是白天),它們的 TIM 水平會驟降。 但一小時後,當舊金山的燈熄滅時,TIM 開始重新積累。 顯然,果蠅的分子時鐘最初因轉移而停止,但在延遲後,它們在新時區的模式下恢復滴答作響。
相比之下,凌晨 4 點從舊金山移動的果蠅在被放置在紐約時經歷了過早的日出,當時是早上 7 點。 這種移動也導致 TIM 水平下降,但這次蛋白質沒有開始再次積累,因為分子時鐘因時區切換而提前。
透過檢查tim RNA 的產生時間,我們更多地瞭解了不同分子反應背後的機制。 tim RNA 的水平在當地時間晚上 8 點左右最高,在早上 6 點到 8 點之間最低。 當地時間晚上 8 點從紐約飛往舊金山的果蠅正在產生最高水平的tim RNA,因此在舊金山暴露於光線下損失的蛋白質很容易在新地點的日落後得到補充。 然而,凌晨 4 點從舊金山飛往紐約的果蠅在出發前產生的tim RNA 非常少。 果蠅經歷的過早日出消除了 TIM,並允許下一個生產週期以更早的時間表開始。
不僅僅是蟲子
讓果蠅產生時差對於理解包括人類在內的哺乳動物的晝夜節律具有直接意義。 1997 年,由東京大學的 Hajime Tei 和神戶大學的 Hitoshi Okamura 領導的研究人員,以及貝勒醫學院的 Cheng Chi Lee 獨立地分離出了小鼠和人類的per等效物。 另一波工作,這次涉及許多實驗室,在 1998 年發現了小鼠和人類形式的tim。 這些基因在視交叉上核中處於活躍狀態。

來源:Cynthia Turner
涉及小鼠的研究也有助於回答一個關鍵問題:是什麼首先開啟了per和tim基因的活性? 1997 年,西北大學霍華德·休斯醫學研究所的 Joseph Takaha-shi 及其同事分離出一個他們稱為Clock的基因,該基因突變後會產生沒有明顯晝夜節律的小鼠。 該基因編碼一種轉錄因子,一種在這種情況下與 DNA 結合並允許將其讀出為信使 RNA 的蛋白質。
此後不久,小鼠Clock基因的果蠅版本被分離出來,各個研究小組開始將per、tim和Clock基因的組合引入哺乳動物和果蠅細胞。 這些實驗表明,CLOCK 蛋白靶向小鼠中的per基因和果蠅中的per和tim基因。 該系統已經形成了一個完整的迴圈:在時鐘最易理解的果蠅中,CLOCK 蛋白——與一個名為cycle的基因編碼的蛋白質結合——結合並激活per和tim基因,但前提是細胞核中不存在 PER 和 TIM 蛋白。 這四個基因及其蛋白質構成了果蠅生物鐘的核心,並且經過一些修改,它們似乎形成了控制整個動物王國(從魚類到青蛙、小鼠到人類)晝夜節律的機制。
最近,哈佛大學的 Steve Reppert 小組和我實驗室的 Justin Blau 開始探索將小鼠和果蠅生物鐘與各種行為、激素波動和其他功能的時間聯絡起來的具體訊號。 似乎一些輸出基因是透過與 CLOCK 蛋白的直接相互作用而開啟的。 PER 和 TIM 阻止 CLOCK 開啟這些基因的能力,同時它們產生中央反饋迴路的振盪——建立基因活性迴圈的擴充套件模式。
未來一個令人興奮的前景是恢復果蠅和小鼠等生物體中受時鐘調節的整個基因系統。 很可能在這些網路中會發現以前未表徵的基因產物,這些產物對行為具有有趣的影響。 也許其中之一,或分子時鐘本身的組成部分,將成為緩解時差、輪班工作副作用或睡眠障礙和相關抑鬱症的藥物的首選靶點。 將來有一天,適應從紐約到舊金山的旅行可能會容易得多。
生物鐘
作者回答了一些關鍵問題
生物鐘在哪裡? 在哺乳動物中,控制晝夜節律(稱為晝夜節律的晝夜活動週期)的主時鐘位於大腦中稱為視交叉上核 (SCN) 的一部分。 但其他地方的細胞也顯示出時鐘活動。
是什麼驅動時鐘? 在單個 SCN 細胞內,專門的時鐘基因由它們在具有 24 小時節律的反饋迴路中編碼的蛋白質開啟和關閉。
生物鐘是否依賴於正常的 24 小時晝夜迴圈? 不。 時鐘基因活動的分子節律是天生的且自我維持的。 它們在沒有晝夜環境迴圈的情況下仍然存在。
光在調節和重置生物鐘中起什麼作用? 白天視網膜吸收的強光有助於將時鐘基因的活動節律與流行的環境週期同步。 夜間暴露於強光會透過急性改變某些時鐘基因產物的量來重置晝夜節律。
分子時鐘如何調節個體的晝夜活動? 時鐘基因合成的波動蛋白控制著額外的遺傳途徑,這些途徑將分子時鐘與動物生理和行為的定時變化聯絡起來。
無處不在的時鐘
它們不僅僅存在於大腦中
關於動物生物鐘的大部分研究都集中在大腦上,但這並不是唯一觀察晝夜節律的器官。
俄勒岡州立大學的 Jadwiga Giebultowicz 在果蠅腎臟狀的馬氏管中鑑定出了 PER 和 TIM 蛋白——生物鐘的關鍵組成部分。 她還觀察到這些蛋白質是根據晝夜節律產生的,夜間升高,白天下降。 即使在斬首的果蠅中,這種迴圈仍然存在,這表明馬氏管細胞不僅僅是對昆蟲大腦的訊號做出反應。
此外,加利福尼亞州拉霍亞斯克裡普斯研究所的 Steve Kay 研究小組發現了果蠅翅膀、腿、口腔區域和觸角中生物鐘的證據。 透過將指導熒光 PER 蛋白產生的基因轉移到活果蠅中,Kay 和他的同事表明,每個組織都攜帶一個獨立的、感光的時鐘。 即使每個組織從昆蟲身上解剖下來,這些時鐘仍然繼續發揮作用並對光做出反應。
顱外生物鐘不僅限於果蠅。 日內瓦大學的 Ueli Schibler 在 1998 年表明,大鼠結締組織細胞(稱為成纖維細胞)的 per 基因根據晝夜節律活躍。
顯示晝夜節律時鐘活性的各種細胞型別的多樣性表明,對於許多組織來說,正確的時間安排非常重要,值得在本地跟蹤。 這些發現可能會給術語“生物鐘”賦予新的含義。 — M.W.Y.
