生物化學家克雷格·克魯斯首次設法用一種奇異的新化合物讓蛋白質按指令消失時,他說他認為這是一種“客廳把戲”,“一種有趣的化學奇觀”。
今天,這種有趣的把戲正在推動羅氏、輝瑞、默克、諾華和葛蘭素史克等製藥公司數十億美元的投資。“我認為你可以推斷,幾乎每家公司都在這個領域有專案,”位於加利福尼亞州千橡市安進公司全球研究高階副總裁,也是克魯斯早期合作者之一的雷蒙德·德沙耶斯說。
這種名為靶向蛋白質降解的藥物策略,利用了細胞清除不需要或受損蛋白質的自然系統。這些蛋白質降解劑形式多樣,但今年即將進入臨床試驗的一種型別是克魯斯在耶魯大學(位於康涅狄格州紐黑文市)花費 20 多年開發的一種:蛋白水解靶向嵌合體,或 PROTAC。
支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們當今世界的發現和想法的具有影響力的故事的未來。
PROTAC 龐大而笨重,與傳統藥物的認知相悖。但它們也提出瞭解決一些最頑固疾病的可能性。因為它們破壞而不是抑制蛋白質,並且可以在其他藥物無法結合的地方與蛋白質結合,所以蛋白質降解劑有可能被用來攻擊藥物開發商長期以來認為“不可成藥”的靶標:癌症的罪魁禍首,如 MYC 蛋白,或在阿爾茨海默病中纏結的 tau 蛋白。
英國鄧迪大學的生物化學家阿萊西奧·丘利說:“這是一個新的領域。“我們正在打破我們認為可成藥的規則。”
該領域有理由感到樂觀。2014 年,科學家發現,多發性骨髓瘤治療藥物來那度胺 (Revlimid) 是世界上最暢銷的藥物之一,其工作方式與蛋白質降解劑類似,可以分解兩種以前無法觸及的蛋白質。
然而,該領域缺乏已發表的資料來證實 PROTAC 和其他新興化合物可以使不可成藥的蛋白質消失。而且,關於這些奇特的分子在體內如何以及在何處發揮作用,仍然存在疑問。
目前,所有人的目光都集中在 Arvinas 身上,這是一家由克魯斯在康涅狄格州紐黑文市創立的生物技術公司。該公司計劃開始測試一種用於治療前列腺癌的 PROTAC,儘管它攻擊的是一種已被其他藥物成功靶向的蛋白質。“我們正處於證明這些 PROTAC 可以成為藥物的風口浪尖,”Arvinas 公司生物學高階副總裁伊恩·泰勒說。“緊隨其後的是:我們能否用不可成藥的蛋白質做到這一點?”
學術練習
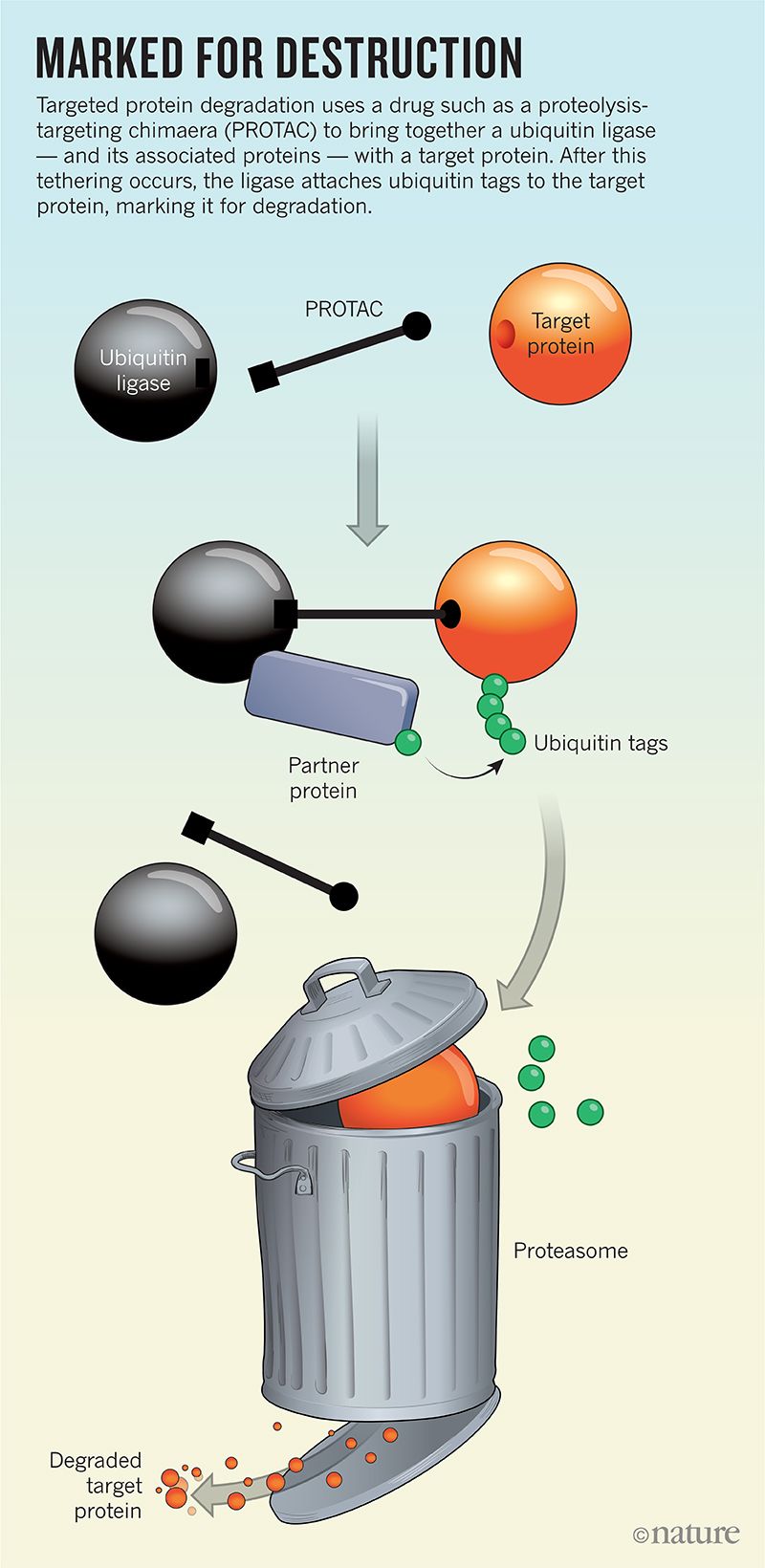
在示意圖中,PROTAC 通常看起來像啞鈴。它們是由兩個結合端透過一條細細的繫繩連線而成的分子。
作用發生在末端。一個抓住靶蛋白,而另一個抓住泛素連線酶——細胞自然垃圾處理系統的一部分,該系統透過在缺陷或受損蛋白質上貼上一種名為泛素的小蛋白質來標記它們(參見標記以銷燬)。泛素標籤就像“請收集”標籤,指示細胞的蛋白質粉碎機(稱為蛋白酶體)執行其工作。
來源:自然
鄰近性在生物學中佔很大比重,因此透過簡單地將連線酶和靶蛋白聚集在一起,PROTAC 確保靶標將被標記以進行破壞。連線酶是高效的,而泛素(顧名思義)是豐富的,因此單個 PROTAC 應該能夠在整個細胞中重複執行其捕獲和釋放功能,這表明只需要少量此類藥物即可產生強大的活性。
最早公開的 PROTAC 樣分子的描述是在 1999 年由馬里蘭州蓋瑟斯堡的 Proteinix 生物技術公司的兩位科學家提交的專利中。在該專利中(參見 go.nature.com/2vyjf9l),約翰·肯頓和史蒂文·羅伯茨提出了利用細胞蛋白質降解系統的想法。同事們對這個想法不屑一顧,稱肯頓和羅伯茨試圖同時結合兩種蛋白質——不需要的蛋白質和連線酶——從而使藥物發現複雜化。“內部對此並沒有太大的熱情,”肯頓回憶說,他現在是馬里蘭州羅克維爾市 Meso Scale Diagnostics 的研究主管。Proteinix 沒有繼續採用這種方法。
但在美國的另一邊,另一對頭腦正在思考同樣的想法。在 1998 年在華盛頓州西北部 Semiahmoo 灣風景優美的度假村舉行的研究務虛會上,德沙耶斯停在克魯斯的海報前,聽他談論使用小分子將兩種蛋白質連線在一起。德沙耶斯當時是加利福尼亞理工學院帕薩迪納分校的生物化學家,他深入研究了泛素連線酶。人類基因組編碼大約 600 個泛素連線酶,它們需要與其他蛋白質形成複合物才能進行標記。大約一年前,德沙耶斯共同發現了一個蛋白質家族,現在已知包含 250 個泛素連線酶。
“突然想到,嗯,如果你可以將物質連線到泛素連線酶,那麼你就可以潛在地驅動蛋白質的泛素化——及其降解,”德沙耶斯回憶道。他和克魯斯整個週末都在繼續聊天,並分手製定了一個計劃,以尋找資金來探索這個想法。
當時,克魯斯正在開發一種與 PROTAC 工作方式相反的藥物。它阻斷細胞中的泛素系統,導致蛋白質積累到危險水平,並最終觸發細胞死亡。這項工作的成果卡非佐米 (Kyprolis) 現在被用於治療血液癌症多發性骨髓瘤。“我認為另一方面也會同樣有趣,”克魯斯說。“事實證明確實如此。”
克魯斯和德沙耶斯很快發表了一項研究,證明他們的第一個 PROTAC Protac-1 成功地抓取並導致了來自非洲爪蟾蛙卵提取物中一種稱為 METAP2 的癌症相關蛋白質的降解。
克魯斯說,儘管如此,Protac-1 離成為藥物還差得很遠,他稱這篇論文為“學術練習”。第一代 PROTAC 在人體細胞中的活性較低,可能是因為這些化合物很難進入細胞內部。它們依靠大型、笨重的肽來結合連線酶。科學家們必須找到一種方法,使連線酶結合端更像藥物——“有可能成為藥物的東西,”克魯斯說。或者他們需要繼續前進。
在倫敦葛蘭素史克的資助和研究支援下,克魯斯繼續前進,主要針對一種特定的連線酶,即 von Hippel-Lindau 病腫瘤抑制因子 (VHL)。2012 年,克魯斯與他的研究生丹尼斯·巴克利和丘利(克魯斯實驗室的前訪問學者)一起,報告了一種針對 VHL 的小分子結合劑。克魯斯終於開始相信 PROTAC 真的可以成為藥物。
尋找小分子
克魯斯並不是唯一一個追逐蛋白質降解劑的人。2010 年,在馬薩諸塞州波士頓的丹娜-法伯癌症研究所,化學生物學家詹姆斯·布拉德納閱讀了一篇由日本研究人員團隊撰寫的論文,該團隊由當時在橫濱東京工業大學的半田裕志領導。半田一直在試圖瞭解臭名昭著的藥物沙利度胺(在 1950 年代末和 1960 年代初在一些國家獲批用於幫助緩解妊娠期噁心)為何會導致肢體發育問題。(它現在被批准用於治療多發性骨髓瘤和皮膚病。)半田使用沙利度胺作為誘餌來捕獲細胞中的蛋白質,發現該藥物與一種名為 cereblon 的泛素連線酶結合並阻止其活性。他的團隊發現,這種抑制作用會影響斑馬魚和小雞的肢體生長和發育。
布拉德納意識到,如果沙利度胺與泛素連線酶結合——這並非易事,因為此類酶出了名的難以捕獲——那麼也許他可以找到一種方法與同一連線酶結合,但將其靶向與疾病相關的蛋白質。2013 年,巴克利作為博士後研究員加入了布拉德納的團隊,他們開始尋找與 cereblon 結合的小分子。
在 2015 年 5 月和 6 月,由布拉德納、丘利和克魯斯領導的三個團隊發表了五篇獨立的論文,描述了具有強大、類似藥物活性的新型小分子 PROTAC。克魯斯與葛蘭素史克的伊恩·徹徹一起,將 PROTAC 與 VHL 結合,並用它將幾種蛋白質的水平降解至不到未處理細胞中存在的 10%。布拉德納和他的同事將 cereblon 與他們的 PROTAC 結合,以降低一種致癌蛋白質的水平,丘利當時在鄧迪大學,他的團隊使用 VHL 作為連線酶,降解了相同的蛋白質。蛋白質降解劑在培養皿中的細胞和老鼠的人類腫瘤中均有效。
除了設計類似藥物的蛋白質降解劑外,克魯斯和布拉德納的團隊都構建了系統——分別是 HaloPROTAC 和 dTAG——使研究人員能夠將靶向蛋白質降解作為實驗室中的工具來使用,使用基因標籤來標記培養細胞和小鼠中的蛋白質以進行破壞。化學家 Behnam Nabet 說,使用 dTAG,“您可以在幾分鐘或幾小時內耗盡一種蛋白質,並監測會發生什麼”,他與丹娜-法伯癌症研究所的 Nathanael Gray 一起領導了該系統的開發。“這為您研究癌基因、激酶和具有非常快速活性的蛋白質提供了強大的力量。”Nabet 說,dTAG 材料目前免費提供:超過 150 個學術實驗室使用該探針來研究耗盡細胞中特定蛋白質的影響。
布拉德納於 2016 年離開丹娜-法伯,成為諾華生物醫學研究所所長,他估計大約 30 種獨立的工具已經採用了這項技術。“化學探針的道路現在已經確立,”他說。“但是,用這些配體制造現實世界的藥物的挑戰是巨大的。”
淘金熱
在 2015 年小分子 PROTAC 的熱潮之後,已經離開該領域的德沙耶斯撰寫了一篇評論文章,宣佈 PROTAC 有可能成為一類主要的新型藥物,可能超過蛋白質激酶抑制劑和單克隆抗體這兩個有史以來最熱門的藥物開發領域。“淘金熱開始了!”德沙耶斯當時寫道。
從那時起,他說,這種情況只會愈演愈烈。他於 2017 年加入安進公司,現在負責監督該公司在該領域的工作。
泰勒說,Arvinas 試驗預計將於 2019 年年中開始,將包括 28 至 36 名轉移性前列腺癌男性,並將持續約九個月。任何新型藥物通常都會針對一個眾所周知的靶標,那裡的生物學和毒理學都得到了很好的理解,而 Arvinas 的第一個候選藥物也不例外。它降解雄激素受體,一種已經被少數已批准藥物靶向的蛋白質。該公司希望透過降解而不是抑制受體,其 PROTAC 將能夠治療那些對現有藥物產生耐藥性或未見益處的人。如果該候選藥物獲得成功,該領域最終將獲得所有人都在尋找的臨床資料。Arvinas 將證明 PROTAC 可以成為一種藥物。
這至關重要,因為人們對蛋白質降解劑是否能在人體內發揮作用存在相當大的疑問。完全組裝好的 PROTAC 打破了眾所周知的藥物經驗法則。其中最主要的是尺寸。一種好的小分子藥物的質量通常小於 500 道爾頓。目前的 PROTAC 的質量在 1,000 道爾頓以上。然而,這些分子仍然可以進入細胞。克魯斯懷疑這是因為它們可能被細胞膜識別為兩個碰巧連線在一起的較小分子,而不是一個大的分子。
“我們正在拋棄我們對大於平均水平的小分子的先入為主的觀念,”泰勒說。
關於不可成藥的先入為主的觀念也消失了。許多這些難以捉摸的蛋白質靶標的問題在於,大多數小分子藥物或單克隆抗體需要與酶或受體上的活性位點結合才能發揮作用。但據估計,人類細胞中 80% 的蛋白質缺乏這樣的位點。然而,PROTAC 可以透過任何角落、縫隙或裂縫抓住蛋白質——它們不需要坐在活性口袋中才能發揮作用。因此,它們可以使這些蛋白質變得可及。
已經有一些證據支援這種方法。去年,倫敦癌症研究所的一個團隊生產了一種小分子,可以與沒有活性位點的轉錄因子調節器結合。他們透過連線泛素連線酶 cereblon 的結合劑,成功地建立了一種有效的 PROTAC。
該領域仍然缺乏已發表的證據證明 PROTAC 可以靶向和降解有價值的不可成藥蛋白質。德沙耶斯說,安進公司有一種 PROTAC 在培養細胞和動物中均有效,可以對抗一種未命名的、高價值的癌症靶標,該靶標在歷史上一直難以結合。Arvinas 聲稱擁有 PROTAC 在小鼠大腦中降解 tau 蛋白的體內證據。該公司在其網站上表示,將其 tau 蛋白降解劑直接注射到小鼠海馬體中,可將 tau 蛋白水平降低 50%。
泰勒說,透過開發針對包括影響大腦的疾病在內的多種疾病的 PROTAC,許多研究人員希望表明該技術是“治療領域不可知的”。各個團隊也在努力擴大蛋白質降解劑可以招募的連線酶庫。目前僅使用了四種主要的連線酶,包括 VHL 和 cereblon,更多種類的可用連線酶可以使藥物開發人員能夠將最有效的連線酶-PROTAC 組合與其細胞型別或感興趣的蛋白質相匹配。“潛在地,任何連線酶都可以透過這種方法被劫持,”丘利說,他正在與德國製藥公司勃林格殷格翰合作開發 PROTAC。
在新靶標、改進的效力和即將開始的臨床試驗的鼓舞下,研究人員準備證明蛋白質降解劑不僅僅是一種客廳把戲。“天空才是極限,”丘利說。“這只是時間問題。”
本文經許可轉載,首次發表於 2019 年 3 月 20 日。
