腦癌令人恐懼。它攻擊我們視為個性的核心、我們的思想、我們人性的器官。而且由於這種疾病在大腦內部生長,因此非常難以治療。該器官進化出許多防禦機制,以阻止外來物質進入,作為一種自我保護的方法,但這些物質包括許多抗癌藥物。對這個意識堡壘使用手術刀或放射線會帶來巨大的風險。由於這些原因,55 歲至 64 歲患上膠質母細胞瘤(最常見的原發性腦腫瘤型別)的人的五年相對生存率非常嚴峻,僅為 5%。這種疾病奪去了約翰·麥凱恩、愛德華·肯尼迪和博·拜登的生命,並且每年奪走約 15,000 名不太出名的美國人的生命。
現在我們開發了一種奈米尺寸的藥物,它可以在體內和大腦中穿行,殺死癌細胞。這些藥物顆粒由寡核苷酸組成——DNA 或 RNA 鏈,這些分子構成了主程式碼,告訴每個細胞該做什麼——它們像海膽的許多刺一樣從中心核伸出。這些帶刺的圓形顆粒被稱為球形核酸。在一項針對八名患者的早期試驗中,這些球體進入膠質母細胞瘤細胞,並結合了其他對癌症持續生長至關重要的“程式碼”分子。
這種球形藥物似乎對多種疾病有效。另一種可怕的疾病是脊髓性肌萎縮症 (SMA),它會影響嬰兒。它剝奪了兒童的肌肉控制能力,直到吞嚥和呼吸變得先是困難,最終變得不可能。大多數患有這種疾病的兒童在進入幼兒園之前就去世了,而且直到最近,醫生還無法提供任何幫助。2016 年,美國食品和藥物管理局批准了一種療法:一種名為 Spinraza 的藥物,每年多次直接注射到脊髓中,每次注射的標價為 125,000 美元,是世界上最昂貴的藥物之一。最近,我們在齧齒動物研究中,將我們的球體(上面佈滿了進入細胞並干擾導致 SMA 症狀的信使分子的核酸)與 Spinraza 方法進行了比較。球體將生存期提高了四倍——115 天對 28 天——而且毒副作用的發生率要低得多。
關於支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您將有助於確保有關塑造我們當今世界的發現和想法的具有影響力的故事的未來。
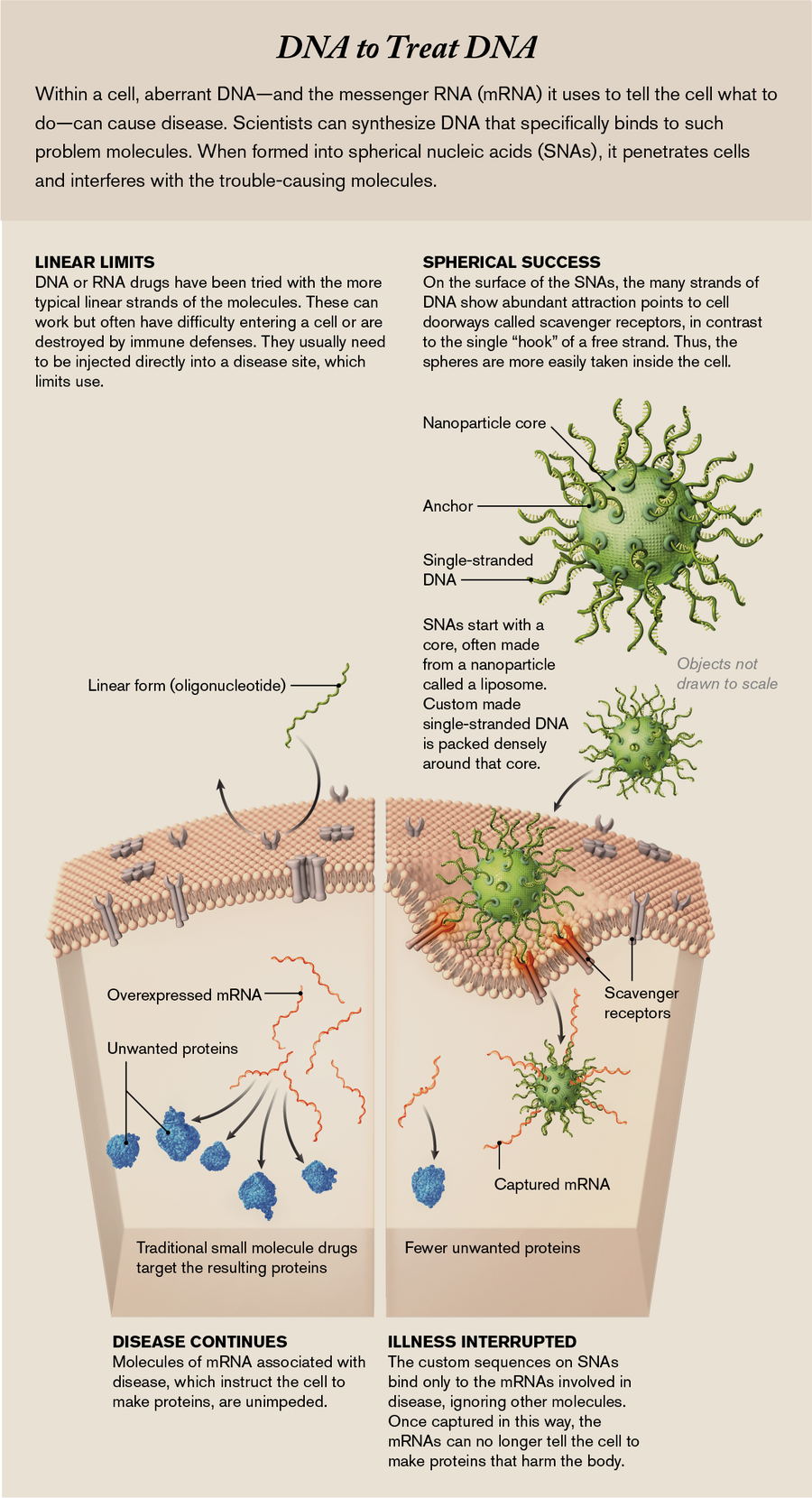
球形核酸 (SNA) 避免了困擾製藥行業開發新藥的難題。傳統藥物是非特異性的:它們會影響許多細胞和器官,而不僅僅是患病細胞;因此,它們有許多副作用。然而,核酸可以被設計成僅干擾致病基因或其傳送的控制細胞行為的相關指令分子。生物學家過去曾嘗試使用核酸,但主要是作為線性分子,並且幾乎沒有能力指導它們去哪裡。而且由於人體對外來遺傳物質具有強大的防禦能力——例如免疫系統——在大多數情況下,這些防禦機制會立即破壞藥物或將藥物送到肝臟和腎臟等器官進行廢物清除。
但是,SNA 的直徑只有十億分之一米,似乎能夠到達體內的任何地方,並在免疫防禦系統攔截它們之前進入細胞內部。球形形狀使我們能夠將高密度的核酸“刺” packed 到一個小空間中,這種密度與細胞表面上的受體產生強烈的相互作用,從而允許顆粒進入細胞內部。在那裡,成分的序列——與構成生命 DNA 程式碼的核苷酸相同,縮寫為 A、T、C 和 G——確保它們僅影響 DNA 或 RNA 的互補序列。(後一種分子使用 U(尿嘧啶)代替 T,我們為此進行了設計。)我們構建我們的鏈,使其僅與細胞中對疾病至關重要的序列匹配。SNA 不是靈丹妙藥,在可以用於大量患者之前,還需要透過更多測試。但潛力是存在的:由於可以重新排列核酸成分以干擾細胞內許多不同的致病分子,因此球體有能力解決世界上一些最令人衰弱的疾病。
可程式設計藥物
傳統上,科學家們透過篩選數十萬種小的合成或天然分子來尋找疾病治療方法,經歷漫長的反覆試驗過程,以檢視其中是否有任何一種具有治療益處。儘管這種流程已經產生了許多令人驚歎的藥物,例如抗生素,但即使是最有希望的藥物也可能引起不必要的副作用。許多其他疾病不受這些分子的影響,因此仍然缺乏治癒或治療方法。即使是生物製劑,一種較新的藥物類別,通常基於小鼠、兔子和其他動物的免疫細胞產生的蛋白質,也通常依賴於簡化的反覆試驗發現過程。
理想的藥物設計過程將允許科學家快速、合理地設計使用與我們的細胞相同的語言的特定藥物,而不是尋找大海撈針般的分子。細胞透過 DNA 和 RNA 傳遞許多複雜的資訊,以製造數百萬種蛋白質。細胞必須正確執行以製造這些蛋白質的步驟數量令人震驚:它們必須選擇由 A、T、C 和 G 核苷酸組成的 DNA 的特定序列,將該序列轉錄成一種稱為信使 RNA (mRNA) 的形式,然後準確讀取該 mRNA 以將稱為氨基酸的分子排列成鏈——長達 35,000 個單位——形成單個蛋白質。
當新增、刪除或以不正確的順序放置諸如 T 或 G 之類的核苷酸時發生的錯誤可能會阻止蛋白質的產生或產生導致疾病的異常蛋白質。mRNA 的副本過多,因此其相關蛋白質的副本過多也可能導致疾病。(來自病毒的外來核酸的引入也會導致疾病,這會導致受感染的細胞製造有害的病毒蛋白質。)
但是我們可以合成我們自己的 DNA 或 RNA 成分片段,稱為寡核苷酸。由於遺傳字母表具有非常具體的規則——A 只能與 T 結合,而 C 只能與 G 結合——我們可以製造具有選擇性結合並滅活一種疾病驅動序列的序列的寡核苷酸。當它們這樣做時,合成的寡核苷酸會阻礙細胞工作,阻止受影響的細胞產生致病蛋白質。
然而,儘管有自動化裝置可以快速製造具有任何所需序列的合成寡核苷酸,但只有不到十幾種基於寡核苷酸的藥物已獲得患者批准。這是因為這些寡核苷酸鏈一旦被注射到血液中,就會面臨一個重大障礙:因為它們是外來的——也就是說,不是患者自身的——它們會被視為有害物質或廢物。人體的免疫系統會破壞這些寡核苷酸,或者人體的廢物過濾站(肝臟和腎臟)會將它們清除。它們無法到達預期的目標。即使寡核苷酸鏈能夠到達含有目標 mRNA 的細胞,該細胞也具有充當屏障的外膜,以阻止寡核苷酸進入內部。因此,與寡核苷酸合作的製藥公司通常會選擇治療可以在肝臟中靶向的疾病。肝臟是一個重要的器官。但是將這些藥物隔離在這個地方確實限制了它們的用途。(另一種方法——將寡核苷酸直接注射到疾病部位,例如使用 Spinraza 注射到脊髓中——技術上很困難,並且仍然不能確保藥物進入所有適當的細胞。)
圖片來源:艾米麗·庫珀
一個令人驚訝的結果
我們西北大學的小組以及其他幾位研究人員在奈米技術方面的進展使我們發現了 SNA,這可能是解決這個問題的一種方法。在 2006 年之前,我們的小組一直對在超靈敏診斷探針中使用 SNA 的高度特異性結合能力感興趣——例如,從血液樣本中提取癌 DNA 片段。我們可以透過化學方式用許多 DNA 鏈裝飾金奈米顆粒來實現這一點,這些 DNA 鏈被設計成將一端錨定到顆粒上,從而產生海膽刺圖案。DNA 的外端被設計成與癌 DNA 序列互補的序列,因此它可以很好地用作探針。我們還將球體用作具有可程式設計鍵的人造原子,以製造新型材料。然而,藥物設計實際上並不在我們的雷達範圍內。畢竟,根據藥物生物學和化學的主流正規化,RNA 和 DNA 不會自然地穿過細胞膜。
然而,我們對這種新幾何結構中的核酸如何與生命系統相互作用感到好奇。藥物開發人員已經一直在試驗單鏈寡核苷酸,正如我們所指出的,效果有限。從我們使用 SNA 作為診斷平臺的研究中,我們知道目標 DNA 和 RNA 與我們的刺簇的結合力將比與遊離寡核苷酸鏈的結合力強得多。原因是我們的刺密集地 packed 在奈米顆粒的表面上。這使得它們更堅硬,這有助於每條鏈上的 A、T、G 和 C 在遇到目標鏈時對齊和結合。這一特性使我們懷疑,如果使用正確的核酸序列,SNA 可能是一種非常有效的寡核苷酸藥物。
為了驗證這個想法,我們進行了一項實驗,當時我們認為這項實驗成功的機會很渺茫。我們取了遊離寡核苷酸鏈,並將它們放入裝有小鼠細胞的試管中。在另一個試管中,我們將大量 SNA 新增到相同型別的小鼠細胞中。我們將紅色熒光分子附著到球體和鏈上,以幫助我們追蹤它們。當我們用顯微鏡觀察細胞時,與遊離鏈混合的細胞如預期的那樣呈透明狀。遊離寡核苷酸沒有穿過細胞膜。但是與 SNA 混合的細胞在螢幕上亮起了鮮紅色的熒光。球體進入了細胞內部!
這怎麼可能發生呢?一般來說,細胞膜嚴格調節哪些分子可以進入,而寡核苷酸通常不在批准的客人之列。此外,寡核苷酸帶有負電荷,細胞表面也是如此。就像兩個磁鐵一樣,這兩個生物物體應該相互排斥。然而,當我們一次又一次地重複這項實驗,使用超過 50 種其他人類和動物細胞型別時,除了一個細胞外,所有細胞都發出紅光,這是成功的訊號。
今天,我們認為我們知道入口是什麼:一種稱為清道夫受體的門戶分子,它點綴在細胞表面。當細胞與其環境相互作用時,這些受體發揮著重要作用;例如,它們允許細胞需要的奈米尺寸的生物分子進入。SNA 刺末端的一些結構特徵恰好模仿了這些清道夫受體的天然底物。正如前面提到的,球體上的鏈條 packed 得很密集,就像 Velcro 一樣,鉤子越多,結合力就越強。對於遊離鏈,即使清道夫受體將它們識別為要攝取的分子,它們也只有一個鉤子,然後就漂走了。
藉助電子顯微鏡,我們可以看到,一旦 SNA 與這些受體結合,周圍的細胞膜就會向內摺疊形成一個口袋,將 SNA 引入細胞內部。
球體作為藥物
但是進入只是成功了一半。要作為藥物發揮作用,SNA 需要找到、結合並滅活 mRNA 的特定片段,該片段指示細胞製造與疾病相關的蛋白質。
我們在細胞中靶向的第一個 mRNA 片段不會引起疾病,但確實指示細胞製造一種在顯微鏡下發出亮綠色的蛋白質。我們的目標是阻止這種 mRNA。當我們用設計用於匹配綠色致病 mRNA 的 SNA 暴露小鼠細胞,並將它們與未獲得球體的類似細胞進行比較時,顏色差異很明顯。沒有球體的細胞呈亮綠色,表明 mRNA 已經編碼了蛋白質。但是暴露於我們的 SNA 的細胞是透明的,這意味著我們已經阻止了 mRNA,使其無法傳遞指令來製造任何綠色的東西,正如我們在 2006 年的《科學》雜誌上報道的那樣。
接下來,我們將 SNA 與困擾線性寡核苷酸藥物的主要挑戰進行了對抗:被人體自然防禦系統破壞。我們發現,我們的球體具有很強的電荷——再次是因為密集的 packed ——這有助於它們逃避免疫干擾。這種高電荷會抑制稱為核酸酶的防禦分子,核酸酶是降解外來 DNA 和 RNA 的蛋白質,使其無法靠近。
現實檢驗
至少在實驗室裡,我們取得了一些進展。其他科學家複製並獨立推進了我們的一些工作,包括皮膚科醫生艾米·帕勒、SMA 專家亞瑟·伯格斯、免疫治療專家張斌、癌症生物學家亞歷克斯·施特格、移植外科醫生傑森·韋特海姆和腫瘤學家普里亞·庫姆特卡爾。但是從實驗臺突破到更健康的患者的道路漫長而艱辛,因此大約 10 年前,我們小組的研究人員成立了一家名為 Exicure 的公司,以將基於 SNA 的藥物推進到臨床。
我們最初探索了是否可以將這些強效藥物透過皮膚霜和滴眼液輸送到患病組織,這是可行的,因為 SNA 很容易被細胞吸收,並且比直接注射等侵入性策略有了很大的改進。我們的最初兩個目標是牛皮癬和難以癒合的傷口,並且已經有幾個有希望的 SNA 候選藥物正在針對其中一些疾病進行早期臨床試驗。
當然,皮膚相對容易到達。大腦則不然。大腦受到警惕的免疫系統和旨在阻止外來分子進入的血管網路(血腦屏障)的保護,使得膠質母細胞瘤等癌症特別難以治療。然而,我們認為 SNA 可能會透過相同的門戶分子穿過這些防禦系統,這些門戶分子可以使它們更容易穿過細胞膜。一旦進入大腦,球體就可以透過靶向負責維持細胞存活的基因和蛋白質(惡性腫瘤會過度產生這些基因和蛋白質)來定位癌細胞。
為了啟動這個專案,我們創造了一種 SNA 藥物,其中包含許多短 RNA 片段,專門設計用於敲除膠質母細胞瘤細胞中一種名為 Bcl2L12 的蛋白質的產生。這種蛋白質充當生化防禦劑,有助於維持癌細胞的功能。我們認為,透過攔截告訴細胞製造這種蛋白質的 mRNA,SNA 可以使癌症更容易受到傳統藥物的影響。事實上,在我們在 2013 年的《科學轉化醫學》雜誌上報道的動物研究中,情況就是這樣:注射到小鼠血液中的 SNA 到達大腦,穿過血腦屏障,並阻止了膠質母細胞瘤細胞內部 Bcl2L12 蛋白質的產生。去年,早期臨床結果表明,這些 SNA 也到達了人類患者的膠質母細胞瘤細胞。我們沒有治癒人們,我們還沒有測試 SNA 是否使癌細胞更容易受到攻擊。儘管如此,SNA 到達大腦的能力及其缺乏毒性為治療這種癌症以及其他神經系統疾病帶來了希望,併為下一組臨床試驗奠定了基礎。在其他疾病(如脊髓性肌萎縮症)中的測試也顯示出在動物身上的前景。
SNA 的另一個令人興奮的方向是將其用作針對癌症的免疫療法。癌細胞的膜中通常具有與健康細胞中發現的蛋白質不同的蛋白質。因此,癌細胞蛋白質可以充當危險訊號,如果我們的免疫系統可以被訓練成像追逐流感病毒一樣追逐它,我們自己的身體就可以更好地保護我們免受這種疾病的侵害。
為了製造 SNA 癌症疫苗,我們將金奈米顆粒核替換為空心奈米顆粒,稱為脂質體,用其中一種危險訊號蛋白質填充它,並將其注射到患有相應癌症的動物體內。我們最近的一些實驗發表在 2019 年的《美國國家科學院院刊》上,表明這種 SNA 會立即引發對腫瘤的免疫反應,顯然是在教導免疫系統追逐顯示該危險訊號的細胞。效果似乎也很持久:即使 SNA 消失後,免疫系統仍會繼續追逐帶有該蛋白質的細胞。SNA 已經在人體 I 期臨床試驗中顯示出效力和安全性,並且針對致命性皮膚癌的其他球體正在另一組安全性試驗中進行測試。
然而,SNA 尚未成為批准的藥物。它們首先需要克服許多挑戰。由於球體確實會到達廣泛的細胞,我們需要仔細研究它們是否會產生任何負面的“脫靶”效應,即使它們的設計應該將它們限制為僅針對問題 DNA 和 RNA。必須探索更大的患者群體,並且我們需要改進靶向性,以增加到達受影響器官和細胞的藥物量。
我們認為 SNA 訪問如此多不同組織的能力具有顛覆性,並將成為此類藥物出現和最終廣泛使用的核心。SNA 是三種核心能力的產物:製造大量寡核苷酸的能力、對遺傳疾病途徑的理解以及將此類寡核苷酸送入重要組織和細胞的能力。前兩者很重要,但沒有第三者,這個過程就像製造軟體而沒有執行它所需的硬體。SNA 可能是那種至關重要且用途廣泛的硬體——一個能夠為許多不同型別的疾病重複使用的平臺,一個開始將製藥行業從為每種新療法艱難尋找全新分子的困境中解脫出來的平臺。SNA 只需要一組不同的寡核苷酸就可以追逐一種新的疾病。而我們才剛剛開始。
