羅伯特·索格在2009年研究小鼠的疼痛,但最終頭痛的是他自己。
在加拿大蒙特利爾的麥吉爾大學,索格正在研究動物如何產生對觸控的極端敏感性。為了測試這種反應,索格用細毛戳小鼠的爪子,這些細毛通常不會打擾它們。雄性小鼠的行為正如科學文獻所說的那樣:即使是最細的線,它們也會猛地縮回爪子。
但雌性小鼠對索格的輕柔戳刺保持了沉默。“在雌性身上就是不起作用,”索格回憶道,他現在是阿拉巴馬大學伯明翰分校的行為學家。“我們無法弄清楚原因。”索格和他在麥吉爾大學的導師,疼痛研究員傑弗裡·莫吉爾,繼續確定這種疼痛過敏是由雄性和雌性小鼠中截然不同的途徑產生的,不同的免疫細胞型別導致了不適。
支援科學新聞業
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞業 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們當今世界的發現和想法的有影響力的故事的未來。
如果索格和莫吉爾遵循大多數疼痛研究人員的慣例,他們永遠不會做出他們的發現。透過納入雄性和雌性小鼠,他們是在逆潮流而動。當時,許多疼痛科學家擔心雌性激素週期會使結果複雜化。其他人則堅持使用雄性,因為,嗯,事情就是這樣做的。
今天,部分受到索格和莫吉爾工作的啟發,並受到資助者的推動,疼痛研究人員正在睜開眼睛關注不同性別之間的反應譜。結果開始逐漸顯現,並且很明顯,某些疼痛途徑差異很大,免疫細胞和激素在不同的反應中起著關鍵作用。
這種推動是更廣泛的運動的一部分,即將性別視為生物醫學研究中的一個重要變數,以確保研究涵蓋各種可能性,而不是從單一群體中收集結果。2016年,美國國立衛生研究院 (NIH) 做出了一項重大改變,要求撥款申請者證明他們選擇實驗動物性別的合理性。加拿大衛生研究院性別與健康研究所科學主任卡拉·坦嫩鮑姆說,疼痛研究中的發現是最令人興奮的新興領域之一。她補充說,關於索格和莫吉爾的工作,“據我所知,沒有其他科學領域發現過這種型別的性別差異。”
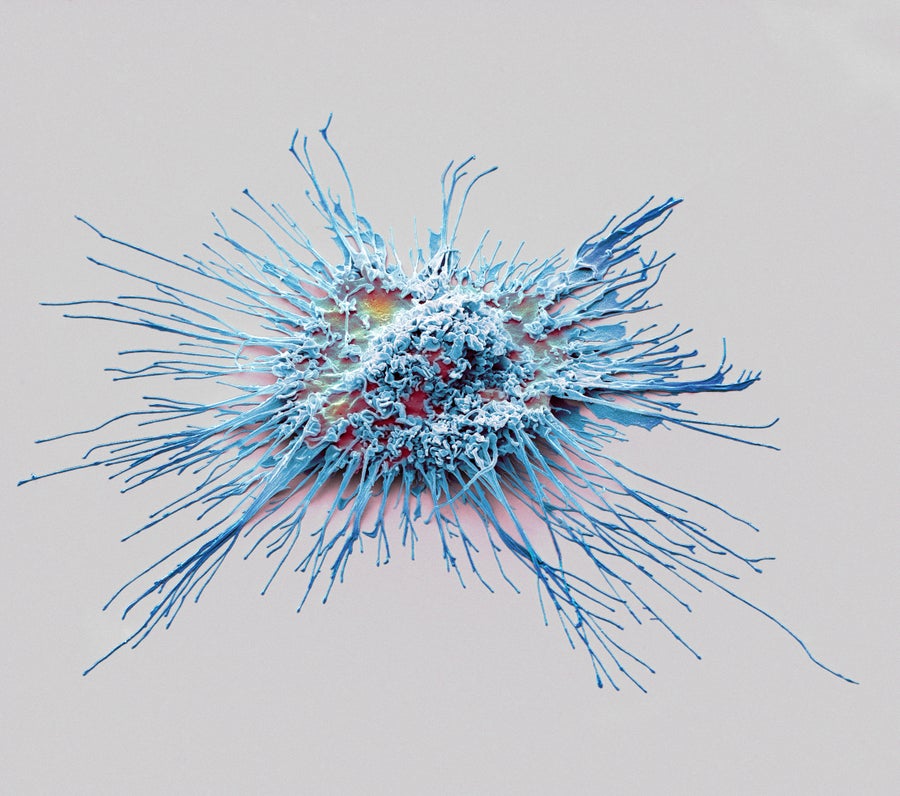
小膠質細胞是神經系統的免疫細胞,是雄性小鼠疼痛形式的幕後推手。
圖片來源:Steve Gschmeissner Getty Images
坦嫩鮑姆補充說,這項研究可能會為新的醫學進展開啟大門。這些進展是迫切需要的:全世界約有 20% 的人經歷慢性疼痛,其中大多數是女性。今天,製藥市場向所有人提供相同的止痛藥。但如果疼痛的根源不同,那麼某些藥物可能比其他藥物在某些人身上效果更好。
此外,當激素水平在生活中波動時,人們可能需要不同的止痛藥。並且一個人的性別並不總是清晰地分為男性和女性類別:它由一系列特徵決定,包括遺傳、解剖發育和激素水平,每種特徵都可能影響一個人在疼痛治療中的需求。情況遠未完善,並且研究(大多數在齧齒動物身上進行)到目前為止主要集中在生物性別上,而不是性別,性別是一個不一定與性別相符的社會心理概念。
英國劍橋阿斯利康公司神經科學副總裁兼主管伊恩·切塞爾預測,未來的止痛藥將為個人量身定製,而性別將是這些個性化處方的關鍵因素。“但我們還不瞭解它,”他補充道。
對疼痛免疫
當皮膚、肌肉、關節或器官中的神經感測器記錄到潛在的有害感覺(例如熱或組織損傷)時,就會發生疼痛。它們透過周圍神經向脊髓傳送訊號,啟用其他神經,這些神經將訊號傳送到腦幹,然後傳送到大腦皮層,大腦皮層將這些訊號解釋為“哎喲!” 但疼痛的發生方式有很多種,並且涉及多種化學途徑。一些疼痛型別透過時間來區分。有對熱、尖銳或其他有害物質的急性反應,也有長期慢性疼痛,即使在最初的損傷癒合後也可能持續存在。
慢性疼痛可以表現為對原本無痛刺激的過敏,就像索格的雄性小鼠的情況一樣。早在 2009 年,他和莫吉爾就在研究一種由炎症引發的慢性疼痛模型。
將一種名為脂多糖的細菌分子注射到小鼠的脊柱中引起了小膠質細胞(神經系統常駐免疫細胞)的注意。但在索格的研究中,這僅導致雄性小鼠的炎症,解釋了為什麼它們對毛髮刺激測試如此敏感,索格和莫吉爾在 2011 年報告中指出。雌性小鼠的小膠質細胞保持靜止,這似乎解釋了它們對索格用細毛戳它們的爪子無動於衷的原因。
為了更好地理解為什麼雄性和雌性小鼠對疼痛的處理方式如此不同,索格和莫吉爾轉向了一種影響所有小鼠的疼痛來源。他們損傷了動物的坐骨神經,坐骨神經從下背部向下延伸到每條腿。這導致了一種慢性疼痛形式,當身體的疼痛檢測系統受損或發生故障時就會發生。這導致雄性和雌性小鼠都變得對觸控格外敏感。
但即使在這種情況下,也存在差異。小膠質細胞似乎在雄性小鼠的疼痛中起著重要作用,但在雌性小鼠的疼痛中則不然。索格和一個來自三個機構的合作團隊發現,無論他們如何阻斷小膠質細胞,這都只消除了雄性小鼠的疼痛過敏。
並不是說雌性小鼠對疼痛免疫。它們和雄性小鼠一樣受到神經損傷的困擾,但它們沒有使用小膠質細胞來變得對觸控過敏。莫吉爾和索格想知道另一種稱為 T 細胞的免疫成分是否是雌性小鼠慢性疼痛的幕後推手。已知這些細胞在小鼠的疼痛敏化中起作用。
索格在缺乏 T 細胞的雌性小鼠身上嘗試了相同的神經損傷。它們仍然對細毛變得過敏,但現在的機制似乎是透過小膠質細胞發生的。在缺乏 T 細胞的雌性小鼠中,阻斷小膠質細胞的活動可以阻止這種疼痛反應,就像在雄性小鼠中一樣。當研究人員將 T 細胞轉移回缺乏 T 細胞的雌性小鼠時,這些動物停止在神經損傷疼痛中使用小膠質細胞(參見兩種疼痛途徑)。
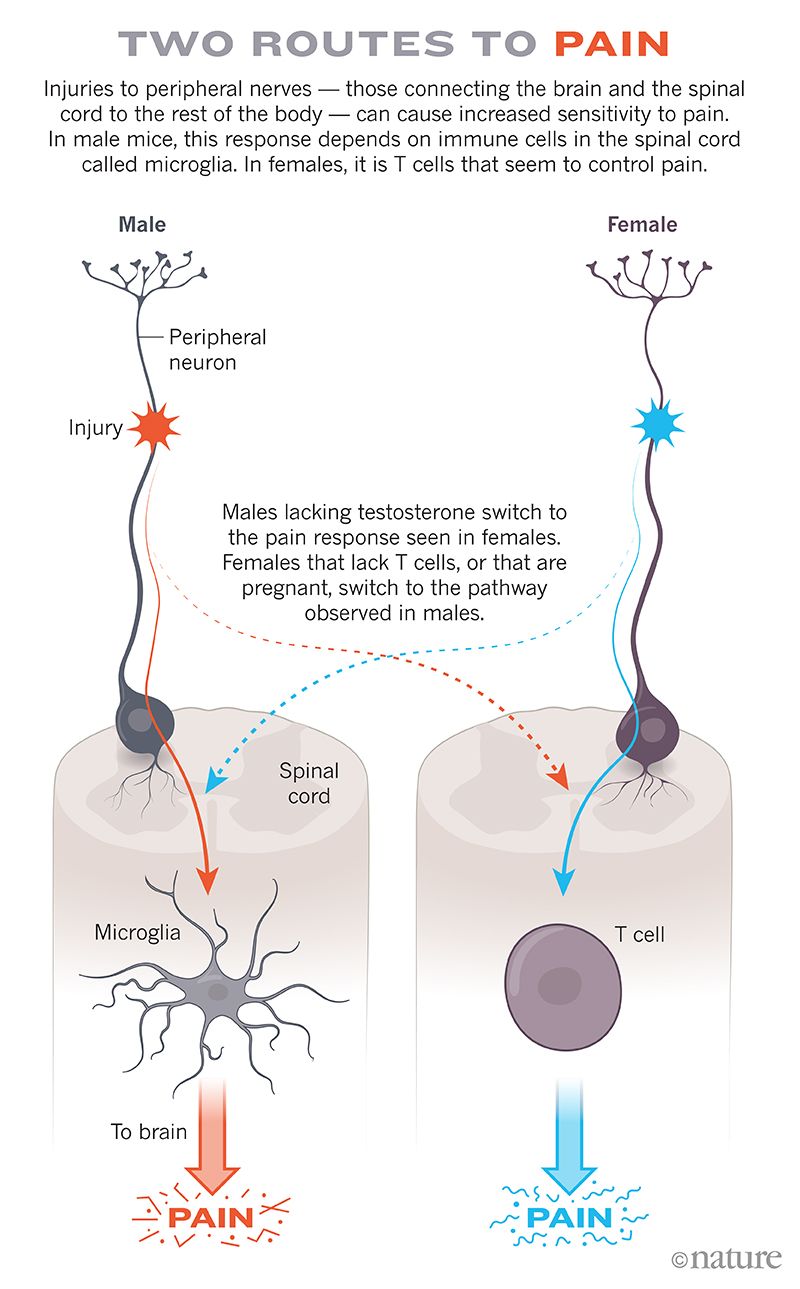
德克薩斯大學達拉斯分校的神經藥理學家格雷格·杜索爾說,該團隊在 2015 年報告的發現對疼痛領域產生了重大影響。結果表明,即使從外部來看,每個人的疼痛可能看起來相似,但科學家不能假設內部也是相同的。
痛點
如果動物可以在疼痛途徑之間切換,是什麼控制了這種切換?研究人員長期以來將疼痛感知的性別差異歸因於雌激素,雌激素是一種控制子宮、卵巢和乳房發育的激素,並調節月經週期。雌激素可以加劇或減輕疼痛,具體取決於其濃度和位置。睪酮是參與陰莖、睪丸和前列腺發育以及第二性徵(如體毛)的激素,受到的疼痛研究人員的關注較少,儘管研究表明它可以減輕疼痛,並且一些患有慢性疼痛的人接受睪酮治療。
在小膠質細胞和疼痛過敏的情況下,莫吉爾的研究直接指向睪酮作為疼痛途徑的控制開關。在 2011 年和 2015 年的研究中,當索格測試去勢雄性小鼠(睪酮水平低)時,這些動物表現出與雌性相似的反應。當研究人員向去勢雄性或雌性提供睪酮時,疼痛途徑切換為依賴小膠質細胞的途徑。
從那時起,研究人員繼續發現證據,證實小膠質細胞及其酶和受體在雄性小鼠經歷疼痛中的重要性。這種現象並不侷限於小鼠:莫吉爾的合作者之一,神經科學家邁克爾·索爾特,也在患有神經損傷引起的過敏的大鼠雄性身上發現了小膠質細胞受體在起作用。索爾特是加拿大多倫多病童醫院的研究主管,他現在正在獼猴身上研究這個問題,獼猴處理疼痛的方式可能與人類更相似。
在人類身上研究這些疼痛途徑要困難得多,但線索正在浮出水面。德克薩斯大學達拉斯分校的神經藥理學家泰德·普萊斯和他的合作者在 3 月份發表了初步證據,表明免疫細胞在人類疼痛中的作用方式存在差異。
他們正在研究從癌症患者身上取出的神經組織,這些患者的腫瘤已經侵入了他們的脊柱。在從經歷疼痛的男性身上切除的神經中,普萊斯的團隊發現了由一種稱為巨噬細胞的免疫細胞引起的炎症跡象。這些細胞的功能與小膠質細胞相似。然而,在疼痛的女性中,更重要的參與者似乎是神經細胞本身和一段刺激神經生長的蛋白質構建塊(稱為肽)。普萊斯說,結果表明人類和齧齒動物的性別差異之間存在相似之處。
但免疫細胞和激素並不能完全解釋疼痛差異。例如,北卡羅來納大學教堂山分校醫學中心的轉化生物學家莎拉·林斯塔特發現,一些女性可能具有慢性疼痛的遺傳傾向。她的團隊在血液中發現了一組 RNA 分子,這些分子更有可能在機動車事故後患上慢性頸部、肩部或背部疼痛的女性中升高。這些 RNA 分子中的許多是由 X 染色體上的基因編碼的,大多數女性都有兩個 X 染色體副本。
林斯塔特說,這是有用的資訊。“這將使我們能夠開發新的療法,這些療法可以專門用於女性,或者在女性中以更高的劑量使用。”
藥物差異
其他人也在考慮針對性別的止痛治療。在 2018 年 11 月線上發表的一項研究中,普萊斯和他的團隊報告說,一種名為二甲雙胍的糖尿病藥物可以減少脊髓感覺神經元周圍的小膠質細胞數量。他們還表明,該藥物僅能阻斷雄性小鼠神經損傷引起的疼痛過敏。“它對雌性沒有任何作用;事實上,情況變得更糟,”普萊斯說,他對原因有一個理論:為了進入神經系統,二甲雙胍依賴於一種在雄性細胞中表達水平更高的蛋白質。然而,更高的劑量並沒有對雌性產生影響,大概是因為藥物被困在神經之外。
更高的劑量確實可以幫助接受藥房中最古老的止痛藥之一:嗎啡的女性。佐治亞州立大學亞特蘭大分校的神經科學家安妮·墨菲說,女性和雌性齧齒動物通常需要更高劑量的嗎啡才能達到與男性和雄性齧齒動物相同的止痛效果。她是少數在 NIH 更改其指南之前就研究性別差異的研究人員之一。
墨菲的團隊在 2017 年報告稱,小膠質細胞也是嗎啡不同效果的幕後推手。該藥物透過阻斷大腦中稱為導水管周圍灰質或 PAG 的區域中的神經元來減輕疼痛。但該藥物也可能啟用那裡的小膠質細胞,抵消嗎啡的止痛效果。這正是發生在雌性大鼠身上的情況,雌性大鼠的 PAG 中的小膠質細胞比雄性更活躍。當科學家在雌性大鼠爪子上應用熱光束之前用嗎啡治療它們時,雌性動物的 PAG 中炎症更多,並且比給予相同劑量的雄性更快地縮回腿。當墨菲的團隊阻斷嗎啡對小膠質細胞的影響時,雄性和雌性對疼痛的反應方式相似。
至少有一種已經上市的藥物,科學家有理由認為它可能在不同性別之間發揮不同的作用。2018 年,美國食品和藥物管理局批准了基於抗 CGRP 抗體的偏頭痛治療方法,CGRP 是一種在神經系統中發現的肽,與此類頭痛有關。偏頭痛對女性的影響是男性的三倍。
在普萊斯和杜索爾領導的一項尚未發表的小鼠和大鼠研究中,研究小組將 CGRP 應用於大腦周圍的厚膜。在雌性中,這種肽產生了一種看起來像偏頭痛的反應:動物們做了鬼臉,它們的臉部對觸控過敏。在雄性中:“什麼也沒有,”杜索爾說。現代抗 CGRP 藥物可能在女性身上比在男性身上效果更好,他補充說,但該藥物的臨床試驗並未檢查此類效果。
這在許多藥物試驗中都很典型。它們通常包括男性和女性,但每種性別的數量通常都不足以找出差異。普萊斯說,過去臨床試驗失敗的止痛藥,如果按性別分別進行測試,則很有可能獲得成功。“這似乎非常明顯,”他補充道,“但實際上沒有人這樣做。”
個性化藥丸
阿斯利康公司的切塞爾很樂意開發一種僅對特定性別的人有效的止痛藥。但研究參與者和動物受試者的性別是由實用性、倫理問題和政府法規驅動的,他說。阿斯利康在其大多數臨床前疼痛研究中使用雌性齧齒動物,因為它們不如雄性具有攻擊性,並且更容易飼養和處理。在早期臨床試驗中,安全是重點,因此公司通常排除可能懷孕的人。因此,藥物主要在男性和絕經後女性身上進行試驗。
即使科學家開發出針對男性或女性特定疼痛途徑的藥物,這些藥物可能也不夠。最好更密切地定製藥物,以考慮到遺傳、激素水平和解剖發育的譜系。
關於不符合性別和性別二元定義的人的疼痛機制的研究很少。在一項研究中,義大利的研究人員調查了接受激素治療的跨性別者。他們發現,在 47 名從男性轉變為女性的人中,有 11 人報告了變性後出現的疼痛問題。在 26 名從女性轉變為男性的人中,有 6 人報告說服用睪酮後疼痛問題減輕了。
根據他的團隊在小鼠身上進行的去勢和睪酮治療實驗,莫吉爾認為疼痛途徑將由激素水平決定。他預測,睪酮水平超過一定閾值的人將具有與男性相關的疼痛機制,而睪酮水平低於該水平的人將透過女性常見的機制體驗疼痛。
疼痛反應似乎也會在一生中發生變化,在激素水平升高或下降的時候。僅關注生物性別的研究發現,在青春期,女孩的疼痛狀況發生率高於男孩。隨著人們年齡的增長,有些人進入更年期,激素水平再次發生變化,慢性疼痛發生率的性別差異開始消失。懷孕也會改變疼痛反應。莫吉爾的研究小組在 2017 年報告稱,在懷孕早期,小鼠從典型的女性、不依賴小膠質細胞的疼痛敏化機制轉變為更男性相關的、涉及小膠質細胞的機制。到懷孕後期,動物似乎根本感覺不到慢性疼痛。
但他不再是少數幾個尋找這種性別差異的科學家之一。“人們現在左右都在發現這一點,”莫吉爾說。“我認為我們現在只知道了一半。”
本文經許可轉載,並於 首次發表 於 2019 年 3 月 29 日。