在林克彥(Katsuhiko Hayashi)實驗室的籠子裡亂竄的小鼠看起來並不特別。它們像同類一樣奔跑、進食和睡覺。但這八隻齧齒動物有一個不尋常的起源故事,這是日本九州大學的生殖生物學家林克彥在三年前在《自然》雜誌上透露的。他和他的同事宣佈,這些黃褐色的小鼠並非源於精子和卵子的結合。從母系方面來看,它們的根源可以追溯到一個經過重程式設計的皮膚細胞。
其他研究人員稱這項進展“令人驚歎”,它兌現了1997年科學家成功克隆多莉羊時暗示的承諾。這項成就建立在20世紀70年代青蛙的早期克隆工作之上,並教會了科學家,每個動物細胞都具有相同的基本指令集。多莉的創造者透過將綿羊的乳腺細胞轉化為活體動物,表明每個哺乳動物細胞都具有相同的基因——乳腺細胞與任何其他細胞之間的區別僅僅在於哪些基因被開啟或關閉。
對於林克彥和其他科學家來說,這項工作創造了他們可能能夠對哺乳動物細胞進行重程式設計,使其成為從神經元到卵子的任何東西的前景,前提是他們能夠設計出正確的操作手冊。包括林克彥在內的少數世界各地的研究人員正在利用這一遺產來解決體外配子發生——從成體細胞生成卵子和精子的問題。
支援科學新聞
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您正在幫助確保未來能夠繼續報道關於塑造我們今天世界的發現和想法的具有影響力的故事。
生殖科學家和一些與不孕不育作鬥爭的夫婦正在密切關注林克彥的進展,以及類似的努力,這些努力已成功地將齧齒動物幹細胞(可以發育成任何型別特化細胞的祖細胞)轉化為基本的精子。如果這些卵子和精子技術能夠應用於人類,我們或許有一天能夠用血液或皮膚細胞來替代我們有缺陷的配子。在那個未來,男性不必擔心缺乏健康的精子。而女性也無需眼睜睜地看著自己成為母親的機會隨著30歲的到來而消逝,幾乎任何年齡的女性都可以獻出一點血液,最終得到一批卵子。同性伴侶或許有一天也能夠擁有在生物學上與他們都有血緣關係的孩子。
這一希望仍然令人嚮往,但卻遙不可及。多年來旨在尋找可靠的替代卵子和精子細胞(創造大多數哺乳動物生命所必需的)的動物實驗尚未成功。但即使是這些在小鼠和人類細胞中進行的非常初步的工作,也引發了科學界對最終人類應用的倫理問題的浪潮。
計劃生育
為了使這種生殖過程在小鼠身上奏效,林克彥的團隊需要將幾個早期的發現聯絡起來。在2010年,它練習了按下細胞的“重置”按鈕,將它們送回到它們找到自身身份之前的階段。該團隊首先追溯了日本京都大學的山中伸彌(Shinya Yamanaka)開發的過程,他因此獲得了2012年諾貝爾獎。
首先,研究人員從成年小鼠的尾巴上刮取皮膚細胞。然後,他們向其中注射了一種含有四種特定基因的化學混合物,將成體細胞轉化回能夠變成多種不同型別細胞的幹細胞。接下來,他們採用了英國古爾登研究所(Gurdon Institute)的阿齊姆·蘇拉尼(Azim Surani)和當時在蘇拉尼實驗室工作的齋藤通紀(Mitinori Saitou)在21世紀初建立的遺傳學見解。(兩人後來都成為了林克彥的導師。)這項工作,以及對來自普通小鼠胚胎的胚胎細胞進行的相關實驗,最終幫助林克彥的團隊瞭解了哪些基因是誘導幹細胞成為卵子祖細胞(稱為原始生殖細胞)所必需的。
.png?w=900)
圖片來源:塔米·托爾帕
但有一個問題:原始生殖細胞,它可以發育成精子或卵子,仍然像任何典型的動物細胞一樣具有兩組染色體。為了形成性細胞(每個親本僅有一組基因),生殖細胞必須經歷兩次細胞分裂,這個過程稱為減數分裂。在雌性中,第一次細胞分裂發生在胚胎中,當原始生殖細胞進入生殖系統時。第二次分裂發生在排卵期間,此時卵子在暴露於多種激素後最終成熟。在創造出原始生殖細胞後,林克彥和他的同事們能夠將它們放回活體小鼠體內以完成其發育——達到當時的科學邊界。然而,為了在培養皿中創造出可存活的卵子,研究人員需要了解並重新創造卵子成熟途徑中的每一步。
科學家們發現,關鍵在於更仔細地模仿自然。他們花費了數年時間來調整培養轉化卵細胞的溶液。一個突破來自於團隊在培養基中加入來自其他小鼠胎兒卵巢的細胞,同時在培養皿中使細胞成熟。卵巢釋放出激素混合物——基本上創造了一個類似卵巢的環境,以欺騙細胞,讓它們認為自己仍在體內。此外,科學家們還改變了液體培養基的粘度,以模仿在小鼠體內發現的粘度。
一旦他們得到了正確的培養基,並且卵子在實驗室中成熟,接下來的步驟就類似於任何其他體外受精(IVF)程式。研究人員首先在實驗室中將成熟的卵子和正常的小鼠精子結合在一起。幾天後,他們使用一個微小的移液管選擇了一個有希望的胚胎,並將其注射到一隻雌性小鼠體內,由它孵育20天的小鼠胎兒。最後,在經歷了許多失敗的嘗試後,小鼠會流產,或者胚胎無法植入,或者它會變成死胎,這個過程最終導致了一隻健康的小鼠幼崽的誕生。最終,更多的小鼠幼崽也相繼誕生。
然而,這個過程仍然遠非完美。在林克彥小組創造的數百個幹細胞中,只有16個在為期五週的小鼠卵子成熟過程中存活下來。當科學家們將成功的實驗室製造的卵子與精子結合時,只有極小一部分由皮膚細胞轉化而來的卵子最終變成了健康的小鼠幼崽(相比之下,從成年小鼠身上取出的卵子並在體外受精的成功率為62%)。然而,科學家們證明了他們的方法是可行的。這八隻小鼠幼崽長大後變得正常而健康。它們甚至繼續交配並生育了活潑的幼崽。
當精子遇到卵子
很多人需要生殖方面的幫助。超過10%的美國男性和類似比例的女性被認為是不育的。克服不孕不育的選擇是艱鉅的,而且往往不成功。例如,試管嬰兒需要女性接受一到兩週的激素注射,旨在釋放多個卵子。然後,其中少數卵子將在實驗室中與精子受精,並植入一到兩個。費用主要由個人承擔,很容易超過20,000美元,然而,大約65%的體外受精週期仍然失敗,通常是由於卵子質量差。此外,如果某人沒有健康的卵子或精子,試管嬰兒也無濟於事。
很明顯,為什麼挖掘人類血液或皮膚細胞來製造嬰兒是一種誘人的替代方案。林克彥說,與其提取人類卵子,醫護人員可以抽取一小瓶潛在母親的血液。(血液在醫療機構中是常規抽取的,可能比皮膚細胞更容易在人體患者身上獲取,儘管兩者都可以使用。)
實驗室中的科學家可以將這些血細胞轉化為幹細胞,然後在經過幾個步驟後,轉化為卵子或精子。接下來,可以將製造的卵子與正常精子受精,反之亦然,並使用與試管嬰兒相同的方法植入女性體內——使孩子獲得他或她通常會從每個親本那裡獲得的相同遺傳物質。
林克彥說,目前該程式應用於人類的風險太高,只有當科學家創造的卵子能夠像天然卵子一樣經常導致健康胚胎時,該程式才會被接受。首先,研究人員必須證明,他們能夠使卵子在實驗室中存活足夠長的時間,以密切模擬人類發育所需的時間。(在小鼠中,卵細胞在五天內成熟;在女性中,它們大約需要30天。)然而,在生殖科學家甚至可以考慮以這種方式創造嬰兒之前,他們將不得不確認該過程在更接近人類的大型動物身上是否有效。
共同成長
為了克服這個障礙,林克彥的團隊已經在與靈長類動物——狨猴合作。但幾個主要挑戰阻礙了他們的進展。小鼠是很好的研究物件,因為它們每五天排卵一次,懷孕期為20天。狨猴的妊娠期超過140天,因此即使所有科學都完美執行,製造嬰兒也需要更長的時間。狨猴原始生殖細胞成熟為卵子所需的時間比小鼠卵子成熟的時間長得多,林克彥和他的團隊尚未找到一種能夠使細胞存活足夠長時間以實現這一目標的實驗室環境。
在他們對齧齒動物的研究中,研究人員瞭解瞭如何在活體小鼠體外使原始生殖細胞成熟,但他們仍然需要來自小鼠胎兒的卵巢細胞來輔助這個過程。為了確保原始生殖細胞在猴子體記憶體活和成熟——並能夠擴大這項工作,最終創造出更多的實驗室培養的卵子——林克彥認為他必須做的不僅僅是將卵巢細胞轉移到培養皿中。他將不得不確定傳送關鍵成熟訊號的特定卵巢細胞,並弄清楚如何從幹細胞中提取它們。這樣,在未來階段的工作中,他將能夠培養所有必要的成分——而不是繼續依賴於挖掘其他胎兒的卵巢細胞。
古爾登研究所生殖系和表觀基因組學研究主任、該領域的先驅蘇拉尼一直在試驗這些關鍵“輔助”細胞的不同組合,以支援生殖細胞的成熟和通訊。“[生殖]細胞實際上會經歷到某個點,然後它們需要一些非常具體的東西來突破下一個點——它們需要訊號或環境的改變——或其他什麼,”蘇拉尼解釋說。他和他的團隊一直在對哪些細胞可能在該過程中特別重要進行有根據的猜測,但這是一項緩慢而艱苦的工作。為了幫助指導他們的下一步工作,他們現在正在研究流產的人類胎兒,以尋找關於卵細胞成熟每一步的線索。該實驗室也開始使用豬,而不是小鼠,因為豬的發育更接近人類,而且豬比猴子更便宜。齋藤和他的實驗室最近在《科學》雜誌上發表了一篇論文,表明他們已經從成體細胞中創造出了人類卵子前體細胞。這個過程花費了很長時間,並且產生的類卵子前體結構很少,這表明在人類中製造卵子可能比在小鼠中複雜得多。
除了調整培養皿方案外,可能還有另一種方法來推進這個過程。一些研究人員認為,他們將透過儘快在體內移動他們製造的細胞來獲得更好的結果,從而利用身體的自然質量控制系統,該系統可以消除有缺陷的配子,併為剩餘的細胞競爭者留下更多資源。蒙大拿州立大學的幹細胞科學家蕾妮·雷喬·佩拉(Renee Reijo Pera)正在她的精子研究中採取這種方法。她說,在自然界中,只有最健康的精子才能存活下來並使卵子受精,但在培養皿中製造和成熟精子會消除這種競爭,從而增加了缺陷精子受精的風險。由於人體經過精細調整以淘汰不良精子,雷喬·佩拉將她的工作重點放在製造可以在睪丸中成熟的原始精子上。“我們認為應該由身體來做選擇,”她說。“在培養皿中,我擔心我們會迫使那些在自然環境中不會發生的事情向前發展。”
無論科學家採取什麼預防措施,一些批評家都認為,永遠不應該使用人工卵子或精子來創造人類生命。例如,瑪西·達爾諾夫斯基(Marcy Darnovsky)認為,實驗室生成的生殖細胞永遠不可能足夠安全,以證明其風險是合理的。達爾諾夫斯基是遺傳與社會中心(Center for Genetics and Society)的執行主任,該中心是一個倡導負責任地使用人類遺傳技術的公共利益組織。她說,她完全支援那些能夠更好地理解人類和動物發育的研究。但她劃了一條界線,反對使用工程化的卵子和精子來創造新的生命——尤其是人類生命。“我認為這對任何由此產生的孩子來說都可能具有極高的生物學風險,”她說,並引用了哺乳動物克隆的例子:許多克隆胚胎未能發育,一些動物出生時就患有可怕的健康問題。達爾諾夫斯基認為,需要公共政策來確保林克彥、蘇拉尼、雷喬·佩拉和其他人正在追求的科學進步不會走得太遠。
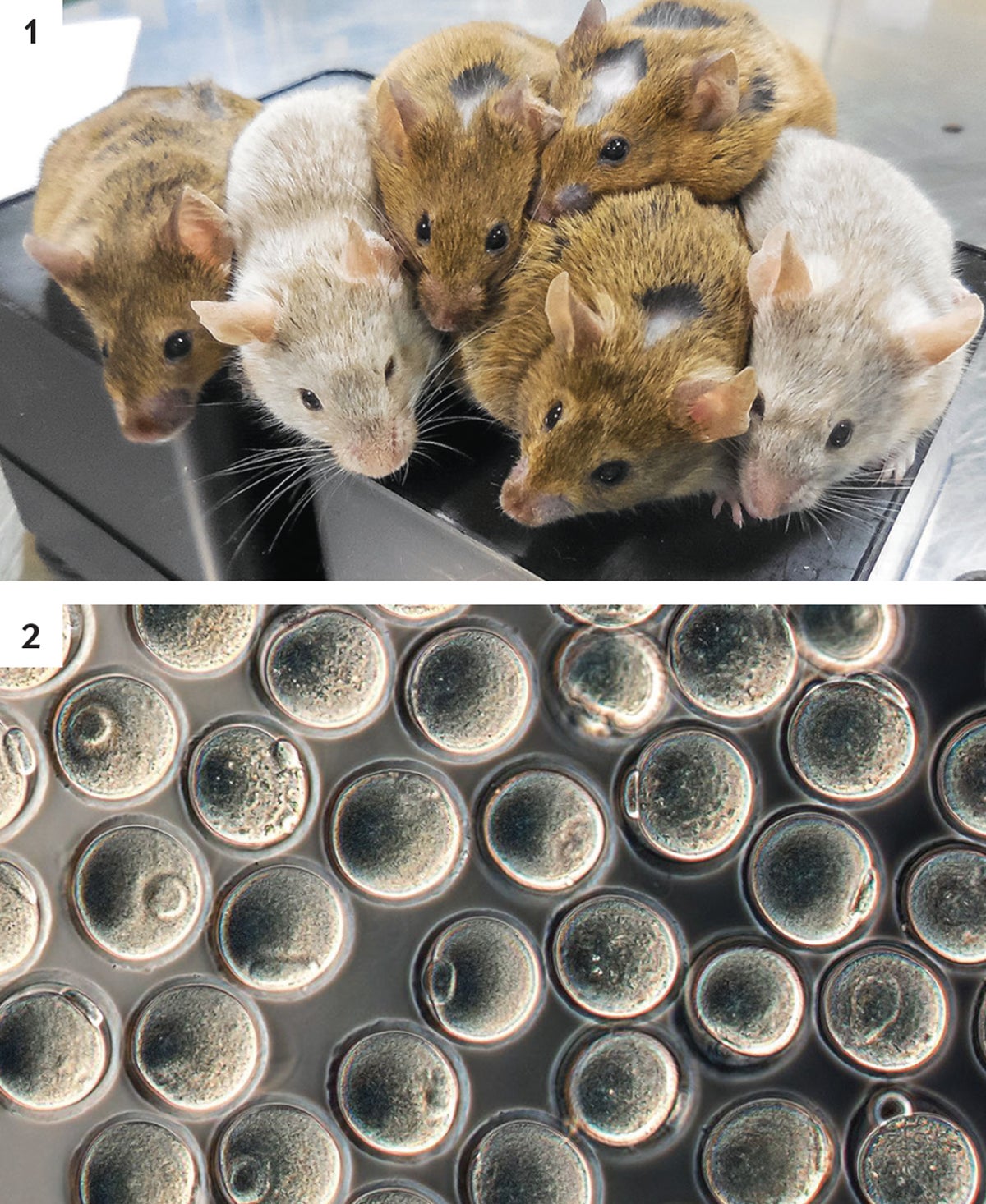
用實驗室製造的卵子和典型的小鼠精子創造的小鼠是健康的 (1)。這些卵子來源於胚胎幹細胞 (2)。
圖片來源:林克彥 九州大學;摘自戴維·西拉諾斯基(David Cyranoski)在《自然》雜誌第538卷中發表的“在培養皿中用皮膚細胞製造的小鼠卵子”;2016年10月20日
關於這種方法可能對我們理解生育意味著什麼,仍然存在其他擔憂。例如,如果任何人的細胞都可以被操縱成精子或卵子,這是否預示著未來個人的細胞可以同時變成精子和卵子——創造出單親後代?或者,是否有人能夠從一個人的餐巾紙或床上偷偷摸摸地拿走一個脫落的皮膚細胞,並在未經其同意或不知情的情況下創造一個孩子?此外,正如哈佛醫學院院長喬治·戴利(George Daley)及其同事在2017年《科學轉化醫學》雜誌上撰文指出的那樣,這種技術可能會以前所未有的規模創造胚胎——引發人類生命貶值的幽靈,以及令人困惑的政策挑戰。
研究人員表示,迄今為止,倫理方面的擔憂限制了任何與人類相關的體外配子發生研究,並將資金保持在最低水平。在美國,涉及胚胎的科學研究長期以來一直受到限制。奧巴馬政府對幹細胞研究比其前任政府更為友好,但在唐納德·特朗普領導下,鐘擺已經有所回擺。蘇拉尼和英國利茲大學從事相關工作的海倫·皮克頓(Helen Picton)表示,在其他國家,此類研究缺乏資金,並且難以獲得天然胚胎的組織樣本進行比較,這給研究增加了額外的挑戰。例如,林克彥說,他在他的祖國日本很難進行人類生殖細胞研究。(日本法律禁止對人類生殖細胞進行受精,即使是出於研究目的。)但以色列魏茨曼科學研究所的幹細胞科學家雅各布·漢納(Jacob Hanna)表示,由於文化上對推進生殖技術的興趣,他更容易開展研究。
倫理難題
科學家們說,即使他們永遠不會製造出人類嬰兒,僅僅是追求製造卵子和精子的目標也會有回報:在治療不孕不育、理解早期發育以及揭示毒素可能對人類遺傳產生的影響方面。“這是一次發現之旅,”專門研究卵巢生理學和生殖的皮克頓說。例如,弄清楚如何識別高質量的卵子和精子可能有助於改進試管嬰兒的選擇過程。而改進配子創造配方的過程將為深入瞭解細胞出錯導致疾病、出生缺陷或細胞死亡的原因提供最初的真正見解。
瞭解如何從皮膚或血液細胞製造卵子和精子也可能有助於科學家更好地揭示被稱為表觀遺傳學的遺傳——不是基因的變化,而是基因表達的變化。瞭解精子和卵子如何在早期形成可能使我們能夠仔細檢查這些細胞中是否積累了甲基或其他基因變化。目前,關於某些性狀似乎在不改變潛在遺傳基因的情況下被傳遞下來的問題有很多。例如,在2016年的一項研究中,在大屠殺倖存者在創傷發生多年後出生的孩子身上發現了與調節應激激素相關的基因區域的表觀遺傳變化。基因沒有改變,但基因的行為方式似乎被傳遞了下來。蘇拉尼說,能夠從幹細胞中生成卵子和精子可能使科學家能夠深入研究這種表觀遺傳過程,並可能為衰老相關疾病提供見解,這些疾病通常是由表觀遺傳標記的積累引起的。對這些標記如何在發育中的生殖細胞中被擦除的新理解甚至可能產生治療衰老相關疾病的方法。
蘇拉尼現在正在研究線粒體——細胞的能量來源——在卵子製造過程中的表現。線粒體在生殖過程中會經歷一個選擇過程,孩子只接收來自母親的遺傳物質。糾正線粒體缺陷的過程尚不清楚,但蘇拉尼希望,透過研究生殖細胞如何糾正此類錯誤,他和他的同事可以瞭解很多關於細胞能量和相關疾病的知識。“在這個過程中,我們可以收集可能對人類健康產生巨大影響的知識,”他說。
林克彥希望這些努力也將有助於拯救和恢復幾乎滅絕的物種,例如白犀牛。他說,透過提高他們對配子形成過程的理解,研究人員將更有能力與可能滅絕的物種合作。他目前正在嘗試在北方白犀牛身上覆制他的小鼠研究。儘管進展緩慢,但林克彥認為人工授精最終將使科學家能夠拯救這個瀕臨滅絕的物種。但等待時間要長得多。他指出,小鼠懷孕20天;白犀牛懷孕16個月。
林克彥說,當他向觀眾談論他的白犀牛工作時,每個人看起來都很高興。但當他提到在人類身上進行類似的研究時,“有些人非常懷疑,有些人非常害怕。”林克彥理解他們的擔憂。在人類幹細胞能夠成功轉化為可存活的卵子和精子之前,將會浪費大量的人類生殖細胞和胚胎。他告誡說,即使是可存活的配子也可能仍然帶有出生缺陷的風險。
雷喬·佩拉認為,倫理確實支援研究這項工作在人類中的應用——而且,如果能夠足夠安全地完成,甚至可以利用它來創造人類。作為一名不孕不育的癌症倖存者,雷喬·佩拉認為,幫助夫婦生育孩子是這項探索的理由。
然而,關於究竟什麼應該被認為是安全的,以及應該由誰來決定,仍然存在棘手的問題。當科學家們開發出其他有爭議的技術,如試管嬰兒和基因編輯CRISPR系統時,研究人員、倫理學家和公眾成員之間的正式會議幫助制定了關於其潛在應用的建議和指南。研究人員和倫理學家指出,體外配子發生也可能需要這樣做。此外,這些對話應該在科學發展到人類可以使用它的階段之前很久就進行。“在不可避免的事情發生之前,社會最好發起並保持對[體外配子發生]的倫理挑戰的有力公開對話,”戴利和他的同事在他們2017年1月的論文中寫道。“隨著科學和醫學以驚人的速度向前發展,生殖醫學和再生醫學的快速轉型可能會讓我們感到驚訝。”

