基因療法在人體中經歷了三十年的蹣跚起步後,正逐漸成為少量但不斷增長的疾病的治療選擇。儘管在 1970 年代提出這一概念時,它面臨著科學和倫理方面的不確定性,但該方法的基礎——替換或修復單個致病基因——已被證明是可靠的。研究人員已經開發出不同的方法來糾正或影響某人基因的功能方式,並利用這些技術為多種血液疾病以及退行性眼病和肌肉疾病建立了療法。過去五年中,美國已批准了六種以上的此類療法,並且針對各種疾病的許多其他療法正在朝著臨床試驗邁進。
現有的基因療法依賴於兩種基本方法。更常見的方法是從患者身上抽取血液,並在實驗室中對特定細胞進行重新程式設計,然後再將它們重新注入人體。另一種方法是將基因療法直接輸送到體內,通常是更容易觸及的區域,例如眼睛。現在,該領域開始成熟,並超越這些最初的策略。持續的進步使基因傳遞更加安全有效,從而在新的組織(如肝臟和心臟)中進行了數十次人體試驗。其他方法正在超越基因療法的最初定義,採用尖端的分子工具來修復基因內的錯誤,而不是替換或插入整個基因。
然而,儘管最近取得了進展,基因療法在更廣泛的臨床應用道路上仍面臨許多障礙——其中最主要的是如何在不觸發免疫反應的情況下靶向特定組織。更廣泛、長期的挑戰包括提高生產效率和降低成本:在美國,基因療法目前的平均治療費用超過每劑 40 萬美元。儘管如此,憑藉如此巨大的潛力和如此多需要新解決方案的患者,基因療法只會繼續在知名度和效力方面不斷增長。
早期的成功和衝擊波
最初的基因療法方法(其中一些方法仍在應用)背後的概念相當簡單:當疾病是由缺失或功能失調的基因引起時,將該基因的功能性副本傳遞到受影響的細胞中。加州大學聖地亞哥分校的生物工程師普拉尚特·馬利說,這是“基因療法 1.0 版本的定義”。
最早的嘗試之一發生在 1990 年,當時美國國立衛生研究院的研究人員治療了兩名患有嚴重免疫缺陷的年輕女孩,這種免疫缺陷是由酶缺失引起的。在那次試驗中,與許多目前的治療方法一樣,產生酶的治療基因搭乘工程病毒進入靶細胞,這些病毒的大部分基因組已被剝離。這使得病毒無法複製,同時為傳遞所需的人類基因騰出了空間。杜克大學高階基因組技術中心主任查爾斯·格斯巴赫說,本質上,這種方法利用了病毒感染人類細胞的能力,同時“利用病毒外殼作為特洛伊木馬,傳遞治療性基因貨物”。
美國國立衛生研究院團隊抽取了女孩們的一些血液來分離白細胞,然後用攜帶編碼缺失酶基因的病毒“感染”這些白細胞。接下來,該團隊將經過糾正的細胞輸注到女孩體內。每個孩子在接下來的 18 到 24 個月內接受了大約十幾次輸注。這種治療方法並非治癒,但減輕了她們的症狀,並證明了該方法可以安全使用。格斯巴赫說,就其本身而言,這是一個“重要的里程碑”。
隨後迅速湧現出大量新的基因治療試驗,但在 1999 年,18 歲的傑西·格爾辛格在接受旨在治療其代謝性肝病的一項實驗性基因治療時去世,該治療使他的免疫系統過度運轉。幾年後的 2003 年,研究人員報告稱,幾名接受免疫缺陷治療的人患上了白血病,這是病毒隨機將其貨物插入基因組的促癌區域的不幸結果。
格斯巴赫說,研究人員開始思考,“‘等等,也許我們對它的理解不如我們想象的那麼好。’”基因療法停滯了近十年。臨床試驗暫停,研究人員將所有注意力重新轉向實驗室——研究和調整病毒載體,去除額外的基因,並用化學物質處理它們,使其更安全、更有效地到達靶細胞。
重新聚焦為更好地理解什麼有效、什麼無效提供了時間和空間。今天,由於取得了這些進展,許多基因療法採用了腺相關病毒 (AAV) 或逆轉錄病毒載體,除了早期試驗中改進的腺病毒載體外,每種載體都有其自身的優點和缺點。大多數 AAV 載體傳遞的遺傳貨物作為單獨的、自由漂浮的元件保留在細胞內,而不是穩定地整合到宿主細胞的基因組中。這使得這些載體比早期載體誘發癌症的可能性大大降低,但根據治療基因在宿主細胞中保留的時間長短,可能會使治療的永續性降低。另一方面,由於它們體積小,因此可以感染範圍廣泛的細胞並在組織內有效傳播。逆轉錄病毒具有不同的優勢。與 AAV 載體相比,它們可以容納更大、更復雜的基因。而且,一些逆轉錄病毒,如慢病毒,傾向於將自身插入編碼區,即基因組中被翻譯成蛋白質的部分。這最大限度地降低了癌症風險,同時比 AAV 載體帶來更持久的益處。
領域復甦
基因療法在 2010 年代初期重新開始,當時賓夕法尼亞州和馬里蘭州的研究人員分別報告了治療白血病或淋巴瘤的試驗結果。實驗性療法訓練並增強了患者的免疫系統,使其能夠檢測和摧毀癌細胞。為此,科學家們必須設計基因,使細胞能夠識別和殺死腫瘤。他們將這些基因放入逆轉錄病毒載體中,並將它們傳遞到 T 細胞,即從受試者血液中分離出來的免疫細胞。當經過治療的 T 細胞被重新輸注時,它們使癌症進入緩解期。“一切看起來又非常有希望了,”辛西婭·鄧巴說,她是一位在國家心肺血液研究所研究血細胞治療的醫生科學家。
美國食品和藥物管理局此後批准了幾種此類 T 細胞療法,稱為嵌合抗原受體 (CAR) T 細胞療法,用於治療某些淋巴瘤和白血病,以及多發性骨髓瘤。由於 CAR T 細胞治療本身並不解決基因功能障礙,而是賦予 T 細胞腫瘤追蹤能力,因此有些人爭論它們是否完全符合基因療法的資格。然而,從方法論上講,CAR T 透過使用病毒載體傳遞基因來增強細胞功能——類似於最早的嘗試。“你對‘基因療法’的定義在邊緣上有點模糊,”鄧巴說。
另一種在類別邊緣有點模糊的基因方法被稱為寡核苷酸療法。該技術不是糾正現有基因,而是使用短核酸序列或寡核苷酸來影響細胞如何將基因翻譯成蛋白質。其中一種治療方法努西內生(Spinraza)與中間 RNA 分子結合,誘騙細胞產生更多在脊髓性肌萎縮症患者中缺失的蛋白質。
基因療法 2.0
馬利說,在過去的十年中,技術進步迎來了一個新時代,基因療法的定義也在不斷發展。最新的方法放棄了健康基因的傳遞,而是旨在精確修復細胞內的基因。馬利說,當基因組中存在突變或其他錯誤時,現在的問題是,“我們是否真的可以進去修復它?”
這項創新得益於獲得諾貝爾獎的 CRISPR-Cas9 的發現,CRISPR-Cas9 是細菌中的一種免疫防禦系統,它可以檢測入侵病毒的特定 DNA 序列,並引導一種酶切斷並摧毀病毒基因組。該系統在細菌之外具有廣泛的用途:科學家們發現他們也可以使用它在哺乳動物基因組內進行精確切割。在短短七年內,這項技術已從哺乳動物細胞的體外實驗室實驗發展到人體試驗。
基於 CRISPR 的療法中的“貨物”不是 DNA 片段,而是基因編輯系統本身,透過病毒、奈米顆粒或單獨作為 RNA-蛋白質複合物引入細胞。這些療法可以在體外(體外)使用,在將細胞返回患者之前在實驗室中改變細胞,或者透過將基因編輯工具直接傳送到受影響的組織,在那裡它們編輯細胞基因組。
數十家公司目前正在開發此類基於 CRISPR 的療法。一項早期臨床試驗採用了一種體外基因編輯方法來治療患有鐮狀細胞病或相關血液疾病(稱為 β-地中海貧血)的人。這些研究人員在 2021 年 1 月報告了他們前兩名受試者的結果。6 月,另一家公司報告了首次成功的直接基因編輯試驗,該試驗使用奈米顆粒將 CRISPR-Cas9 元件傳遞到肝細胞中,並使一種與罕見疾病(稱為轉甲狀腺素蛋白澱粉樣變性)相關的基因失活。
新興方法允許更高的精度和細微差別——例如,交換單個核苷酸,或暫時抑制基因的活性而不改變其 DNA——使研究人員有餘地將他們的目標定得更高。他們正在研究神經系統疾病、自身免疫性疾病和其他癌症的治療方法。從長遠來看,他們的目標是從單基因疾病轉向治療由多個基因相互作用引起的疾病,例如心血管疾病和慢性疼痛。隨著基因療法成功緩解了一些疾病,研究人員、臨床醫生和患者都希望保持過去十年的進展,並將基因療法確立為現代醫學的基石。
編輯生命之書
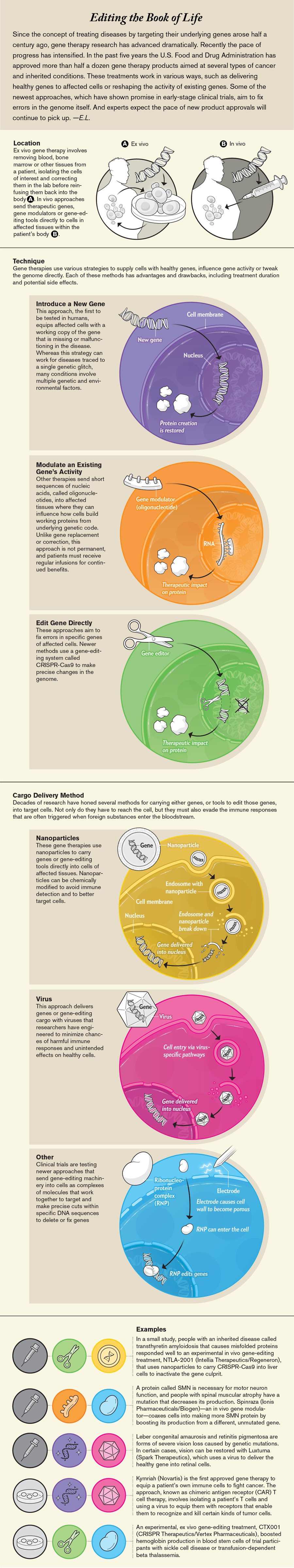
圖片來源:Now Medical Studios;來源:“曾經和未來的基因療法”,作者:Karen Bulaklak 和 Charles Gersbach,發表於《自然通訊》,第 11 卷;2020 年 11 月(參考文獻);辛西婭·鄧巴美國國立衛生研究院(專家評審)
