大約三十年前,一位名叫大衛·P·斯特拉坎的英國流行病學家提出了一個簡單但違反直覺的觀點,以解釋為什麼在過去一個世紀中,花粉熱、溼疹和哮喘變得越來越普遍。斯特拉坎將英國這些過敏性疾病發病率的上升與工業革命以來生活水平的提高聯絡起來——特別是,幼兒時期經歷的感染次數急劇下降。他推測,生命最初幾年接觸細菌和病毒(如果嬰兒能存活下來)會在某種程度上預防這些疾病在以後出現。
儘管斯特拉坎最初的直覺,現在通常被稱為衛生假說,關注的是過敏性疾病,但研究人員後來也使用其基本原則——接觸或缺乏接觸環境影響——來解釋歷史上各種其他疾病的增加。這些疾病包括脊髓灰質炎、多發性硬化症和1型糖尿病。許多流行病學調查揭示了某些疾病模式隨著工業化從歐洲蔓延到北美及其他地區而不斷升級。凡是兒童期感染(和死亡率)下降的地方,幾種以前罕見的疾病的發病率就開始上升——儘管並非均勻地且並非同時發生。
嚴重的脊髓灰質炎爆發最早出現在19世紀末。多發性硬化症的發病率(免疫系統攻擊特定神經細胞周圍的保護層)在20世紀下半葉在世界某些地區翻了一番。1型糖尿病(當身體錯誤地破壞胰腺中產生激素胰島素的細胞時發生,胰島素使身體能夠利用葡萄糖獲取能量)在20世紀上半葉開始緩慢上升,並在1950年代急劇上升。
支援科學新聞事業
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞事業 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們當今世界的發現和想法的具有影響力的故事的未來。
早期接觸各種病毒或細菌如何能預防許多看似無關的疾病的出現,其確切機制仍然不清楚。某種程度上,感染使發育中的身體學會如何應對病原體。此外,缺乏接觸這些微生物可能會促使身體攻擊自身。特別是,大量研究表明,一大類病原體——腸道病毒——與脊髓灰質炎和1型糖尿病的激增有關。
與更常見的2型糖尿病(通常與成年後體重增加有關)不同,1型糖尿病通常在20歲之前發病。我們對容易自發患上1型糖尿病的小鼠進行的實驗表明,同一株腸道病毒可以透過複雜的機制來預防或引發該疾病,這取決於小鼠感染時的年齡。假設我們的結果在人類身上得到證實,那麼基於一組通常在糞便中排洩的病毒的疫苗有可能預防許多人的1型糖尿病。
一個世紀的線索
我們的研究始於一個基本問題,類似於斯特拉坎提出的問題:為什麼1型糖尿病在過去如此罕見,但在1950年代卻成為一種禍害?在古代,希臘、阿拉伯、印度和中國的醫生都描述了一種罕見的症狀群——包括體重迅速下降、異常口渴以及品嚐時帶有甜味的尿液——這幾乎可以肯定是1型糖尿病的結果。研究人員根據個別醫院的資料推斷,在20世紀初,每10萬名15歲以下兒童中約有1到2人患上1型糖尿病。今天,在美國部分地區,這個數字接近每10萬名兒童20人,而在芬蘭,則超過每10萬名兒童60人。令人不安的是,這些數字仍在繼續上升。
然而,這種增長並非穩步上升。在一些國家緩慢上升多年之後,1型糖尿病在20世紀中葉開始飆升。從那時起,流行病學家計算出全球平均每年增長3%到5%。在1998年至2010年間,1型糖尿病的發病率驚人地躍升了40%。
如此短的時間內如此急劇的上升告訴我們,我們看到的不是人類基因庫的根本變化:DNA不會如此迅速地突變。許多基因的不同組合深刻地增加了個體患上1型糖尿病的風險。然而,據研究人員所知,這些高風險基因譜的流行率並沒有改變。相反,越來越多具有相對較低1型糖尿病遺傳易感性的人現在正在遭受這種疾病的折磨。很少有病例可以完全歸因於遺傳疾病。來自世界各地科學家的這些和其他發現強烈表明,新出現的環境因素必然在起作用。
多年來,人們考慮過各種可能性——但都被駁回了。與2型糖尿病不同,1型糖尿病不能由人的飲食或其他與健康相關的習慣引起。更令人感興趣的是,幾項研究確定,1型糖尿病在離赤道越遠的地方發生頻率越高。維生素D的缺乏是否可能是這種區域差異的原因?維生素D很容易在身體暴露在陽光下時產生。然而,這個想法很快就被推翻了。例如,流行病學家發現,芬蘭等一些最北端的國家,在陽光較多的地區比陽光較少的地區1型糖尿病的發病率更高。
大量證據反而指向病毒觸發因素——可能是一種或多種存在於汙水或受汙染飲用水中的病毒。大量研究表明,腸道病毒——之所以如此命名是因為它們通常存在於腸道中(古希臘語中énteron的意思是腸)——是罪魁禍首。(事實上,沒有實質性資料將任何其他型別的病毒或環境影響與該疾病聯絡起來。)一些腸道病毒能夠在胰腺中複製,炎症區域與產生胰島素的胰島細胞所在的區域相鄰。炎症區域產生自身免疫性T細胞。在正常情況下,我們的T細胞保護身體免受入侵者的侵害。然而,自身免疫性T細胞會攻擊身體自身的胰島細胞,破壞它們產生胰島素的能力,從而導致糖尿病。
研究人員已經統計出100多種腸道病毒。然而,似乎沒有單一型別的腸道病毒單獨負責在全球範圍內引發糖尿病。相反,科學家們已經確定了一些候選病毒,其中最主要的是六種被稱為柯薩奇B組病毒的腸道病毒,它們與該疾病的發生有關。他們不完全理解這種感染如何可能促使身體攻擊自身。這個過程必然是複雜的:流行病學研究表明,某些似乎會促進某些人患上該疾病的特定腸道病毒,顯然可以保護另一些人免於患上該疾病。
圖片來源:Amanda Montañez
汙水
當我們評估可能識別出導致糖尿病的腸道病毒的各種實驗時,我們從另一種疾病中尋找線索:脊髓灰質炎。脊髓灰質炎是一種通常導致兒童癱瘓的疾病,它是由另一類腸道病毒——脊髓灰質炎病毒引起的。這些病毒似乎已經存在了數千年:一塊古埃及石碑(一塊刻在石板上的浮雕),現在在哥本哈根博物館展出,似乎描繪了一位脊髓灰質炎患者。然而,它們引起的這種可怕的疾病過去非常罕見,直到19世紀末,零星的和隨後的年度流行病突然開始發生。在20世紀,脊髓灰質炎奪走了數萬名兒童的生命,並使數百萬兒童致殘。就在1988年,脊髓灰質炎每天使約1000名兒童致殘。得益於大規模疫苗接種運動,脊髓灰質炎現在僅在兩個國家流行。
衛生假說有助於解釋脊髓灰質炎病例的這種突然激增。人們很容易忘記,發達國家當代生活的許多便利設施只有大約一個世紀的歷史。在歐洲和北美廣泛安裝市政供水系統之前,人們從井、池塘或公共噴泉取水用於所有目的,包括飲用、洗澡和洗衣服。毫不奇怪,飲用水經常被人類或動物糞便汙染。自來水和肥皂的缺乏也意味著人們在如廁後無法像今天這樣嚴格地保持雙手清潔。因此,簡單的準備飯菜或握手的行為可能會廣泛傳播細菌。
因此,幾乎每個人,從生命早期開始,都暴露於從人類糞便傳播到環境中的脊髓灰質炎病毒。然而,新生兒往往不會患上這種疾病,因為他們的母親已經對病毒產生了免疫力,並將保護性抗體傳遞給懷孕期間發育中的胎兒和哺乳期間的嬰兒。隨著嬰兒長大並停止哺乳,並且隨著母體抗體減弱,幼兒開始由於反覆接觸病毒而產生自身針對該病毒的保護性抗體。因此,儘管脊髓灰質炎病毒幾乎無處不在,但脊髓灰質炎本身並不常見,因為年輕人首先受到母親抗體的保護,隨後又受到自身免疫系統的保護。
這種保護鏈,作為人類生活的一部分已存在億萬年,隨著人類群體進入一個“更清潔”的世界而開始斷裂。一個可能倖免於接觸脊髓灰質炎病毒的男孩可能會在以後的生活中遇到它們,那時他沒有任何保護性免疫力。這種與脊髓灰質炎病毒的偶然相遇可能會導致麻痺性脊髓灰質炎——每100到200例脊髓灰質炎病毒感染中發生一次。這可能就是為什麼例如富蘭克林·D·羅斯福總統在加拿大新不倫瑞克省的一個島嶼度假時,在39歲時患上麻痺性脊髓灰質炎。
儘管脊髓灰質炎留下了可怕的遺產,但我們從以下事實中獲得了一些安慰:針對引起脊髓灰質炎的病毒感染的疫苗已被證明是安全且非常有效的。如果研究人員可以製造出針對一種腸道病毒的疫苗,他們也應該能夠製造出針對其他腸道病毒的疫苗。如果實驗證明腸道病毒會導致1型糖尿病,那麼這一發現可能會指向一種潛在的新療法:即,一種針對1型糖尿病的疫苗,該疫苗將保護那些風險最高的人免受病毒感染。
(我們可以排除脊髓灰質炎病毒作為1型糖尿病的病因。儘管脊髓灰質炎流行病在20世紀變得司空見慣,但沒有觀察到1型糖尿病的平行爆發。此外,脊髓灰質炎已在1型糖尿病發病率持續上升的國家被根除。)
為了證明病毒會引起特定疾病,應該首先從受影響的組織中分離出病毒。對於1型糖尿病,那就是胰腺。但是安全地從人類胰腺中取樣組織仍然是一項外科挑戰——這就是為什麼很少對其他方面健康的人進行這種活檢的原因。此外,要準確確定身體免疫系統何時開始攻擊胰腺並破壞產生胰島素的胰島細胞極其困難。當明確某人患有1型糖尿病時,任何可能是活動性感染跡象的跡象通常都已消失。
然而,大約40份已發表的報告令人信服地將各種腸道病毒的存在與1型糖尿病的發生聯絡起來:病毒或其遺傳物質是從患者的死後胰腺組織中分離出來的。其他研究表明,某種腸道病毒感染很可能在1型糖尿病的發展中起著長期作用。
碰巧的是,一種特定的小鼠品系,即非肥胖型糖尿病 (NOD) 小鼠,會在沒有任何研究人員干預的情況下自行患上1型糖尿病。(奇怪的是,在衛生條件下飼養的NOD小鼠比在骯髒籠子中飼養的小鼠患病速度更快。)我們假設NOD小鼠類似於具有1型糖尿病遺傳易感性的人類。此外,與大多數腸道病毒不同,柯薩奇B組病毒在小鼠體內複製良好,並且已經與1型糖尿病聯絡起來。所有這些因素使NOD小鼠成為探索腸道病毒與1型糖尿病之間關係的理想模型。
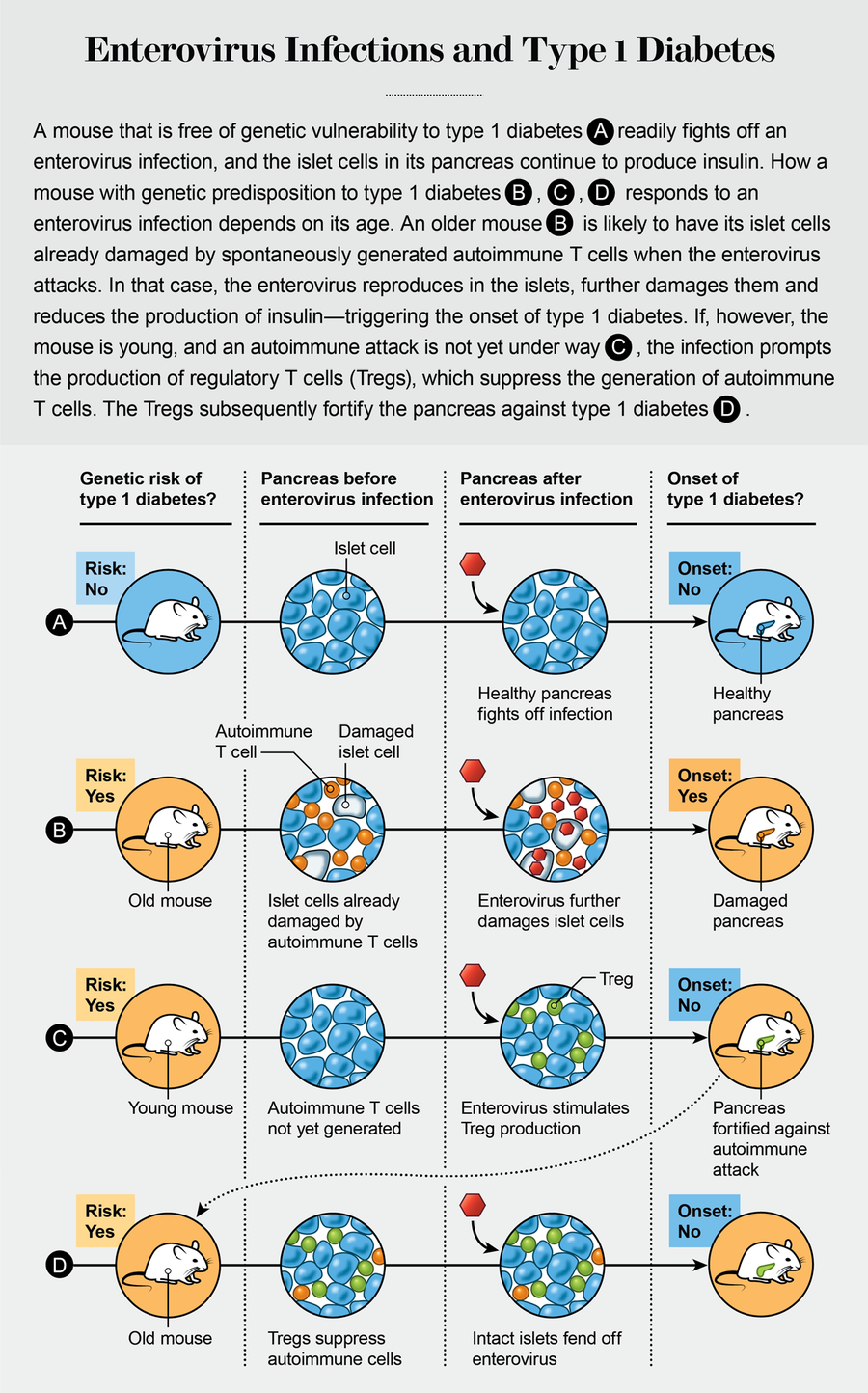
2002年,我們有意用柯薩奇B組病毒感染非常年輕的NOD小鼠,這些小鼠原本是在無菌環境中飼養的。我們發現,與未感染的對照組相比,這些動物隨著年齡增長而患上1型糖尿病的可能性要小得多。這些結果支援了早期接觸微生物對預防1型糖尿病具有保護作用的假設。有趣的是,這種影響並不侷限於特定型別的柯薩奇B組病毒,儘管某些病毒似乎比其他病毒提供更強的保護作用。芬蘭坦佩雷大學病毒學家海基·許奧蒂及其同事的實驗也產生了類似的結果。
我們可以考慮三種可能的機制,透過這些機制,幼年時接觸腸道病毒可以預防此類感染在以後的生活中造成的損害。首先,感染可能會觸發針對該特定型別腸道病毒的保護性抗體的產生,因此隨後接觸相同型別不會導致疾病。(這個過程反映了脊髓灰質炎病毒疫苗和我們今天使用的許多其他病毒疫苗背後的原理。)其次,由於柯薩奇B組病毒在分子水平上與其他腸道病毒非常相似,它們可能會促使身體更快地動員足夠的防禦力量,即使是針對它從未遇到過的腸道病毒。第三,腸道病毒感染可能會刺激稱為Tregs的調節性免疫細胞的產生。這些通常有益的細胞充當盡職盡責的警察部隊,抑制否則會傷害宿主的自身免疫性T細胞。
為了區分這些不同的機制,我們決定在不同年齡感染小鼠,並在接種後觀察至少30周。經過多年的實驗,我們發現用柯薩奇B組病毒感染年齡較大的NOD小鼠會增加而不是降低它們患上1型糖尿病的可能性。這一發現與我們在年輕NOD小鼠中觀察到的情況形成鮮明對比。
我們得出結論,胰腺必須已經發炎——這意味著產生胰島素的胰島細胞必須首先受到小鼠自身自身免疫性T細胞的攻擊——腸道病毒才能進入胰島並繁殖,從而加速糖尿病的發病。換句話說,在柯薩奇B組病毒感染可能加速1型糖尿病發病之前,必須先發生基因誘導的對胰腺的自身免疫攻擊。小鼠年齡越大,炎症越嚴重,疾病發作得就越快——通常會在一兩天內導致完全爆發的糖尿病。(相比之下,在無菌環境中飼養的年齡較大的小鼠在幾周後才患上糖尿病。)
加利福尼亞州拉霍亞免疫學研究所的免疫學家馬蒂亞斯·馮·赫拉斯及其同事的研究表明,生命早期(在自身免疫攻擊開始之前)的腸道病毒感染可以刺激調節性T細胞的產生,這些細胞會持續到成年期。Tregs抑制自身免疫性T細胞的產生,從而預防1型糖尿病。但是,如果胰腺已經因自身免疫性T細胞而發炎——就像在年齡較大的NOD小鼠中自然發生的那樣——病毒就能夠複製,損害產生胰島素的胰島細胞並引發糖尿病。換句話說,腸道病毒既可以預防也可以引發NOD小鼠的1型糖尿病,這取決於感染髮生的年齡。
糖尿病疫苗
假設在NOD小鼠身上的這些觀察結果反映了具有1型糖尿病遺傳易感性的人類的情況,我們如何利用它們來幫助這些脆弱的個體?沒有人希望回到衛生習慣不良或沒有衛生習慣的日子。但我們不應該必須這樣做。根據我們在脊髓灰質炎病毒疫苗方面的經驗,我們知道開發安全有效的腸道病毒疫苗是可行的。
一般來說,抗病毒疫苗有三種類型:活但減毒、滅活和亞單位疫苗。活的、減毒的疫苗最初是透過將病毒透過細胞或動物宿主來減弱其致病能力而產生的。這種疫苗被認為是誘導免疫力最有效的疫苗,因為病毒在宿主體內複製並誘導正常的免疫反應。但它們可能會迅速突變成致病性毒株。基因工程現在可以改變或刪除病毒基因組的特定區域,以限制這種逆轉的可能性,但風險仍然存在。滅活疫苗使病毒失活,使其無法繁殖,但它們仍然會在宿主體內誘導一定程度的免疫力。然而,由於病毒不會在體內持續存在,因此通常需要定期重新接種疫苗。亞單位疫苗使用一種或多種已知能刺激免疫反應的病毒部分,以在接種疫苗的人體內產生所需的免疫型別。2021年,針對SARS-CoV-2的mRNA疫苗被部署用於對抗COVID大流行,並顯示出優異的效果,在接種疫苗的人群中誘導了保護性免疫。鑑於這種成功,這項技術在不久的將來將很容易適應其他疫苗靶點,例如人類腸道病毒,以預防感染,以及可能預防1型糖尿病。
大量證據表明,沒有單一的腸道病毒,甚至少數幾種腸道病毒參與了全世界1型糖尿病的發生。此外,歷史證據表明,當接觸多種腸道病毒是生活常態時,1型糖尿病是罕見的。因此,我們假設接種多種型別的腸道病毒應該提供最大的保護。這種方法將模擬人類過去在整個歷史中積累對腸道病毒的保護性免疫的方式。最初的疫苗可以是滅活病毒疫苗,以安全地誘導免疫。此後,可以使用滅活或高度減毒的疫苗作為加強劑量。
我們感到鼓舞的是,針對1型糖尿病的疫苗方法終於正在進行中。許奧蒂的研究小組正在與芬蘭生物製藥公司Vactech Oy合作開發針對單一型別柯薩奇B組病毒的疫苗,許奧蒂是該公司的董事會主席,並且已經測試了該疫苗預防小鼠1型糖尿病的能力。這種滅活病毒疫苗在人體中的1期臨床試驗於2021年開始。在兒童身上進行測試——以確保安全性、產生對腸道病毒的保護性免疫反應以及預防1型糖尿病——將需要十年以上的時間。鑑於許多觀察表明沒有單一毒株的腸道病毒與1型糖尿病有關,我們只能保持希望,希望這種疫苗將顯著降低該疾病的發病率。
此外,許多非凡的努力正在進行中,以逆轉1型糖尿病的發病。波士頓兒童醫院的研究員保羅·菲奧里納及其同事已經證明,適當處理的幹細胞在注入小鼠體內時,有時可以逆轉1型糖尿病。另一個由馬薩諸塞州總醫院免疫生物學實驗室的丹尼斯·福斯特曼領導的研究小組正在調查卡介苗 (BCG) 疫苗(通常用於預防肺結核)在消除1型糖尿病影響方面的功效。美國和英國的幾個研究小組專注於使用胰島素原(胰島素的前體)或編碼胰島素原的DNA進行免疫。特別是,倫敦國王學院的馬克·皮克曼及其同事在2017年釋出的一份多研究員合作報告表明,來自胰島素原的蛋白質片段可以在新診斷出1型糖尿病的人群中誘導有益反應。
僅在美國,醫生每年就診斷出64,000例新的1型糖尿病病例。我們需要記住,疫苗不可能完全根除該疾病:一些病例似乎僅僅是因為患者的基因構成而發生的。改進治療方法以提高那些無法再自行產生胰島素的個體的生活質量仍然很重要。即使只有一小部分疫苗試驗參與者免受該疾病的侵害,也將有大量人群擁有更好的生活。鑑於1型糖尿病的發病率正在如此迅速地增加,使其像過去一樣罕見的能力可能會使數百萬人受益。
