
以下文章經線上出版物《 對話 》許可轉載,該出版物報道最新研究。
哇…外面真冷!孩子們湧向電視機,希望聽到會放雪假的訊息;雜貨店的麵包和牛奶貨架空了,因為一場即將到來的暴風雪;而公用事業卡車正在路上噴灑鹽或鹽水。
關於支援科學新聞
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道: 訂閱。透過購買訂閱,您正在幫助確保未來能夠繼續講述關於發現和塑造我們當今世界的想法的具有影響力的故事。
我們都知道為什麼前兩個會發生——孩子們為放假一天感到興奮,可以喝熱巧克力和堆雪人。成年人正在囤積必需品。但是那些卡車是怎麼回事?
它們正在透過噴灑岩鹽或鹽水溶液來防止結冰,從而保護駕駛員免受溼滑路面的影響。這種鹽與您餐桌上的鹽非常相似——都是氯化鈉 (NaCl)。有些專有混合物含有其他鹽類——例如氯化鉀 (KCl) 和氯化鎂 (MgCl)——但它們不常用。
道路鹽不像您在食物中使用的鹽那樣純淨;它呈棕灰色,主要是由於礦物質汙染。透過徑流使環境暴露於這種鹽可能會產生一些意想不到的後果,包括對植物、水生動物和溼地的負面影響。
但由於一個簡單的科學原理:溶液的凝固點降低,這是一種廉價有效的方法來保護道路免受冰凍。純水的凝固點,即它變成冰的溫度,是華氏 32 度。因此,如果下雪、雨夾雪或凍雨,並且地面溫度為華氏 32 度或更低,則街道和人行道上會形成固體冰。
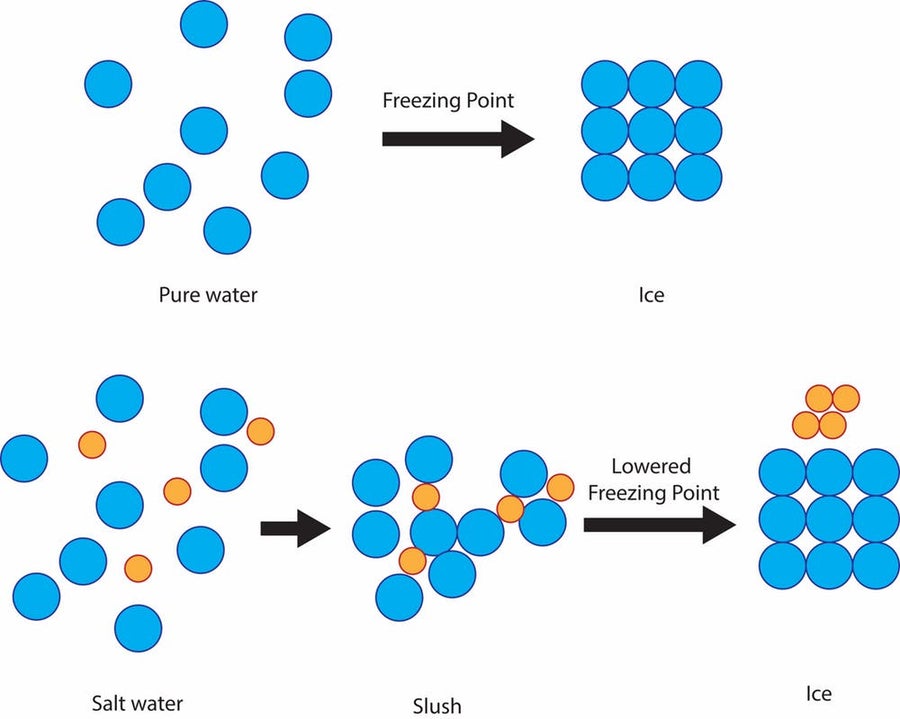
鹽可以防止水分子在華氏 32 度時凝固成冰晶,而是在該溫度下保持泥濘狀,然後最終在華氏 15 度左右結冰。鳴謝:Julie Pollock (CC BY-ND)
但是,如果水中混合了鹽,溶液的凝固溫度將低於華氏 32 度。鹽會阻礙水分子形成固體冰晶的能力。凝固點降低的程度取決於溶液的鹽度。
重要的是要注意,鹽必須在液態水中才能遵守這一原理。這就是為什麼許多城市在結冰之前噴灑鹽溶液的原因。
傾倒在冰上的鹽依賴於陽光或汽車輪胎駛過產生的摩擦力,以最初將冰融化成可以與鹽混合的泥漿,然後不會再次結冰。用固體鹽進行預處理依賴於較溫暖的路面來最初融化任何積雪或凍雨,以便它可以與鹽充分混合。這也是為什麼橋樑(比其他道路更冷)的預處理通常不起作用,以及為什麼您會看到“橋樑先於道路結冰”標誌的原因。
這些鹽溶液將水的凝固溫度降低到華氏 15 度左右。因此,對於那些面臨真正寒冷氣溫的人們來說,不幸的是,用鹽處理並不能消除道路上的冰。
在這些較低溫度下使用的另一種策略是在冰上撒沙子。沙子不會改變熔化溫度,它只是為您的輪胎提供粗糙的表面,以防止打滑和滑動。
凝固點降低的科學可以應用於任何溶液,許多研究小組都專注於開發對環境負面影響較小的替代品。它們包括糖蜜和甜菜汁等新增劑。因此,也許您可以期待在冬季散步後,不僅可以清理掉牛仔褲底部的白色鹽漬,還可以清理掉粉紅色的鹽漬。
