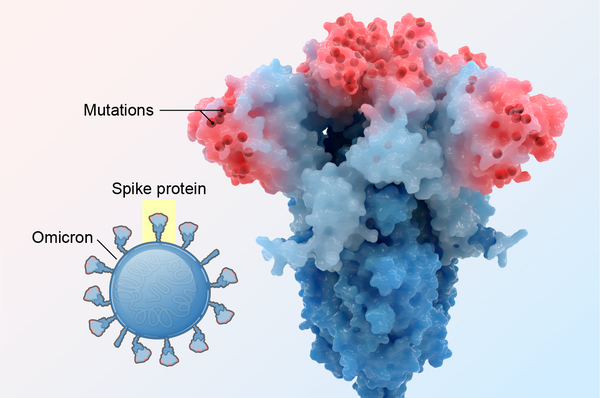
奧密克戎冠狀病毒變異株可能是人類歷史上傳播速度最快的病毒。一個人感染麻疹病毒——一種傳染性極強的微生物——可能在12天內感染另外15人。但是,當奧密克戎在去年冬天突然來襲時,它在人與人之間傳播得如此之快,以至於一個病例可能在四天後引起六個病例,八天後引起36個病例,12天后引起216個病例。到二月底,該變異株幾乎佔美國所有新增新冠感染病例。
早在2020年11月發現阿爾法變異株時,科學家們對其少數突變將如何影響其行為知之甚少。現在,憑藉一年的知識和資料積累,研究人員已經能夠將奧密克戎的約50個左右的突變與幫助其如此快速有效地傳播的機制聯絡起來。不列顛哥倫比亞大學的生物化學家斯里拉姆·蘇布拉馬尼亞姆說,這種調查過程通常需要更長的時間。“但是我們已經研究這些變異株一年了,所以我們已經做好了準備,”他補充道。
奧密克戎的突變數量是其他受關注變異株的兩倍,其BA.2亞譜系可能具有更多突變。奧密克戎的刺突蛋白上有13個突變,這些突變在其他變異株中很少見。這些對其構造的改變賦予了它新的、令人驚訝的能力。如果說德爾塔是蠻力十足的綠巨人變異株,那麼可以將奧密克戎視為閃電俠——戴著面具且速度極快。
支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們當今世界的發現和想法的具有影響力的故事的未來。
在這裡,我們探討該變異株發生物理變化的四種方式。其中三個改變幫助這種病毒逃避免疫系統並變得更具傳染性,而第四個改變可能導致其產生更輕微的疾病。
圖片來源:Veronica Falconieri Hays
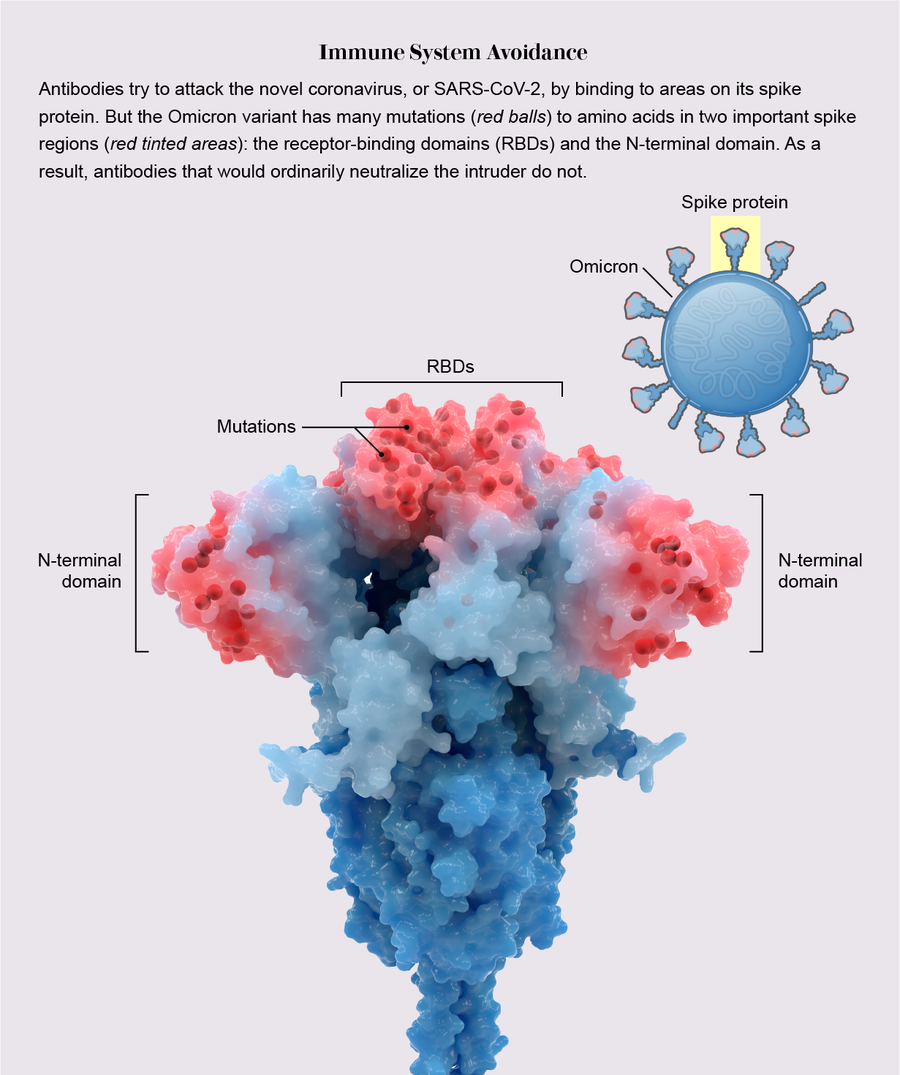
它戴上了偽裝。大多數證據表明,奧密克戎之所以具有如此強的傳播性,最主要的原因是一種強大的機制:在所有變異株中,奧密克戎具有無與倫比的躲避免疫系統的能力。
在感染期間,冠狀病毒刺突蛋白頂部的拳頭狀氨基酸團塊,稱為受體結合域(RBD),會抓住某些人類細胞外部的一種蛋白質:ACE2受體。為了防止這種不幸的結合,免疫系統會產生抗體——由先前感染或疫苗接種誘導產生的Y形蛋白質——這些抗體識別RBD並像尼龍搭扣一樣粘附在其上,從而阻礙病毒與ACE2連線。
在之前的變異株中,RBD上的一個、兩個或最多三個氨基酸發生了突變,僅足以改變每個RBD,從而阻止部分但不是全部抗體識別它。但是,奧密克戎攜帶了15個RBD突變,其中許多突變發生在主要的抗體結合位點上,形成了精巧的偽裝,以躲避更多的抗體。這就像病毒戴上了全面的《碟中諜》風格的乳膠面具來改變它的面孔。“突變實在太多了,而且新突變也很多,”華盛頓大學的生物化學家馬修·麥卡勒姆說。
圖片來源:Veronica Falconieri Hays
在《科學》雜誌上發表的一項分析中,麥卡勒姆與他的實驗室負責人大衛·維斯勒及其同事展示了這種劇烈轉化的後果:在醫院使用的八種新冠抗體療法中,只有一種——這些療法基於天然抗體——仍然能有效地與RBD結合。其他研究表明,RBD和一個名為N端結構域的第二個位點上的突變使病毒能夠躲避透過疫苗接種或感染獲得的抗體。由於奧密克戎令人信服的偽裝,該變異株幾乎沒有受到阻礙,並以閃電般的速度傳播。然而,疫苗仍然可以抵禦重症,特別是加強針。
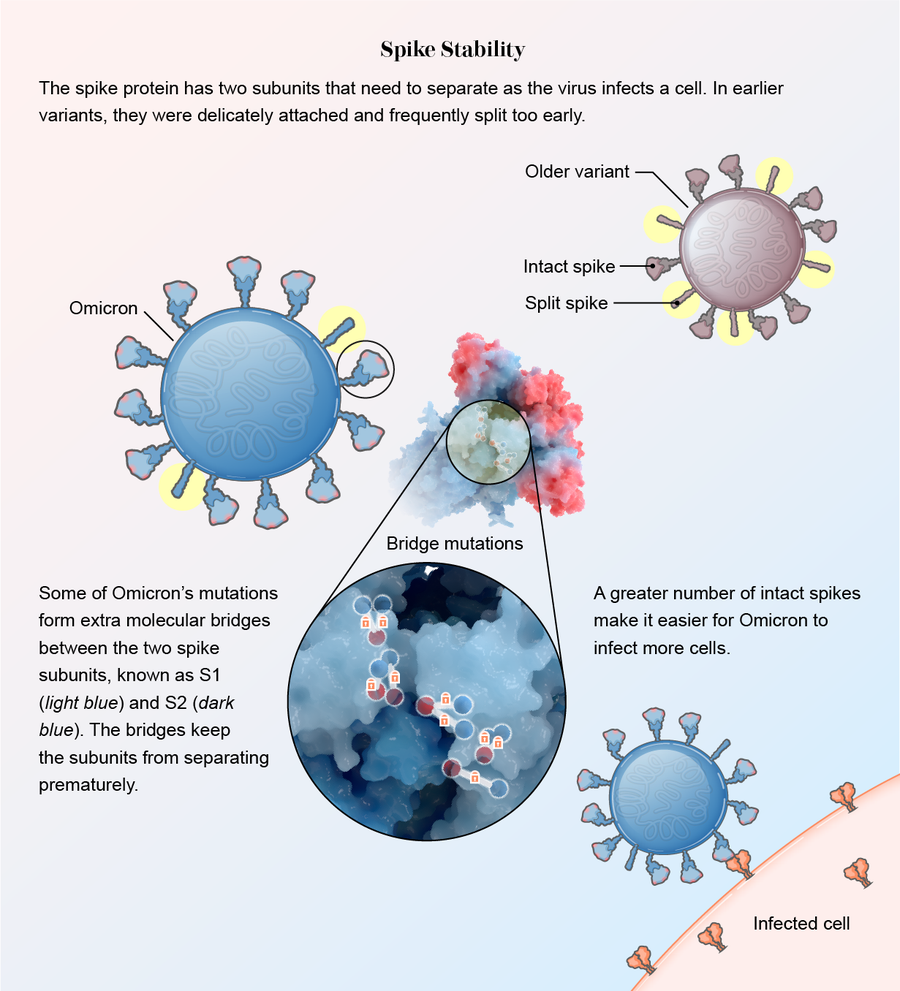
它變得更穩定了。當奧密克戎劇烈改變其刺突蛋白以躲避免疫系統時,這些改變消除了一些刺突蛋白連線ACE2所需的化學殘基。但其他突變彌補了這一點:根據《科學》雜誌的另一項研究,RBD形成了新的化學橋樑,仍然可以有效地與該蛋白質結合。“它顯然失去了一些對結合重要的殘基,但它透過其他相互作用彌補了這些殘基,”該論文的資深作者蘇布拉馬尼亞姆說。
刺突蛋白也變得更堅固。在其他變異株中,刺突蛋白內的兩個亞基S1和S2連線鬆散。這使得它們可以快速分離,以便當病毒遇到人類細胞時,刺突蛋白可以埋入其中。然而,這種脆弱安排的缺點是,許多刺突蛋白過早分離,在接近細胞之前就已分離。一旦分離,刺突蛋白就無法再幫助病毒附著。
圖片來源:Veronica Falconieri Hays
根據幾項研究,奧密克戎的突變導致細小的分子橋樑更好地將亞基連線在一起。其中一項研究發表在《醫學病毒學雜誌》上,其他研究以預印本論文的形式釋出,尚未經過其他科學家的正式審查。“這種病毒確實保護了自己免於過早觸發,”其中一篇論文的作者、俄亥俄州立大學病毒和新興病原體專案主任劉善綠說。“當病毒在正確的時間出現在正確的位置時,它可以被觸發並進入細胞,但在此之前不會。”
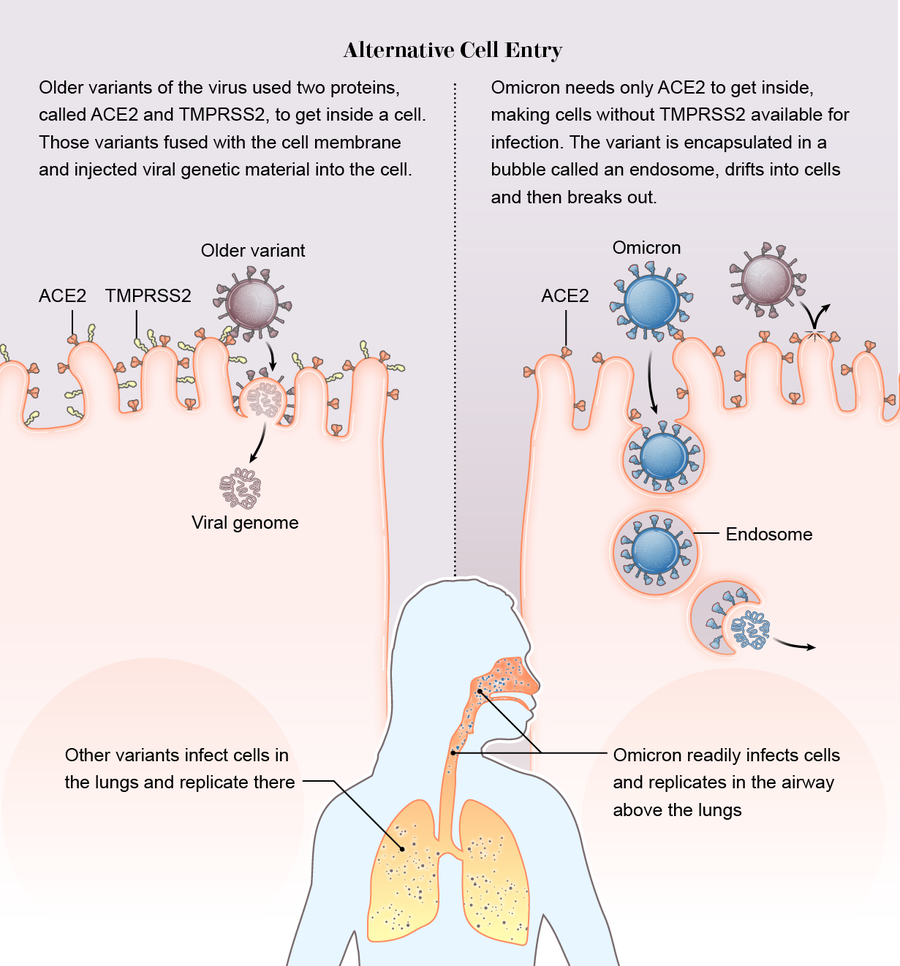
它從側門溜了進去。在之前的變異株中,有一個不變的因素:病毒依賴於人類細胞表面上的一種名為TMPRSS2(發音為“tempress two”)的蛋白質來幫助其突破細胞膜。但是奧密克戎沒有使用TMPRSS2。它採取了完全不同的途徑進入細胞。它沒有破壞前門,而是從側門溜了進去。
其他變異株需要ACE2和TMPRSS2蛋白質才能將它們的基因組注入細胞,而奧密克戎僅與ACE2結合。然後它被包裹在一個稱為內吞體的空心氣泡中。氣泡漂移到細胞內,病毒在那裡突破並開始接管。
科學家們推測,奧密克戎透過這種方式獲得了兩個可能的優勢。首先,許多細胞的外部沒有TMPRSS2,因此如果病毒不需要表面蛋白質,它就有更廣泛的細胞可供感染。“目前的假設是,如果病毒透過內吞體進入並且不依賴TMPRSS2,那麼病毒可利用的細胞可能會多出七倍甚至十倍,”倫敦帝國學院的病毒學家溫迪·巴克利說,她的團隊和其他團隊一起檢測到新的進入途徑,他們在預印本中對此進行了描述。
其次,雖然德爾塔變異株經常深入感染富含TMPRSS2的肺細胞,但奧密克戎在肺部上方的氣道中快速複製,這可能有助於它在人與人之間傳播。“我們可能看到了一種向呼吸道上部的轉變,這促進了病毒透過咳嗽、打噴嚏等方式傳播,”格拉斯哥大學的病毒學家喬·格羅夫說,他也是一篇預印本的合著者,該預印本也檢測到了進入途徑的變化。
它降低了防禦能力。與前三個變化不同,奧密克戎的最後一個,第四個變化並沒有幫助該變異株更具傳染性。相反,這種改變產生了一個令人驚訝的弱點,使該變異株更容易受到我們身體防禦系統的一部分的攻擊,即先天免疫系統。
科學家們檢查了奧密克戎和德爾塔對干擾素的反應,干擾素是一種小蛋白質,其作用類似於高速公路照明彈,提醒先天免疫細胞注意入侵者。德爾塔擅長抑制干擾素反應,但奧密克戎卻很糟糕。它實際上激活了干擾素訊號傳導。
研究人員尚不清楚這種變化是如何發生的。冠狀病毒的26種蛋白質中至少有11種與干擾素系統相互作用,其中許多在奧密克戎中發生了突變。但是,即使不知道確切的機制,科學家們也可以看到這種變化後果的跡象。
由於肺部的干擾素反應比上呼吸道更明顯,奧密克戎對該反應的脆弱性可能阻止了它擴散到更深層的器官。“這在生物學上符合我們所看到的,”英國肯特大學的生物學家馬丁·邁克爾斯說,他在一篇發表在《細胞研究》雜誌上的論文中分析了奧密克戎如何與干擾素相互作用。“奧密克戎似乎不太能夠進一步進入身體和肺部,從而引起重症。”
雖然奧密克戎對我們整個人群的影響並不輕微——它導致住院和死亡人數激增,以及創紀錄的兒童住院人數——但該變異株似乎確實在一些感染者以及動物模型中引起了較輕的疾病。然而,未接種疫苗或有其他風險因素的人仍然面臨著重病和死亡的高度風險。
未來的變異株,如果出現的話,可能會對其結構和能力進行其他修改。“我不相信我們可以高枕無憂,並說一切都結束了,”巴克利說。隨著感染在世界各地的許多人群中持續傳播和演變,病毒將想出更多傳播方式——包括科學家們甚至沒有想到的方式。