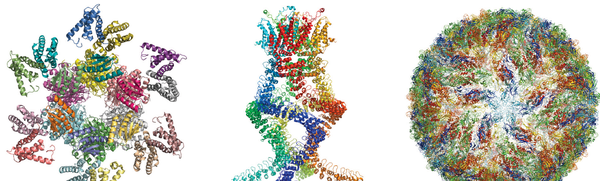
今天中午之前,斯德哥爾摩時間,三位真正的遠見卓識者獲得了科學界的金獎:2017年諾貝爾化學獎。這些研究人員開發了在原子水平上成像複雜蛋白質的方法,採用電子顯微鏡來觀察分子如何產生抗生素耐藥性,如何將光轉化為光合作用的能量以及寨卡病毒如何運作。“為了開發用於生物分子溶液高解析度結構測定的低溫電子顯微鏡”,瑞典皇家科學院將化學獎授予了瑞士洛桑大學的雅克·杜波謝、紐約市哥倫比亞大學的約阿希姆·弗蘭克和英國劍橋MRC分子生物學實驗室的理查德·亨德森。
“這項發現就像分子的谷歌地球,因為它將我們帶到蛋白質內原子的精細細節,”美國化學學會主席、在生物材料領域進行過研究的化學家艾莉森·坎貝爾說。雖然諾貝爾委員會強調了生物和醫學應用,但坎貝爾表示,該方法可以用於分析任何型別的聚合物,例如分解塑膠的工業酶。
弗蘭克在諾貝爾獎宣佈期間的電話中指出,實際應用尚未到來。“這並不是立即的床邊應用。還需要幾年時間,”他說。坎貝爾也同意。“這是一種前端技術,”她說。“但潛力是巨大的。你可以瞭解你正在研究的任何目標分子。你可以看到它的形狀,當蛋白質改變形狀時,它們的功能也會改變。”
關於支援科學新聞
如果您喜歡這篇文章,請考慮透過 訂閱來支援我們屢獲殊榮的新聞報道。透過購買訂閱,您正在幫助確保關於當今塑造我們世界的發現和想法的具有影響力的故事的未來。
這是過去四年中第二個授予顯微鏡學的化學諾貝爾獎。2014年,斯特凡·赫爾、埃裡克·貝齊格和威廉·莫爾納因提高光學顯微鏡的功率而獲獎,使科學家能夠在活細胞內觀察分子的活動,儘管不是在原子變化水平上。
長期以來,X射線晶體學一直是化學家和生物學家尋求瞭解蛋白質結構的首選方法。據《自然》雜誌上的一篇新聞文章稱,它幫助科學家獲得了十多個諾貝爾獎,其中包括1962年揭示DNA雙螺旋結構的獎項,到2015年,X射線已被用於確定流行的蛋白質資料庫中大約100,000個分子中約90%的結構。
但是該技術不能做到一切。顧名思義,晶體學要求其目標被製成晶體。對於在細胞內外發現的許多大型複雜分子——例如將遺傳指令轉化為工作蛋白質的核糖體——科學家根本無法做到這一點。
然而,電子可以從蛋白質中的每個原子上反彈,並揭示其結構。該結構是三維的,從1970年代開始,弗蘭克開發了一種數學影像處理方法,允許計算機將幾個二維電子顯微鏡影像合併成清晰的3-D影像。杜波謝的貢獻是展示瞭如何將這種顯微鏡用於生物分子。蛋白質等分子周圍被水包圍,這有助於它們維持結構,但電子顯微鏡會使水乾燥。杜波謝找到了一種快速冷卻水的方法,使其變得像玻璃一樣——這種形式稱為玻璃化水——並使其中的分子保持其形狀。
然後在1990年,經過15年完善樣品製備和電子檢測的工作,亨德森成功地使用電子顯微鏡建立了名為細菌視紫紅質的大型細菌細胞膜蛋白的影像,並在原子解析度下做到了這一點。亨德森和奈傑爾·安溫在《大眾科學》1984年2月刊中撰文,介紹了他們兩人如何率先使用電子顯微鏡來觀察細胞膜蛋白的細節。
現在,對於任何“對蛋白質的結構和功能感興趣”的科學家來說,“我很想在我的實驗室裡擁有一個這樣的儀器,”坎貝爾說。杜波謝、弗蘭克和亨德森將在12月在斯德哥爾摩舉行的年度諾貝爾獎頒獎典禮上獲得他們的獎章,並分別獲得900萬瑞典克朗(約合110萬美元)獎金的三分之一。