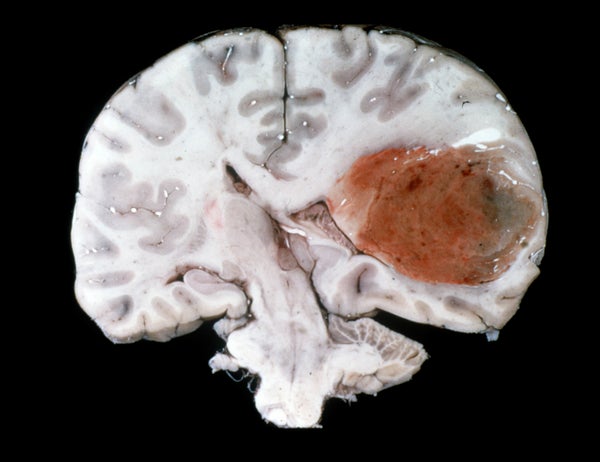
最常見的惡性腦癌形式——稱為膠質母細胞瘤——以其狡猾而臭名昭著,被認為是人類最致命的癌症。膠質母細胞瘤瀰漫且不規則地侵入正常腦組織,使其成為外科手術的噩夢。而且它們的突變速度如此之快,以至於目前大多數可用的癌症療法都無法跟上它們的速度。即使是相鄰的腫瘤細胞也可能在基因上有所不同,因此很難用單一療法靶向治療。
20世紀80年代,當放射療法成為標準治療方案的一部分時,膠質母細胞瘤的生存率略有提高。患者的預期壽命從僅四到六個月延長到近一年。2000年代推出的化療藥物替莫唑胺使生存期又延長了幾個月。但從那時起,患者的生存率就停滯不前了。
近年來,膠質母細胞瘤奪去了參議員特德·肯尼迪、約翰·麥凱恩和喬·拜登之子博·拜登的生命。即使能夠獲得據推測是我們國家最好的癌症護理,也無法挽救這些備受矚目的政治人物。迫切需要治療這種大腦禍害的新方法。許多專家堅持認為,戰勝膠質母細胞瘤的關鍵在於根據患者的個體腫瘤和癌症的特定分子特徵來個性化治療。
關於支援科學新聞業
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞業 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們當今世界的發現和想法的具有影響力的故事的未來。
測試癌症療法(包括膠質母細胞瘤)的一種方法是所謂的“離體”癌症模型,其中在實驗室中探測惡性細胞。它們也被稱為腫瘤“化身”,使研究人員能夠在將藥物引入患者體內之前,先在患者的癌細胞上測試藥物。多年來,人們嘗試了許多離體模型:在培養皿中培養腫瘤細胞;將它們移植到動物模型中;甚至培養“類器官”(在支撐基質上生長的三維腫瘤)。這些技術根據手頭的腫瘤型別取得了不同程度的成功,但沒有一種被證明對膠質母細胞瘤特別有幫助。
最近發表在Nature Biomedical Engineering雜誌上的一份關於新技術研究的報告可能會解決以前離體方法的侷限性。簡而言之,研究人員已經配製出了一種晶片上的膠質母細胞瘤。在過去幾年中,各種器官和疾病(包括許多癌症)的晶片模型已經問世。它們的構建方法是在塑膠微晶片上排列活體人體細胞,以模擬特定的器官或疾病,從而簡化、降低成本並提高藥物測試的效率。哈佛大學韋斯研究所和其他研究小組在開發許多基於晶片的生物模型方面取得了令人矚目的進展。肺、腸道、皮膚、骨髓ALS——甚至血腦屏障的晶片模型都已得到測試。
韓國研究人員關於晶片的新報告可能代表了迄今為止最先進的膠質母細胞瘤離體模型。作者使用生物列印技術將來自人類患者的腦腫瘤細胞放在晶片上,並在腫瘤周圍環形列印血管樣細胞,模擬膠質母細胞瘤所需的生命氧氣供應。在遠離空氣供應的地方,人類膠質母細胞瘤中心的細胞往往會死亡並形成壞死核。最後,研究人員還在他們的模型中加入了“細胞外基質”,即支援動物細胞(包括腫瘤)的三維結締組織、酶和其他蛋白質網路。人們認為這種基質在癌症在體內的行為方式中起著至關重要的作用。
新模型成功地模擬了從腫瘤樣本中提取的患者的治療反應。來自對標準膠質母細胞瘤治療方案(放射療法聯合替莫唑胺)高度耐藥的患者的晶片腫瘤對治療沒有反應。反過來,從耐藥性較低的患者身上列印的腫瘤被發現對治療更敏感。
“據我所知,我們是首次生物列印了晶片上的癌症,”韓國浦項科技大學機械工程系教授、新報告的資深作者曹東佑說。“此外,我們的研究是首次嘗試使用個性化的晶片上的癌症來實際重現患者的治療反應。”曹認為,他們的晶片模型最終可以透過指導適當的治療選擇來幫助延長膠質母細胞瘤患者的生存期。“我相信,當我們測試來自患者的癌細胞,這些細胞是在模擬真實癌症生物學的平臺上培養的,那一天很快就會到來,”他說。
鳳凰城巴羅神經病學研究所的腦癌神經外科專家納德·薩奈支援離體建模研究。然而,他認為,儘管像韓國小組這樣的研究取得了進展,但這些方法仍然存在重大侷限性。“所有這些模型的挑戰在於,它們無法完全重現患者大腦中發生的情況,”薩奈解釋說。“部分原因是您只從腫瘤的一小部分中提取細胞;但膠質母細胞瘤並非同質的。”
他說,膠質母細胞瘤最具挑戰性的特徵之一就是它們的異質性:“這些真的是不同的細胞集合,許多細胞使用不同的生物途徑。這就是為什麼大多數藥物不起作用,以及為什麼這麼多模型不能代表腫瘤的完整生物學特徵。”
薩奈領導著巴羅常春藤腦腫瘤中心,該中心是與常春藤基金會合作成立的,致力於有朝一日治癒腦癌(巴羅治療的腦腫瘤患者比美國任何其他機構都多)。作為主任,他負責監督該中心的“0期”臨床試驗專案。0期試驗是更好地為每位特定患者定製藥物治療的方法。
在此類試驗中,對給定患者之前的腫瘤手術樣本進行基因分析,以幫助確定嘗試哪種實驗性藥物組合最有意義。他們試驗的許多藥物已經在針對其他癌症型別進行測試,因此它們通常具有一定程度的已證實的安全性記錄。
接下來,在患者接受隨訪手術以切除新生的腫瘤之前,薩奈和他的團隊會給患者使用他們選擇的化療藥物組合。目的是解決兩個問題:他們的藥物方案是否真的能到達腫瘤,以及它是否正在攻擊其預期的分子靶點?
薩奈感嘆,雖然其他癌症型別的離體模型可以相當忠實地代表它們的人類對應物,但對於膠質母細胞瘤來說,情況並非如此。血腦屏障在器官周圍形成了一個相當堅不可摧的堡壘,因此讓藥物透過它仍然是一個挑戰。瞭解藥物是否甚至到達大腦——以及它是否正在努力根除腫瘤細胞,這是0期試驗的目標——可能對治療選擇大有裨益。
在患者手術後,薩奈和他的團隊會花大約一週時間分析切除的腫瘤,同時患者也在康復。在那時,他們通常可以很好地瞭解他們的藥物方案是否有可能成為一個好的候選方案。如果是這樣,患者就會接受治療。“如果不是,我們可能會將他們轉移到另一種療法;轉移到另一項試驗,”他說。
自2018年5月開業以來,常春藤小組已招募了近150名患者。入組速度約為每月增加10名患者。“我們成功了嗎?”他問道。“這取決於你如何定義成功。我們沒有治癒任何人。但我們已經確定了很多藥物和藥物組合,這些藥物和藥物組合似乎逐漸改善了我們患者的預後。這是一個迭代過程。”
薩奈承認,即使患者從0期試驗中獲益,腫瘤很可能也會發生突變並復發。“他們會回到手術室,”他說,“我們會問自己,‘好吧,這個腫瘤發生了什麼變化?為什麼它停止反應了?’”他說,這讓團隊瞭解了下一個藥物組合應該是什麼。
治療膠質母細胞瘤似乎是一項西西弗斯式的任務。即使是胰腺癌,被廣泛認為是第二大最糟糕的癌症診斷,也有一些一致的基因缺陷,表明患者之間可能存在共同的療法。雖然人們認為膠質母細胞瘤並非如此,但令人鼓舞的研究仍在不斷湧現。
上週發表在Cancer Cell上的一項研究報告了似乎驅動膠質母細胞瘤早期發展的三個特定基因改變。德國癌症研究中心的 researchers 測試了來自 50 名患者的膠質母細胞瘤樣本,包括他們的初始腫瘤以及任何復發腫瘤。透過分析腫瘤基因組,他們能夠追溯這些腫瘤是如何突變和進化的。他們發現,平均而言,膠質母細胞瘤在診斷前已經發展了長達七年,考慮到這些癌症被認為的快速增殖速度,這是一個令人驚訝的發現。
研究人員發現,所有測試的膠質母細胞瘤在早期發育中都至少有一種特定的基因改變。這些改變要麼是 7 號或 10 號染色體的完全或部分獲得,要麼是 9 號染色體的一部分缺失。
這些基因改變似乎只在膠質母細胞瘤發育早期驅動腫瘤生長。相比之下,複發性腫瘤似乎沒有它們之間共有的特定突變。這表明目前的膠質母細胞瘤治療方法並沒有產生選擇壓力並驅動耐藥性複發性腫瘤的形成。這些結果的含義是,如此多的研究性藥物在膠質母細胞瘤中失敗,是因為它們沒有有效地攻擊腫瘤,而不是癌症透過突變跑贏了潛在有效的治療方法的替代方案。
作者認為,他們的工作表明我們迫切需要針對膠質母細胞瘤的新療法。薩奈就他而言,認為未來膠質母細胞瘤的整個概念可能會演變。“現在,我們傾向於將膠質母細胞瘤視為一種單一疾病,”他說。“然而,我們已經將其劃分為具有獨特生物學特徵的亞群。”他認為,不僅有少數幾種膠質母細胞瘤亞型,而且可能有數百種,甚至更多。
“我認為 10 年後,膠質母細胞瘤這個術語將有點過時,”他預見道。“我認為我們需要深入研究特定變體的各種生物標誌物和基因變化。我們需要定製治療。這就是我們將取得最大進展的方式。”