本文是“鐮狀細胞病創新”專題報道的一部分,該報道由編輯獨立完成,並獲得了Vertex Pharmaceuticals的資助。
鐮狀細胞病似乎很簡單:它是由單個基因中的單個突變引起的。但它對患者的影響卻非常複雜——如此複雜,以至於在該突變被發現 70 年後,治療仍然困難。在擁有健康紅細胞的人體內,血紅蛋白蛋白質在細胞在全身迴圈時攜帶氧氣。在鐮狀細胞病患者中,當突變的血紅蛋白蛋白質聚整合纖維時,就會形成同名的鐮狀細胞,使紅細胞通常的碟形形狀變形為彎曲的鐮刀狀,從而阻止它們有效地向組織輸送氧氣。這些鐮狀細胞可能會卡在血管內,中斷血液流動,並經常引發劇烈疼痛和危象,嚴重時會導致患者住院,並使其面臨心力衰竭和其他危及生命的風險。從長遠來看,血液流動中斷、氧化應激和炎症共同導致中風以及對血管和其他器官的永久性損害。
該疾病的侵襲方式如此之多,研究人員正從多個角度著手解決這個問題:從源頭上阻止骨髓首先產生突變的紅細胞;在細胞水平上,透過改變畸形紅細胞的代謝和蛋白質結構;以及在免疫水平上,預防長期器官損傷。“問題是[它]們都是相互關聯的,”杜克大學血液學家瑪麗蓮·特倫說。“那麼你在哪裡築壩呢?”
支援科學新聞業
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。 透過購買訂閱,您將幫助確保有關當今塑造我們世界的發現和想法的具有影響力的故事的未來。
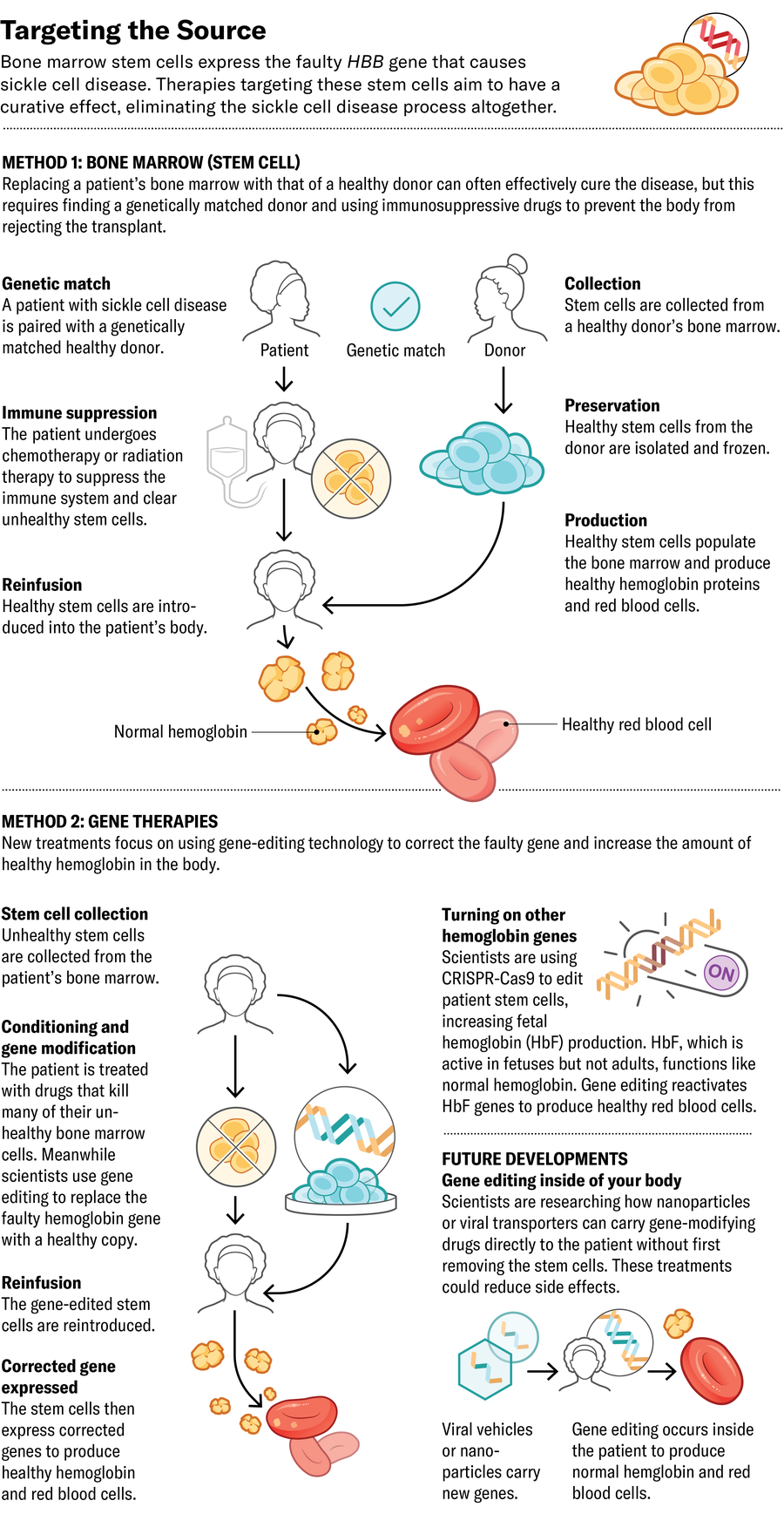
理想的阻止疾病的地方是在其源頭:如果骨髓幹細胞正在生成有缺陷的紅細胞,則用產生健康細胞的幹細胞替換它們。這種方法最成熟的方法是來自匹配供體的骨髓移植。該手術需要使用強力化療預先消除患者的原始骨髓細胞,以便為引入的細胞生長創造一個空間。這種治療可能導致不孕,並且需要長期服用免疫抑制藥物——通常持續數年——以防止身體排斥移植。

Now Medical Studios;來源:美國血液學協會首席科學官凱莉·羅斯(顧問)
為了改進骨髓移植的成功率,一些公司創造了基因編輯方法,消除了對免疫抑制藥物的需求。他們取出患者的幹細胞,在實驗室中修改細胞的 DNA 以促進健康血紅蛋白的產生,然後將它們重新引入患者體內。許多此類基因修飾方法已經進入臨床試驗或已獲得美國食品和藥物管理局的批准。
嬰兒出生時產生的血紅蛋白形式,稱為胎兒血紅蛋白 (HbF),不受鐮狀突變的影響。通常,HbF 在出生後幾個月內大部分會被成人版本的血紅蛋白取代,這促使幾家公司專注於增加血液中 HbF 的含量。2023 年,FDA 批准了 Vertex Pharmaceuticals 的 exa-cel,該藥物使用 CRISPR-Cas9 基因編輯技術來停用阻止 HbF 產生的基因。結果是更高的胎兒血紅蛋白與成人血紅蛋白的比率。
Editas Medicine 也在增強 HbF 的產生,使用另一種稱為 Cas12a 的 CRISPR 相關酶進行編輯。Cas9 透過在雙螺旋的同一位置斷開兩條鏈來編輯 DNA,而 Cas12a 在不同位置斷開它們,併產生更一致的編輯。Beam Therapeutics 正在尋求類似的方法,使用另一種形式的 CRISPR 來交換遺傳密碼中的單個核苷酸,從而增強 HbF 的產生。這兩種療法都仍在臨床試驗中。
Now Medical Studios;來源:美國血液學協會首席科學官凱莉·羅斯(顧問)
另一種不同的策略是插入更具彈性的成人血紅蛋白編碼基因版本,而不是增加 HbF。Bluebird bio 的 lovo-cel 也於去年獲得 FDA 批准,它使用更經典的基因治療方法。它不是編輯患者的 DNA,而是使用一種改良的病毒將健康、增強的成人血紅蛋白基因副本傳遞到骨髓幹細胞中,在那裡它整合到患者的 DNA 中。
費城兒童醫院的兒科血液學家 Alexis Thompson 說,這些新技術“與我們幾乎無法為家庭提供幫助的多年和幾十年相比,是一種進步。”
未來的一種方法可能讓醫生在不從體內取出骨髓的情況下編輯患者的骨髓。在去年發表在《科學》雜誌上的一項研究中,研究人員描述了將信使 RNA (mRNA) 攜帶到骨髓幹細胞中的奈米粒子的開發。當他們在鐮狀細胞病患者的細胞中使用這些粒子時,mRNA 編碼的編輯系統成功地修改了這些細胞基因組中的血紅蛋白基因,以產生更多健康的血紅蛋白蛋白質。
特倫說,這種體內技術可能需要 10 到 20 年才能準備好進行大規模人體試驗。“我們知道我們需要的技術。我們知道很多部件。我們只是還沒有能夠讓它們協同工作。”
與此同時,當前的基因療法仍然昂貴且難以擴大規模,因為每個患者的細胞批次都必須單獨編輯。這些療法對於大多數患有該疾病的人來說遙不可及,尤其是在撒哈拉以南非洲地區,那裡發生了 75% 的鐮狀細胞病例。
Now Medical Studios;來源:美國血液學協會首席科學官凱莉·羅斯(顧問)
所有這一切都意味著,對於大多數人來說,最容易獲得的根治性治療方法是來自具有特定、基因匹配的細胞標記的供體的骨髓移植。(這種匹配通常但不總是能在近親家庭成員中找到。)現在,一種最初為治療血癌而開發的技術可以透過擴大供體庫使更多移植成為可能。一種包括短暫療程的兩種化療藥物——噻替哌和環磷醯胺——的策略足以抑制骨髓接受者的免疫系統,使其能夠接受幾乎任何與其共享一半 DNA 的供體的移植,例如沒有鐮狀細胞病的父母、表親或兄弟姐妹。
在一項針對 54 人的試驗中,研究人員發現,大約 90% 的接受來自半匹配供體移植的鐮狀細胞病患者在至少兩年內沒有出現排斥反應。範德比爾特大學血液學家阿德托拉·卡西姆領導了這項研究,他說,一些患者似乎完全治癒了。與基因療法不同,這種“單倍體相合移植”僅需要短暫且毒性遠低於基因療法的化療療程。卡西姆說,這種方法可能是一種更經濟實惠的選擇:“我們使用的技術是可出口和可擴充套件的。”
當骨髓移植遙不可及時,針對下游生理問題的治療方法可以解決,例如血紅蛋白聚集,並緩解症狀。“可以認為,世界上絕大多數鐮狀細胞病患者不太可能獲得根治性治療,”特倫說。“因此,我們有必要將其他藥物推向市場,以改善他們的生活。”
FDA 近年來批准了三種鐮狀細胞藥物,還有數十種藥物正在研發中。第一種新藥於 2017 年獲得批准,是 Emmaus Medicine 的 l-谷氨醯胺,一種有助於維持紅細胞圓形形狀的抗氧化劑。在一項臨床試驗中,食用混入食物或飲料中的 l-谷氨醯胺粉末的患者,其疼痛危象比安慰劑組的患者減少了 25%。
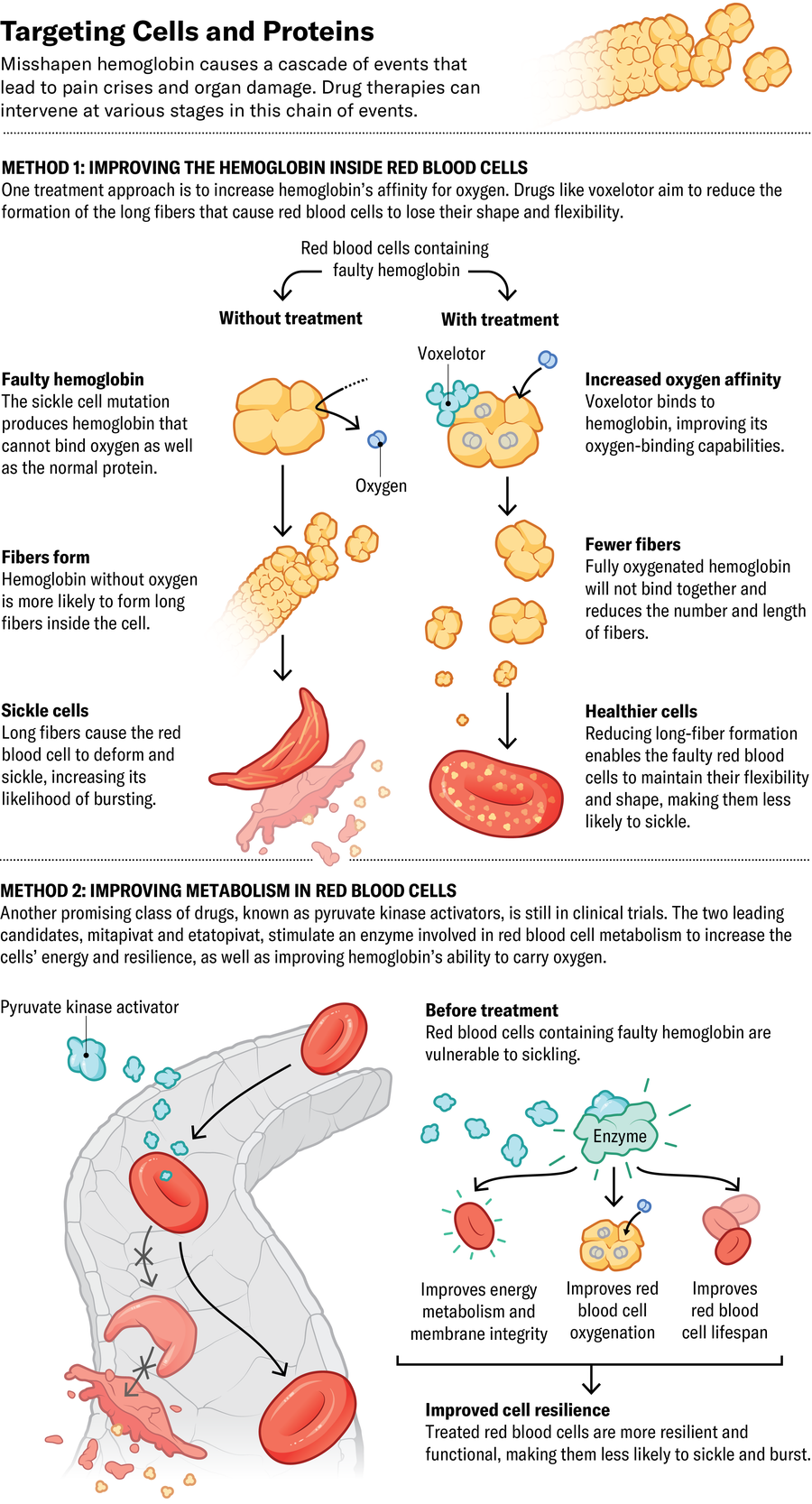
輝瑞公司的 voxelotor 和 osivelotor(後者正在臨床試驗中)都直接與血紅蛋白結合,並提高其與氧氣結合的能力。這種作用還可以防止蛋白質聚集並導致紅細胞失去形狀。FDA 和歐盟委員會分別於 2019 年和 2022 年批准了 voxelotor,此前資料顯示它可以提高血紅蛋白水平並防止嚴重貧血。“當它起作用時,它令人驚歎。它有點像奇蹟藥物,”紐約市西奈山伊坎醫學院專門研究鐮狀細胞的急診醫生傑弗裡·格拉斯伯格說。但有些患者沒有反應,一項 3 期臨床試驗表明它並沒有減少疼痛危象的次數。
Now Medical Studios;來源:美國血液學協會首席科學官凱莉·羅斯(顧問)
另一類有前景的藥物,稱為丙酮酸激酶啟用劑,可刺激細胞代謝中涉及的一種酶,以增加細胞能量並提高血紅蛋白攜帶氧氣的能力。兩個主要的候選藥物,Agios Pharmaceuticals 的 mitapivat 和 Novo Nordisk 的 etavopivat,正在進行臨床試驗。
對於幫助正處於發病痛苦中的人,醫生仍然幾乎沒有選擇。通常,唯一可用的選擇是止痛藥和靜脈輸液。但針對紅細胞以外物質的新藥可能有助於應對急性危象,並減少長期導致疼痛和器官損傷的免疫反應。
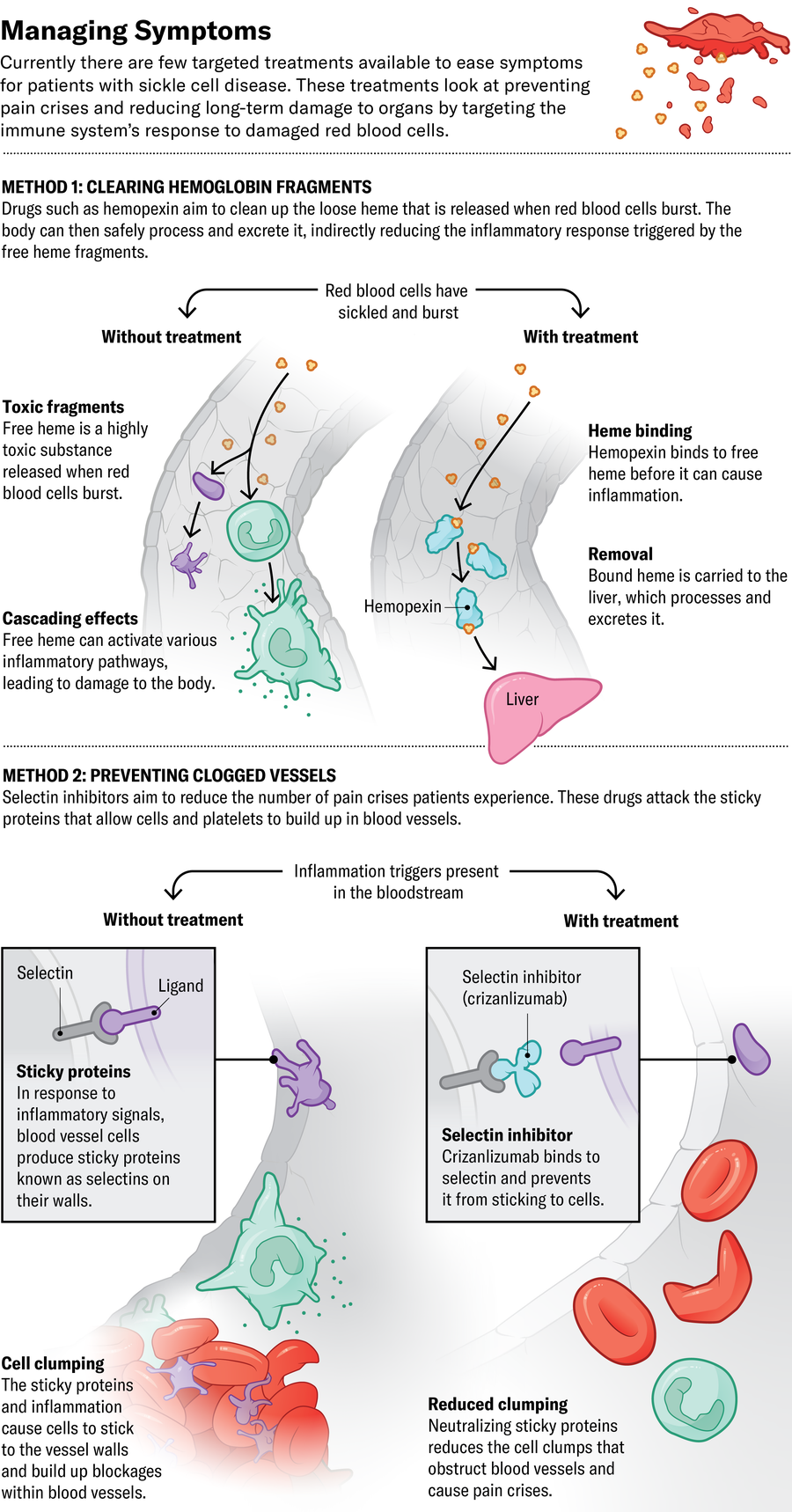
FDA 最近批准的第三種藥物,諾華公司的 crizanlizumab,攻擊血管和血小板細胞上稱為選擇素的粘性蛋白質。阻斷這些蛋白質可以防止紅細胞在血管內聚集在一起,據推測可以預防疼痛危象。但它可能並沒有那麼簡單。歐洲藥品管理局在審查委員會發現它似乎沒有減少人們經歷的危象次數後,於 2023 年撤銷了對 crizanlizumab 的批准。格拉斯伯格認為該藥物仍然有用——他未發表的研究表明,crizanlizumab 和目前正在臨床試驗中的類似藥物可以減少長期器官損傷和慢性腎臟病。
其他方法旨在減少免疫系統活動。CSL Behring 正在進行 hemopexin 的臨床試驗,這是一種清除已從紅細胞中釋放出來的血紅蛋白的藥物。遊離血紅蛋白會導致細胞在血管中聚集並導致炎症,從而導致長期器官損傷。其他地方的研究人員正在調查抑制某些稱為補體蛋白的免疫訊號分子的活性是否可以預防同樣的基於炎症的損傷。
現在,格拉斯伯格和其他人正在努力確定哪些藥物效果最好,以及某些組合是否可以協同作用。他目前正在西奈山進行一項名為 REAL Answers 的試驗,其中 1,200 名患者將單獨或組合接受 FDA 新批准的藥物以及一種名為羥基脲的舊藥。格拉斯伯格的團隊正在評估它們對疼痛危象的影響,監測器官損傷的跡象,並尋找可以預測某人反應良好的遺傳標記。
現在判斷這些新療法中的大多數將如何適應患者護理還為時過早。它們在生命早期開始時可能最有效。這些藥物尚未在兒童的安全性和有效性方面進行廣泛測試,但這種方法可能預防可能早期開始然後隨著時間推移而惡化的器官損傷。
