基因編輯方法CRISPR已經改變了生物學,使科學家能夠透過糾正危險突變來修飾基因以治療或預防遺傳疾病,並創造大量新的轉基因植物和動物。但是,該技術涉及使用一種稱為核酸酶的酶,它像分子剪刀一樣“切割”DNA,可能會引起意想不到的副作用。在DNA中製造這種雙鏈斷裂會導致不必要的遺傳物質被插入或刪除,這可能會產生包括啟用致癌基因在內的後果。如果不產生這些不良的遺傳副產物,大多數突變都無法輕易糾正。
2016年,哈佛大學和麻省理工學院博德研究所的劉如謙(David Liu)領導的團隊開發了另一種方法,稱為鹼基編輯,該方法允許科學家在不依賴雙鏈斷裂的情況下對單個DNA鹼基進行精確編輯。然而,這項技術只能用於修復12種“點”基因突變中的4種,其中包括插入、缺失以及兩者的組合。
現在,劉如謙、劉如謙實驗室的博士後研究員安德魯·安扎隆(Andrew Anzalone)及其同事開發了一種新的基因編輯工具,該工具避免了這些雙鏈斷裂,並且可以糾正所有12種類型的點突變。研究人員在實驗室培養的人類細胞中使用了他們的新技術,稱為“先導編輯”,以糾正導致鐮狀細胞病和泰-薩克斯病的基因缺陷,他們在週一發表在《自然》雜誌上的一項研究中報告了這一發現。他們表示,他們的方法比傳統的CRISPR更有效(在某些細胞型別中除外),並且脫靶效應更少。原則上,它可以糾正約89%的已知人類致病基因缺陷,儘管這仍然是一項非常新的技術,在用於治療人類之前還需要進行更多的研究。
支援科學新聞報道
如果您喜歡這篇文章,請考慮訂閱以支援我們屢獲殊榮的新聞報道。 訂閱。透過購買訂閱,您正在幫助確保未來能夠繼續推出關於塑造我們當今世界的發現和想法的有影響力的報道。
“從宏觀角度來看,先導編輯的發明是所有基因編輯工作者都應該歡呼雀躍的時刻,”加州大學伯克利分校分子與細胞生物學教授、加州大學伯克利分校和加州大學舊金山分校合作機構創新基因組學研究所的技術與轉化科學主任費奧多爾·烏爾諾夫(Fyodor Urnov)說。“先導編輯可能是一種非常強大的[基因]修復方法,”烏爾諾夫說,他沒有參與這項研究,但曾是該論文的審稿人。但他提醒說,“實際上,現在還處於非常早期的階段。”
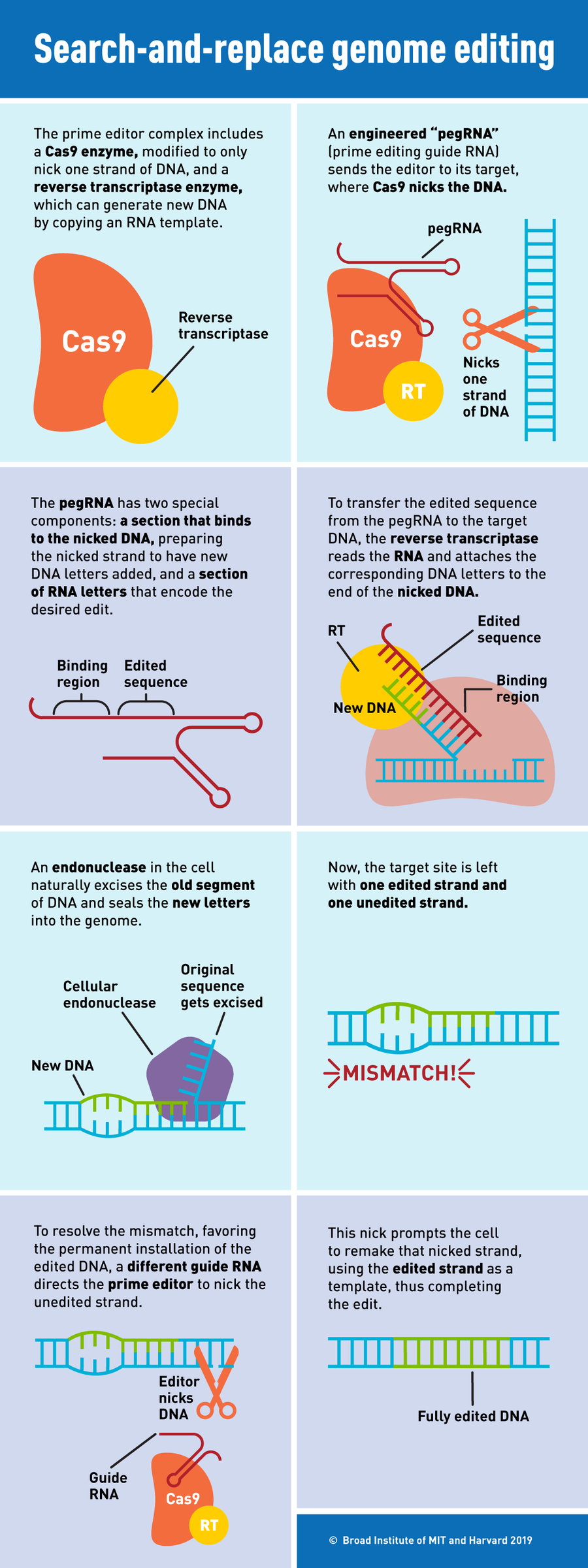
圖片來源:S. Hamilton & K. Zusi,麻省理工學院和哈佛大學博德研究所
先導編輯器由兩個元件組成:一種蛋白質和一個RNA分子。第一個是常見的CRISPR酶Cas9的工程改造形式,並與第二種酶——逆轉錄酶結合。第二個是工程改造的引導RNA,稱為pegRNA,它既指定DNA中的靶位點,又充當所需編輯的模板。在靶位點,工程改造的Cas9在DNA的一條鏈上切開一個缺口,逆轉錄酶將pegRNA直接複製到附著在該點的新DNA鏈中,逐個鹼基進行復制。這會建立一個帶有編輯序列的額外DNA“瓣”。然後,先導編輯器切割未編輯的鏈,並將其替換為編輯後的鏈。
“如果說核酸酶[如Cas9]像剪刀,鹼基編輯器像鉛筆,那麼先導編輯器就像文字處理器,”劉如謙說。它們為DNA提供了一種“搜尋和替換”功能。
安扎隆和他的同事將先導編輯與CRISPR的常用DNA修復機制進行了比較,發現新方法更有效(意味著它成功編輯了更高比例的細胞),並且產生的插入和缺失要少得多。透過先導編輯,該團隊能夠實現約20%至50%的效率——在某些情況下,根據細胞型別的不同,效率高達78%。對於某些疾病,如鐮狀細胞病,即使25%至30%的效率也可以緩解某些症狀。其他疾病,如囊性纖維化,則需要更高的效率。
已知CRISPR酶Cas9在基因組中的多個位點具有意想不到的或脫靶效應。研究人員表明,先導編輯在這些位置引起的脫靶效應更少。他們認為發生這種情況的原因是,Cas9只需要一次DNA配對,而先導編輯需要三次,這意味著可能產生不良影響的隨機配對的可能性較低。
其他研究人員稱讚了這種新方法,儘管他們指出該技術仍處於早期階段。多位CRISPR先驅之一的張鋒(Feng Zhang)也在博德研究所工作,但沒有參與這項研究,他稱其為“一種創造性的方法,進一步擴充套件了可以進行的基因改變範圍。”(張鋒是Editas Medicine和Beam Therapeutics公司的聯合創始人,這兩家公司正在開發基於CRISPR的療法。)
劍橋大學生物化學教授尤西·泰帕勒(Jussi Taipale)稱其為“重大進展”,它“從基因組切割工具轉向真正的基因組編輯工具。”
“很高興看到CRISPR-Cas9工具箱中又多了一個工具!”加州大學伯克利分校的CRISPR先驅詹妮弗·杜德納(Jennifer Doudna)補充道,她不是這項研究的共同作者,但與劉如謙的實驗室有合作。(杜德納是Caribou Biosciences、Editas Medicine、Scribe Therapeutics和Mammoth Biosciences的聯合創始人——所有這些公司都在從事CRISPR技術的研究。)
像所有新技術一樣,先導編輯也有其侷限性,在科學家考慮將其用於人體之前,必須克服這些侷限性。首先,研究人員必須弄清楚如何以安全有效的方式將該工具遞送到體內的細胞,使其到達目標細胞。安扎隆和他的同事在他們的研究中探索了病毒和非病毒遞送方法,他們計劃在動物身上進行更多的研究。
烏爾諾夫說,另一個問題是,工程改造的酶和RNA是否會啟用人體的免疫系統。RNA最初來自細菌,酶來自病毒,因此兩者是“我們從未見過的嵌合體”,他補充道。(傳統的CRISPR也面臨類似的挑戰。)
張鋒說,引入逆轉錄酶也可能將細胞中的其他RNA複製到DNA中,然後整合到基因組中,從而引起不良影響。
最後,還有效率問題。張鋒說,他們取得的成果很有希望,但需要在某些疾病特定的細胞型別中加以改進。
先導編輯不太可能取代CRISPR或鹼基編輯等技術。“核酸酶編輯器[如Cas9]、鹼基編輯器和先導編輯器都有優點和缺點,”劉如謙指出。“我們預計這三類工具都將在治療和研究中發揮作用,”他說。
烏爾諾夫將不同的基因編輯工具比作犬種——每種犬種都有其專門的功能。例如,邊境牧羊犬擅長放羊,而德國牧羊犬則適合做警犬。當談到基因編輯時,他說,“我真的認為我們沒有足夠的資料來判斷哪種‘犬’將被最廣泛地使用。”
