在一個月光皎潔的夜晚,三個虛構的狂歡者在英國荒原上被可怕的景象驚呆了:“一個汙穢的東西,一個巨大的黑色野獸,形狀像獵犬,但比凡人眼睛見過的任何獵犬都大。就在他們看著的時候,那東西撕開了雨果·巴斯克維爾的喉嚨,當它轉過頭,滴著血的下巴對著他們時,三個人尖叫著恐懼,策馬狂奔逃命。”醫學史學家追溯了《巴斯克維爾的獵犬》在阿瑟·柯南·道爾的粉絲中引起的恐懼,這源於狂犬病對當時英國社會意識的深刻影響。狂犬病毒能夠將最溫順的寵物變成口吐白沫、狂怒咆哮的野獸,並且死亡率幾乎達到 100%,是人類歷史上最令人恐懼的災難之一。
早在 1804 年,德國醫生格奧爾格·戈特弗裡德·津克 (Georg Gottfried Zinke) 的實驗就表明,病毒在受感染動物的唾液中濃度很高。這種病菌還能增強唾液的產生,同時增加口腔中唾液的含量——這解釋了為什麼患狂犬病的狗會流口水。路易斯·巴斯德在 19 世紀 80 年代進一步證明,大腦也感染了這種病毒。這一切都不是偶然的。兩個世紀的研究現已證實,狂犬病毒結合了一種傾向,即從受感染動物沾滿唾液的下巴轉移,並具有一種惡魔般的能力,驅使其陷入狂怒的攻擊性咬傷。透過進化上的壯舉,病毒操縱宿主的大腦,以確保自身有效傳播。
狂犬病每年仍導致超過 59,000 人死亡。然而,由於疫苗接種和對受感染動物的隔離,它在發達國家不再引起恐慌。相反,神經科學家正在將這種惡性病菌轉變為人類的優勢。狂犬病毒擅長從咬傷部位到達大腦,透過偷偷地從神經元跳躍到神經元——從而逃避免疫系統的檢測。包括我在倫敦聖斯伯裡維康神經迴路與行為中心小組在內的許多研究人員,現在已經利用和改進了這種能力,以視覺化神經元之間的連線。
支援科學新聞報道
如果您喜歡這篇文章,請考慮支援我們屢獲殊榮的新聞報道,方式是 訂閱。透過購買訂閱,您正在幫助確保未來能夠繼續講述關於塑造我們當今世界的發現和思想的具有影響力的故事。
人腦由數十億個神經元組成,每個神經元與數千個其他神經元相連;繪製這個錯綜複雜的網路對於理解大腦如何產生我們的情感和行為至關重要。利用基因工程改造的狂犬病毒,我們現在可以觀察特定型別的神經元接收何種輸入,電訊號如何從眼睛傳遞到大腦,以及哪些型別的神經元控制姿勢以防止我們摔倒。儘管該領域仍處於起步階段,但在未來,這些資訊可能有助於我們理解神經退行性疾病(如帕金森病),並可能找到治療方法。
從咬傷到大腦
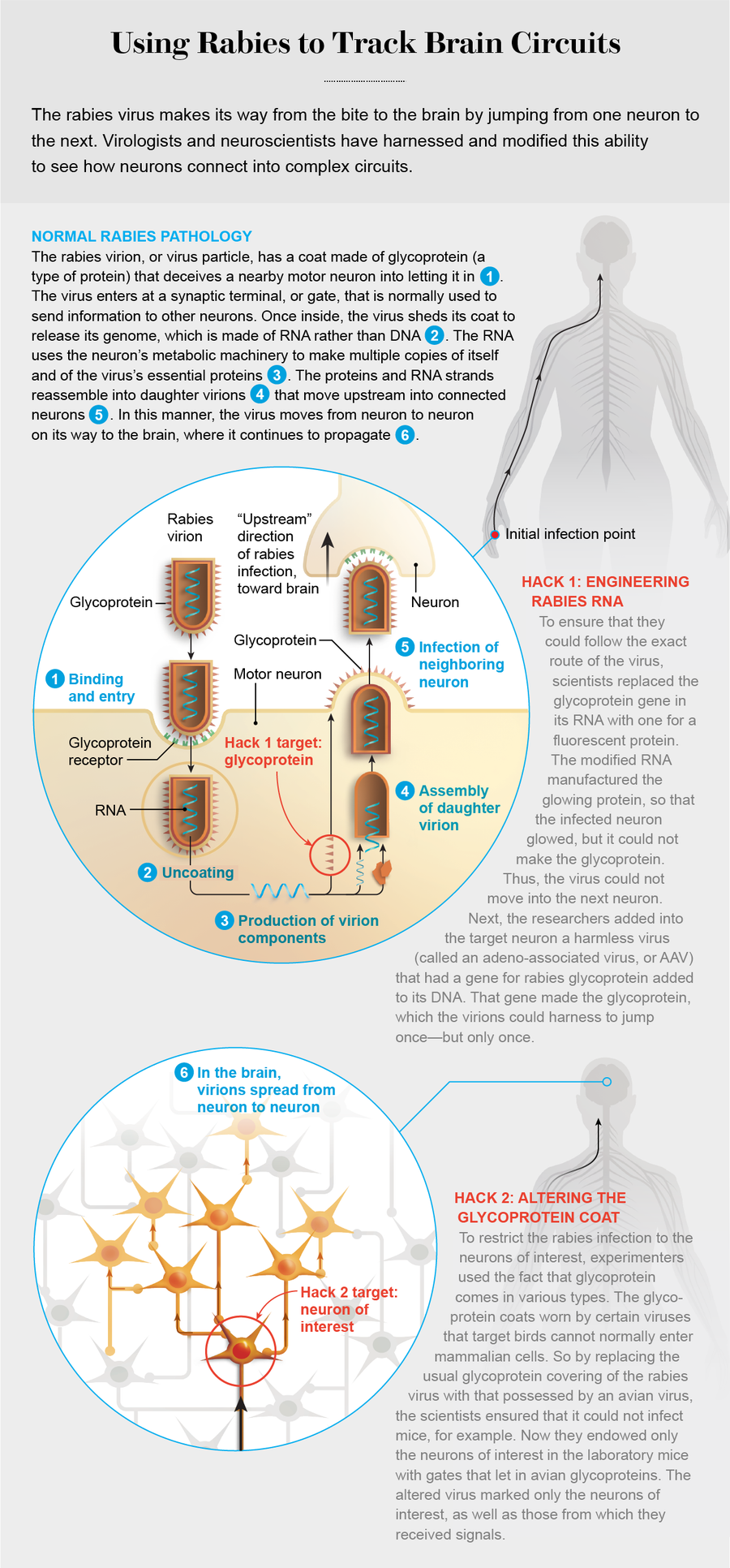
首先,咬傷會將病毒粒子或病毒顆粒注入肌肉組織。狂犬病毒粒子呈子彈狀膠囊,包含單鏈 RNA 和蛋白質,表面覆蓋著一種稱為糖蛋白的尖刺蛋白。這種外殼欺騙了將突起傳送到攻擊部位的運動神經元,使其將病毒帶入細胞內部。運動神經元釋放化學物質,導致肌肉收縮,它們透過一長串其他神經元與受害者的腦部相連——病毒的最終目的地。
確切地說,糖蛋白與神經元突觸末梢上的受體結合:突觸末梢是神經元向相鄰神經元傳遞訊號的點。就像機場安全區域唯一的出口門一樣——而不是入口——突觸末梢保護著神經元之間單向通道——突觸。按照慣例,突觸的“下游”方向是訊號從一個神經元到下一個神經元的流動方向,一直從大腦到肌肉。然而,狂犬病毒逆流而上,因為它必須到達大腦。因此,它欺騙受體,通過出口門進入運動神經元。
病毒擅長利用宿主細胞為自己服務,但很少有病毒能在這方面勝過狂犬病毒。一旦進入細胞內部,入侵者就會脫掉糖蛋白偽裝,其 RNA 開始工作,利用細胞的物質和代謝來產生自身的副本以及所有特徵蛋白。然後,這些成分重新組裝以產生子代病毒粒子。許多病毒種類複製速度非常快,以至於它們迫使受感染的細胞破裂,將病毒粒子釋放到細胞之間的空間中,而狂犬病毒則嚴格調節其繁殖——僅產生足夠的子代以繼續前進。這樣,它就避免了造成如此大的損害以至於驚動免疫系統。相反,它使宿主細胞完整無損,並穿過突觸到達新的上游神經元。這種偷偷摸摸是該疾病潛伏期如此之長(通常在人類中為一到三個月)的原因之一。
就這樣跳到新的神經元后,病毒粒子再次開始整個過程:脫掉偽裝並複製自身,然後重新組裝子代,這些子代移動到下一個上游神經元。透過這種方式,狂犬病毒在神經系統中選擇了一條路徑,從它最初在肌肉組織中遇到的運動神經元,透過脊髓,進入大腦。
到 21 世紀初,包括現就職於巴黎-薩克雷神經科學研究所的加布裡埃拉·烏戈里尼 (Gabriella Ugolini) 和現就職於匹茲堡大學的彼得·斯特里克 (Peter Strick) 的幾個研究小組,都在致力於利用狂犬病作為神經元迴路的示蹤劑。然而,破譯病毒從肌肉到大腦的路徑是一個挑戰。作為一名神經科學家,在觀察已被病毒感染的神經元快照時,您如何區分入侵者從一個神經元到下一個神經元的第一次跳躍、第二次跳躍等等?
研究人員最初透過在感染後不久對實驗動物實施安樂死來解決這個問題,從而使病毒僅在一到兩個突觸之間傳播。這種方法揭示了大腦中一些有助於運動控制的主要通路。但這有其缺點。並非神經元之間的所有連線都是平等的。一個突觸可能是強(或弱)的,這使得訊號跨越它移動時更有可能(或更不可能)促使目標神經元做出反應。另一個突觸可能位於靠近細胞體的位置,而不是遠離突起的末端。一些神經元與下游神經元建立單個連線,而另一些神經元則可能建立數百個連線。這種異質性意味著病毒從一個神經元傳播到下一個神經元所需的時間長短不一,從而增加了一層不確定性。如果病毒在穿過一個弱突觸之前先穿過兩到三個強突觸怎麼辦?
病毒工程
為了解決這個問題,科學家需要改造狂犬病毒。分子生物學家已經發展出操縱 DNA 的驚人能力:基因交換對他們來說已變得像在實驗室廚房裡煮咖啡一樣 routine。然而,野生狂犬病毒沒有 DNA 可供操縱,只有 RNA。逆轉遺傳學的出現繞過了這個障礙,逆轉遺傳學透過從 DNA 製造 RNA 來顛倒正常的遺傳週期。1994 年,當時都在德國蒂賓根動物病毒疾病聯邦研究中心的馬蒂亞斯·施內爾 (Matthias Schnell) 和卡爾-克勞斯·孔澤爾曼 (Karl-Klaus Conzelmann) 僅從克隆 DNA 在實驗室中產生了功能性狂犬病毒。他們甚至改變了狂犬病毒基因組:編碼其特徵特性的 RNA 鏈。
操縱基因組的能力迅速加深了人們對不同狂犬病毒基因如何影響病毒的各種技能的理解。事實證明,只有一個基因對於病毒在神經元之間移動的能力至關重要:編碼糖蛋白的基因。從其基因組中刪除糖蛋白基因的狂犬病毒可以感染細胞,但一旦進入細胞內部,它就會被困在那裡。這將是將病毒推向主流神經科學的發現。
2007 年,當時都在加利福尼亞州拉霍亞市索爾克生物研究所的神經科學家伊恩·威克沙姆 (Ian Wickersham) 和愛德華·卡拉韋 (Edward Callaway) 與德國弗里德里希-勒夫勒研究所的病毒學家孔澤爾曼和斯特凡·芬克 (Stefan Finke) 之間的合作產生了一個巧妙的系統來繪製神經元迴路圖。他們計劃的第一步是用編碼熒光蛋白的基因替換狂犬病毒基因組中的糖蛋白基因。經過基因工程改造的病毒粒子無法制造糖蛋白;相反,其 RNA 製造熒光蛋白(以及所有其他狂犬病毒蛋白)的副本——因此受感染的細胞會發出實驗者選擇的明亮顏色。
第二步是透過一些其他遺傳機制在目標神經元中提供糖蛋白。這樣,子代病毒粒子就可以穿上糖蛋白外殼並跳躍一次——但僅此一次。為此,科學家們利用了一種非常簡單的病毒型別,稱為腺相關病毒 (AAV),因為它通常與稱為腺病毒的更大病毒一起發現。AAV 含有少量的 DNA。索爾克研究所的研究人員將一個用於製造狂犬病毒糖蛋白的基因插入到該 DNA 中。狂犬病毒粒子可以利用該基因製造的糖蛋白跳過單個突觸。但是,它無法將糖蛋白基因帶走,因為它是一段 DNA,而不是 RNA。因此,當病毒粒子跳入下一個細胞時,它再次被困住。那時,看一眼受感染動物的大腦,就會發現遍佈神經系統的發光細胞群,這些細胞群與研究人員想要靶向的任何神經元直接相連。
然而,仍然存在一個問題。將狂犬病毒注射到大腦中會導致任何將突起傳送到注射部位的神經元直接感染。如果無法將狂犬病毒的初始感染限制在特定神經元,科學家就無法區分直接被注射病毒感染的神經元和病毒穿過突觸後感染的神經元。解決方案將來自病毒學的另一個領域:專門感染鳥類的病毒。
在野外,可以找到整類病毒,它們只感染某些動物群體。例如,禽肉瘤白血病病毒 (ASLV) 通常會導致雞患癌症,但通常不能感染哺乳動物細胞。與狂犬病一樣,這種病毒也有一種糖蛋白包膜,它有多種構型。不同的 ASLV 糖蛋白被稱為 Env(代表包膜),後跟特定形式的標籤。每個亞型都與特定的受體結合。例如,EnvA 與稱為 TVA(代表禽腫瘤受體病毒 A)的受體結合。如果細胞不具有 TVA 受體,則它不能被 EnvA 包膜的病毒感染。這種選擇性相互作用使研究人員能夠將狂犬病毒的初始感染限制為一種型別的神經元。
透過在感染狂犬病毒的細胞培養物中引入 EnvA 糖蛋白基因(一種稱為假型化的過程),威克沙姆、卡拉韋及其同事用禽病毒的 EnvA 糖蛋白取代了狂犬病毒上的天然糖蛋白外殼。經過如此改變,狂犬病毒無法欺騙任何哺乳動物細胞讓其進入。透過賦予感興趣的神經元(通常在小鼠大腦中)TVA 受體,神經科學家可以確信狂犬病毒只會感染該細胞。
目標神經元(實際上是一類神經元)也配備了含有狂犬病毒糖蛋白基因的 AAV。一旦進入細胞內部,狂犬病毒就會脫下它的雞服裝,穿上它的正常外套,並跳入上游神經元。透過對狂犬病毒進行基因工程改造,使其僅從一組明確的“起始”神經元感染並跳躍一次,研究人員現在可以清楚地瞭解大腦是如何連線的。
調整狂犬病毒
delta-G 狂犬病系統(因其發明者稱之為改變的糖蛋白而得名)的簡單性和優雅性席捲了神經科學界。使用該系統,研究人員可以立即看到哪些型別的神經元向感興趣的神經元傳送訊號。然而,像所有新技術一樣,該方案也有其不完善之處。有時標記的連線數量相當少——每個起始神經元大約 10 個。
圖片來源:凱莉·墨菲
大約在 2015 年,當時都在哥倫比亞大學的托馬斯·里爾登 (Thomas Reardon)、托馬斯·傑塞爾 (Thomas Jessell)、阿提拉·洛松齊 (Attila Losonczy) 和我,正在使用 delta-G 系統來理解引導運動指令的神經迴路。在脊髓或大腦中的運動神經元中發現的連線數量相對較少,我們懷疑我們得到的電路圖是不完整的。另一個問題是神經毒性。一旦病毒進入細胞,它就會在幾周內開始分解並死亡。如果病毒本身正在導致單個神經元改變其行為,那麼解釋任何觀察結果都可能存在問題。
施內爾和克里斯托夫·維爾比希 (Christoph Wirblich) 都就職於托馬斯·傑斐遜大學,他們在狂犬病毒生物學方面做了開創性的工作,因此我們向他們尋求幫助。他們立刻知道我們的問題源於我們正在使用的病毒株。它最初是為狂犬病疫苗而開發的。疫苗包含人類選擇的特殊病菌株,這些病菌株繁殖異常迅速,因此大量的子代病毒粒子從受感染的細胞中爆裂出來,並在為時過晚之前提醒免疫系統。這指明瞭改進我們研究工具的方向。由於我們在研究中使用小鼠,我們的病毒學家合作者建議我們嘗試一種經過多年調整以感染小鼠神經元的毒株。
該毒株的親本病毒最初是在野外分離出來的,然後透過反覆在小鼠大腦或細胞系中傳代“固定”在實驗室中。因此,它已經進化成為專門針對小鼠神經系統的專家。在組裝了基於這種小鼠特異性毒株的神經元示蹤機制後,我們發現它標記的連線比我們之前看到的要多得多。此外,由於它是逃避小鼠免疫系統的專家,因此它產生的每種蛋白質的量相對較少。因此,它對宿主細胞機制的壓力較小,並允許神經元保持相對健康的狀態。
我們進一步改變了我們的示蹤系統,用編碼光敏蛋白(稱為通道視紫紅質 (ChR),最初在綠藻中發現)的基因替換了狂犬病毒中熒光蛋白的基因。當被藍光啟用時,這種非凡的分子打開了一個通道,允許帶正電的離子流入目標神經元,從而促使其發出電訊號。(然而,受感染的細胞繼續發光,因為我們使用了包含熒光蛋白的 ChR 版本。)藉助這種微調的狂犬病毒系統,我們可以觀察整個神經元迴路在小鼠的某些動作期間放電,或者開啟或關閉它們——最長可達病毒感染神經元后的一個月。這為我們提供了充足的時間來進行許多我們需要進行的測試,以瞭解特定迴路如何產生行為。
佈線圖
利用不同版本的 delta-G 狂犬病系統,神經科學家已經探測了神經系統中的許多不同迴路,以瞭解它們如何影響動物的感知和行為。以視覺系統為例。當光線進入眼睛時,視網膜後部的神經元(稱為視網膜神經節細胞)會將訊號傳遞到大腦。神經科學家傳統上認為,這些資訊傳遞到大腦中的中間位置,最終到達大腦皮層——著名的灰質——在那裡進行處理。瑞士弗里德里希·米歇爾生物醫學研究所的博頓德·羅斯卡 (Botond Roska) 小組使用狂犬病系統追蹤了從視網膜神經節細胞到外側膝狀體核 (LGN) 的輸入,外側膝狀體核是大腦中被認為是皮層中繼站的區域。
研究人員證明,LGN 包含三種不同型別的神經元,每種神經元可能以不同的方式處理視覺資訊。事實上,只有不到三分之一的神經元充當了中繼站,提供了從視網膜到皮層的直接線路。但大約另有三分之一的神經元接收來自一隻眼睛的不同輸入的組合;其餘神經元(約 40%)接收來自雙眼的訊號。因此,儘管 LGN 位於視覺迴路的早期階段,但其大部分神經元都整合了來自多個來源的資訊。這一發現可能會闡明大腦解釋來自眼睛的資訊的過程。
在哥倫比亞大學,我的同事和我研究了外側前庭核 (LVN) 中的神經元,這是一個試圖防止我們摔倒的大腦區域。想象一下,你在一輛行駛中的地鐵列車上,列車突然意外停下。在您有時間思考之前,您會移動雙腳進行補償,繃緊雙腿,甚至抓住最近的杆子。大腦如何在各種類似情況下如此迅速地啟用正確的肌肉群?
我們發現,小鼠的 LVN 包含兩種解剖學上不同的神經元型別,每種神經元型別都具有與神經系統不同部位的不同下游連線。一組神經元在您的大腦感知到您的身體不穩定後會非常迅速地啟動;這些神經元的作用是伸展四肢以擴大支撐面。稍後,第二組 LVN 神經元變得活躍。這些神經元的作用是加強和穩定同一肢體的關節,使身體能夠被推回原來的位置。我們可以透過簡單地開啟藍光來啟用這些神經元,藍光透過光纖電纜傳輸到 LVN。當光線亮起時,小鼠會調整其四肢的位置,就好像是為了阻止自己摔倒一樣——即使它們沒有失去平衡。
哈佛大學的內奧·內奇達 (Nao Uchida) 實驗室調查了第三個重要問題:釋放多巴胺的神經元的功能是什麼?長期以來,人們知道大腦中兩個區域(黑質緻密部 (SNc) 和腹側被蓋區 (VTA))中的此類“多巴胺能”神經元會對獎勵做出反應。當實驗動物獲得獎勵或感官刺激預示著獎勵即將到來時,它們會變得非常興奮。(想想吃一塊糖果,與聽到糖果包裝紙的沙沙聲相比。)為了瞭解神經元接收何種型別的資訊,科學家需要知道它們是如何連線到其他腦回路的。哈佛大學團隊使用 delta-G 系統發現,SNc 中的多巴胺能神經元接收有關刺激相關性的資訊:這種糖果包裝紙的聲音會讓我得到一塊巧克力嗎?相比之下,VTA 接收有關獎勵質量的資訊:這塊糖果有多好吃?
碰巧的是,SNc 中的多巴胺能神經元會在帕金森病中退化。有趣的是,內奇達及其同事還發現,SNc 中此類神經元的主要輸入來自丘腦底核,丘腦底核是大腦中一個小的、透鏡狀區域,與類似的核一起參與控制運動。透過插入電極來刺激丘腦底核(一種稱為腦深部刺激的技術)通常可以有效緩解帕金森病的症狀。神經科學家推測他們發現的輸入解釋了為什麼這種刺激有效,他們推斷,靶向他們已確定也向 SNc 傳送輸入的其他大腦區域,可能會幫助一些帕金森病患者。
因此,自然進化和有針對性的工程相結合,為神經科學家提供了一種非常強大的工具。仍有很大的改進空間。例如,是否有可能對病毒進行基因工程改造,使其向下遊移動,標記神經元的輸出而不是輸入?我們能否製造出一種僅標記神經元之間活躍連線的病毒,從而點亮參與不同行為的迴路?是時候讓這種操縱和恐嚇人類數千年的病毒被操縱來為我們服務了。