當瑪麗·戴維斯因治療乳腺癌的藥物差點喪命時,她向身為科學家的丈夫提出了挑戰:他是否願意將研究重點轉向設計更好的癌症療法?作為加州理工學院帕薩迪納分校的化學工程師,馬克·戴維斯當時正在製造用於化學合成的固體催化劑。但在 1996 年,在瑪麗經歷了高毒性化療藥物多柔比星(被稱為“紅色死亡”)的痛苦之後,他聽從了妻子的懇求,開始著手這項工作。
戴維斯運用他的工程技術,設計出一種比人類頭髮絲寬度還要小千分之一的盔甲狀顆粒,用於包裹藥物喜樹鹼。大約在妻子接受治療十年後,他親眼目睹醫生將這種分子(現在稱為 CRLX101)注射到第一位患者雷·納塔體內。“這是我做過的最可怕的事情,”戴維斯回憶道。在為期六個月的安全性試驗中,納塔的胰腺癌(已擴散到肺部)得到了遏制。而且,與未受保護的藥物相比,這種奈米顆粒包覆的藥物似乎引起的副作用更少。
在有毒分子周圍構建保護層可以解決癌症治療中最大的遺留挑戰之一——如何在攻擊癌細胞時保護健康細胞。化療藥物透過殺死快速分裂的細胞來阻止導致腫瘤的癌細胞過度生長。但是,這些藥物透過供應全身的血管網路到達癌細胞。而且,正如瑪麗·戴維斯的經歷所表明的那樣,它們同樣有可能毒害健康細胞和癌細胞。
支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。 透過購買訂閱,您將幫助確保有關塑造我們當今世界的發現和思想的具有影響力的故事能夠繼續存在。
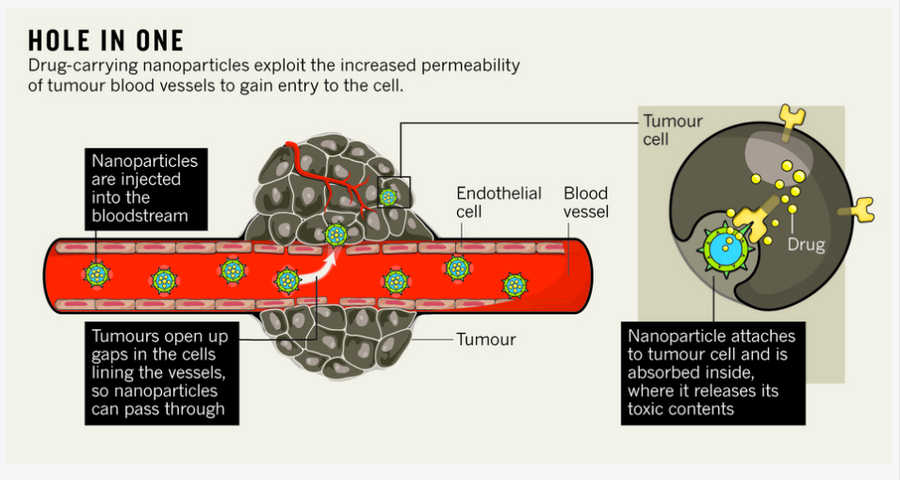
因此,研究人員正在研究將藥物直接輸送到癌組織的方法。藥物輸送是一個多階段的旅程:活性成分需要進入人體,透過血液迴圈到達腫瘤部位,穿透腫瘤塊,然後進入細胞(見下文“一桿進洞”)。透過改進每個步驟,研究人員的目標不僅僅是保護身體免受有毒藥物的侵害。開創性的藥物輸送系統旨在運輸有效載荷——從劇毒分子到遺傳物質——這些物質絕不應單獨在體內迴圈,並比現在可能實現的更精確地靶向癌細胞。
武裝抗體
紐約市阿爾伯特·愛因斯坦醫學院的癌症外科醫生史蒂文·利布蒂說,癌症治療進展的許多興奮點都集中在靶向癌症特異性生物途徑的藥物上。“但這種方法可能無法實現我們所希望的承諾,因為腫瘤本身會躲避這種策略,”他說。另一種方法是使用對所有細胞都有毒性的強效藥物,但將這些藥物限制在良性的“特洛伊木馬”中,直到它們到達腫瘤,他說。
最簡單的方法之一是用細胞殺傷藥物武裝尋癌蛋白。在 20 世紀 90 年代後期,製藥公司開發出與某些型別癌細胞表面結合的抗體。將這些蛋白質與藥物透過穩定的化學連線劑融合,產生強大的組合:抗體促進藥物被癌細胞攝取,而連線劑則阻止藥物在進入細胞內部之前發揮作用。“這是一個簡單的想法,”位於馬薩諸塞州沃爾瑟姆的 ImmunoGen 公司的首席科學官約翰·蘭伯特說,該公司開發並授權了將抗體與藥物連線的技術。“但這花了很長時間才將所有部件組裝在一起。”
市場上只有兩種抗體-藥物偶聯物 (ADC) 療法。第一種名為 brentuximab vedotin(由華盛頓州西雅圖基因公司以 Adcetris 的名稱銷售),於 2011 年獲得美國食品和藥物管理局 (FDA) 批准,用於治療某些型別的淋巴瘤(淋巴系統癌症),這些淋巴瘤對以前的治療沒有反應。第二種 trastuzumab emtansine(由加利福尼亞州南舊金山的基因泰克公司以 Kadcycla 的名稱銷售),於 2013 年被批准作為晚期乳腺癌的治療方法,用於在接受傳統化療藥物治療後。
Trastuzumab emtansine 將有毒化療藥物 emtansine 與抗體融合,這些抗體與一種名為 HER2 的蛋白質受體結合,HER2 在大約 20% 的乳腺癌中過度產生。在一項於 2012 年完成的 III 期試驗中,服用該藥物的近 500 名女性比接受標準治療的女性壽命延長了約五個月,副作用也更少
1。蘭伯特說,研究中的所有女性都處於疾病晚期,但由於試驗的積極結果,該藥物現在正在進行臨床試驗,作為一線治療藥物。幾種類似的藥物目前正處於高階臨床試驗階段,ImmunoGen 正在嘗試將 emtansine 與靶向其他癌症(從淋巴瘤到肺癌和卵巢癌)的抗體連線。包覆奈米顆粒
與傳統的單克隆抗體一樣,ADC 需要自行前往腫瘤部位。“你注射的分子不知道癌細胞在哪裡,”蘭伯特說。“如果它們經過癌細胞,它們可以附著,但大多數會去其他地方。”
一種方法是在化療藥物周圍新增一層包衣。由此產生的奈米顆粒直徑約為 20 到 100 奈米,對於大多數血管來說都太大而無法逃脫。但它們確實找到了從快速生長的腫瘤匆忙構建的滲漏血管中逃逸的途徑。因此,人們認為它們會優先在腫瘤部位積聚。然而,北卡羅來納大學教堂山分校的藥理學家魯道夫·朱利亞諾說,這種現象主要在動物模型中研究過,而不是在人體中研究過。
奈米顆粒可以攜帶比抗體更強的有效載荷,將數千種藥物包裹在一個分子中。然而,不幸的是,它們也會在肝臟和脾臟中積聚,在那裡它們不會產生治療益處,反而會引起副作用。為了最大限度地減少不良影響,研究人員用一層聚乙二醇包覆顆粒,聚乙二醇模仿水,有效地將藥物隱藏起來,使其免受檢測和吞噬入侵者的肝細胞的侵害。但朱利亞諾說,最大限度地減少肝臟攝取仍然是奈米顆粒設計的重要組成部分。
最早開發的用於藥物輸送的奈米顆粒用脂質包覆活性成分。第一個獲得批准的此類藥物是 1995 年的 Doxil。Doxil 攜帶多柔比星,用於治療卡波西肉瘤和其他實體瘤,包括乳腺癌和卵巢癌。
根據美國國家癌症研究所的資料,目前全球市場上有六種此類奈米顆粒獲得批准用於使用。到目前為止,它們似乎提高了安全性——Doxil 不會最終進入心臟,而多柔比星會在心臟中引起毒性——但沒有提高療效。因此,一些研究人員質疑奈米技術是否值得伴隨其生產的高昂價格標籤:它的成本可能是傳統治療的十倍。“新的基於奈米顆粒的藥物輸送將是昂貴的,並且必須透過改善的治療效果來證明其合理性,”朱利亞諾說。“我們仍處於太早的階段,無法確定這一點。”
儘管如此,奈米顆粒藥物輸送可以產生顯著且有價值的效果,加利福尼亞州杜阿爾特市希望之城癌症中心的腫瘤學家雲嚴說,他曾向納塔施用 CRLX101(由馬薩諸塞州劍橋市的 Cerulean Pharma 公司開發)。“當你看到一位病人,你期望他們的血細胞計數下降,你期望他們會噁心,但他們做得很好,這真是太神奇了,”他說。
為輸送而工程設計
馬薩諸塞州波士頓哈佛醫學院的醫生科學家、馬薩諸塞州三家基於奈米技術的生物技術公司的創始人奧米德·法羅克扎德說,奈米技術尚未充分發揮其潛力,因為到目前為止,它僅用於運送旨在透過傳統方法給藥的藥物。法羅克扎德的公司之一,沃特敦的 Blend Therapeutics,正在致力於專門為奈米顆粒使用而設計的藥物。
法羅克扎德的另外兩家公司——劍橋的 BIND Therapeutics 和沃特敦的 Selecta Biosciences——使用一種技術,該技術工程化一條長的聚合物鏈,該鏈可自發摺疊形成顆粒。聚合物中散佈著靶向配體,旨在將顆粒連線到癌細胞。自組裝使科學家更容易在不同的批次中複製分子——這是將該技術轉化為臨床的關鍵優勢。在 2012 年的一項研究中,法羅克扎德和他的同事篩選了 100 種聚合物,這些聚合物結合了一種與前列腺特異性膜抗原 (PSMA) 結合的分子,PSMA 顯示在大多數前列腺腫瘤的表面
2。這些顆粒包裹著化療藥物多西他賽。最有希望的奈米顆粒 BIND-014 正在進行治療肺癌和前列腺癌的 II 期試驗。
一些研究人員正在從傳統的化療中分支出來,並使用奈米顆粒將 RNA 小片段輸送到癌細胞,在那裡它們降低某些基因的表達,這種方法稱為 RNA 干擾。戴維斯說,使用奈米顆粒輸送 RNA 是很有希望的,因為它允許研究人員一次性到達多個基因,從而到達多個通路。他開發了第一個進入癌症臨床試驗的 RNA 攜帶奈米顆粒。該顆粒名為 CALAA-01,靶向基因 RRM2,該基因參與細胞分裂,並使用與轉鐵蛋白受體結合的分子(轉鐵蛋白受體在癌細胞上高度表達)進入細胞內部
3。CALAA-01 進入了治療黑色素瘤的 I 期臨床試驗,但後續試驗因原因不明而被暫停。
其他努力旨在將藥物直接輸送到腫瘤。加拿大蒙特利爾理工學院的生物醫學工程師西爾萬·馬特爾正在構建磁性顆粒,研究人員將能夠引導這些顆粒到達腫瘤。這些顆粒使用與磁共振成像 (MRI) 中相同的造影劑,因此當患者在 MRI 掃描器中時,研究人員可以在腫瘤頂部使用強磁場來引導藥物到達正確的部位。馬特爾和他的同事已經在豬身上測試了該方法,並計劃在人身上嘗試。馬特爾說,磁性顆粒可以包裹其他靶向顆粒。“我們建造了一輛卡車,我們有一個 GPS 系統,”他說。“你可以將任何東西裝入卡車。”
研究人員駕駛藥物直接到達腫瘤部位的願景與瑪麗·戴維斯近 20 年前經歷的全方位攻擊截然不同。今天,她鼓勵丈夫開發的藥物即將結束 II 期臨床試驗,並已用於治療數百名患者。馬克·戴維斯說,未來的療法可能會更有效,副作用更少。“我們需要考慮降低癌症影響的方法,這樣人們就可以在沒有所有額外副作用和毒性的情況下過上合理的生活。”
本文經許可轉載,並於 2014 年 5 月 28 日首次發表。
