沒有人預料到斑點的接管。2009年,由德國德累斯頓馬克斯·普朗克分子細胞生物學和遺傳學研究所的安東尼·A·海曼領導的一個生物物理學家團隊,正在研究一種微小的土壤蠕蟲單細胞胚胎中稱為P顆粒的斑點狀結構。眾所周知,這些斑點只聚集在細胞的一端,使其變得不對稱,這樣當細胞分裂時,兩個子細胞是不同的。研究人員想知道P顆粒的不均勻分佈是如何產生的。
他們發現,這些由蛋白質和RNA組成的斑點,像潮溼空氣中的雨滴一樣在細胞的一側凝結,又在另一側溶解。換句話說,顆粒的分子成分正在經歷相變,就像將物質在液態和氣態之間切換一樣。
這在細胞生物學中發生是一件奇怪的事情。但起初,許多研究人員認為這只不過是一個怪癖,並沒有引起太多關注。然後,這些小斑點——現在被稱為生物分子凝聚物——開始在研究人員觀察細胞的幾乎任何地方出現,執行著無數重要的任務。
支援科學新聞
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。 透過購買訂閱,您正在幫助確保有關塑造我們當今世界的發現和想法的具有影響力的故事的未來。
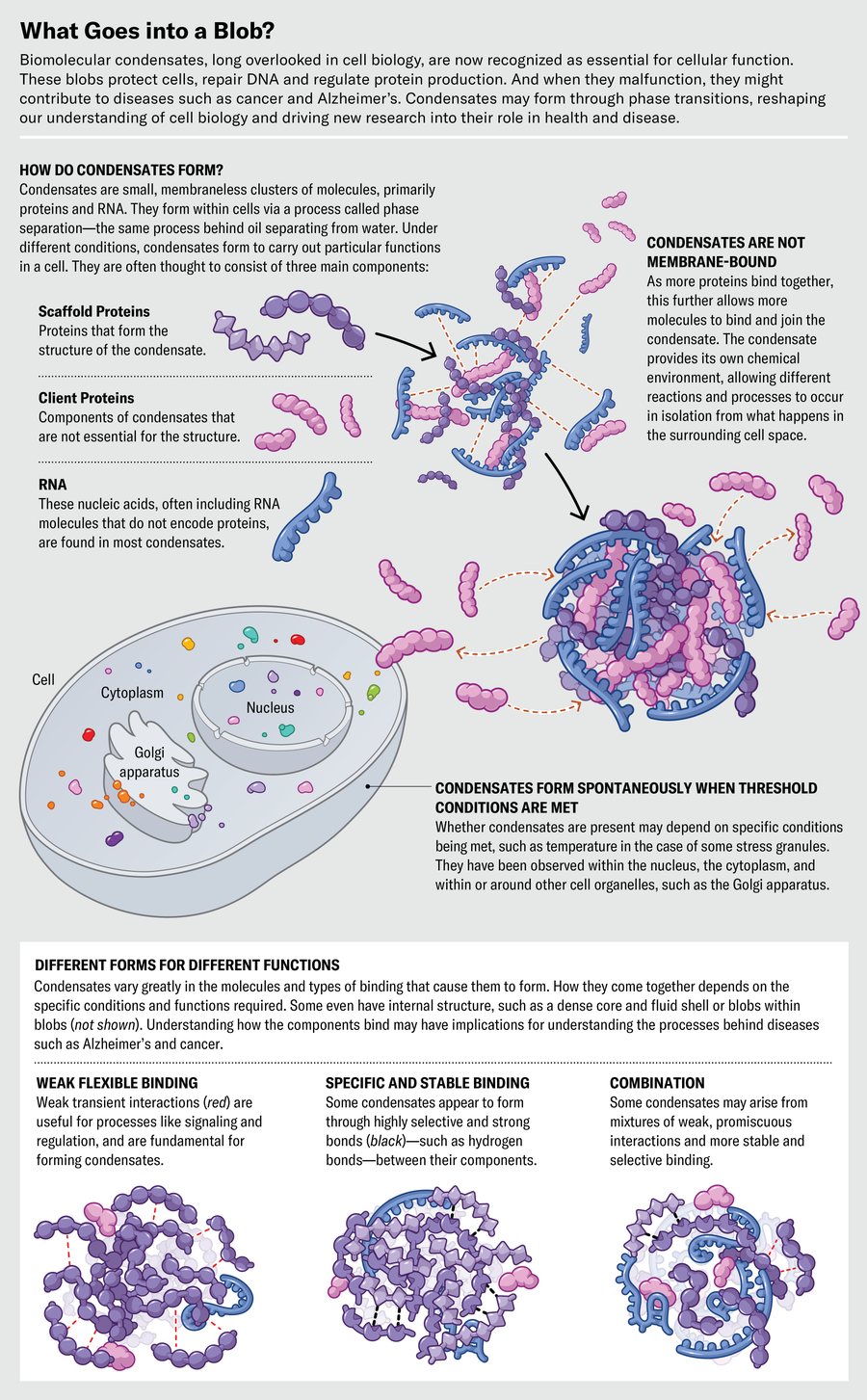
生物學家長期以來一直認為,將秩序和組織帶入細胞內分子的混亂狀態取決於稱為細胞器的膜結合區室,例如線粒體。但事實證明,凝聚物提供了“免費的秩序”,而無需膜。它們提供了一種簡單、通用的組織方式,細胞可以開啟或關閉。德國馬丁斯里德馬克斯·普朗克生物化學研究所的生物物理學家佩特拉·施維勒解釋說,這種安排允許生命賴以生存的許多事物。
現在看來,活細胞內的這些小斑點遍佈生物世界的各個領域,並且“與細胞功能的幾乎每個方面都相關”,生物物理工程師克利夫·布蘭溫尼說,他是2009年德累斯頓團隊的成員,現在在普林斯頓大學經營自己的實驗室。它們保護細胞免受危險的高溫或低溫;它們修復DNA損傷;它們控制DNA轉化為關鍵蛋白質的方式。當它們出現問題時,它們可能會引發疾病。
生物分子凝聚物現在似乎是生命如何使其無數分子成分協調和合作,形成委員會,對我們生存所依賴的群體決策做出關鍵部分。“細胞生物學的最終問題不是如何將幾個拼圖碎片拼湊在一起,”布蘭溫尼說,“而是數十億個拼圖碎片的集合如何在大尺度上產生湧現的、動態的結構。”
德累斯頓技術大學的生物物理學家西蒙·阿爾貝蒂說,這些無處不在的斑點“完全接管了細胞生物學”。現在的挑戰是瞭解它們是如何形成的,它們做什麼——也許是如何控制它們以設計新的醫療療法和治癒方法。
最初,研究凝聚物的研究人員認為它們是透過凝聚形成的,就像一種液相在另一種液相中變得不溶一樣——就像沙拉醬油中的醋滴。但凝聚物並不總是簡單的相分離液體。
2012年,達拉斯德克薩斯大學西南醫學中心的生物物理學家邁克爾·羅森和他的同事表明,各種蛋白質和RNA分子可以從溶液中相分離成緻密的液滴,然後凝結成粘彈性物質。它們似乎跨越了從粘稠的液體(如粘液)到幾乎固體的凝膠(如果凍)的範圍。或者,正如聖路易斯華盛頓大學的生物物理學家羅希特·帕普所描述的那樣,“所有的凝聚物都是橡皮泥。”
“生物分子凝聚物”這個總稱,由海曼、羅森及其同事在2017年提出,使這些無處不在的斑點與它們都是液體的早期概念區分開來。
現在看來,凝聚物是生命如何使其無數分子成分協調的關鍵部分。
與生物化學家和分子生物學家習慣研究的精確分子結合相比,凝聚物看起來可能很混亂。它們不是靜態形式,而是分子會合場所,通常是幾種不同成分的鬆散集合,其中一些成分可以進入或離開斑點。其中一些成分,稱為支架分子,對結構至關重要,粘合在一起形成凝膠狀網路。另一些成分,有時被稱為客戶分子,只是在網路中閒逛。然而,這兩種型別似乎都可以在不使凝聚物解體的情況下來回移動。
通常,凝膠包含蛋白質和RNA分子。蛋白質的原型形象是一種酶,由氨基酸鏈緊密摺疊成球狀物製成。但凝聚物中許多蛋白質的部分更開放和鬆散(像煮熟的義大利麵),或者生物化學家稱之為內在無序區域。
這種形成凝聚物的蛋白質通常似乎有粘性斑塊,例如,鏈攜帶電荷,可以相互吸引,透過無序和柔性的間隔區段連線在一起。與蛋白質(如酶)緊密且非常選擇性地結合其他分子的傳統觀點不同,內在無序蛋白質的相互作用可能相當弱且混雜:它們在結合物件時不太挑剔。
許多凝聚物的另一種成分是RNA分子,它也是帶有電荷的長鏈。長期以來,RNA主要被認為是作為中間體,將資訊從基因傳遞到核糖體的機器,核糖體將其翻譯成蛋白質鏈的氨基酸序列。但形成凝聚物的RNA通常是不同家族的成員:非編碼RNA,它們不僅僅是製造蛋白質的信使,而且本身就是目的。
同時,凝聚物中的一些蛋白質屬於一個家族,其工作似乎是結合RNA。透過調整蛋白質和RNA序列和結構以改變它們的結合傾向,生物學具有用於改變凝聚物功能或它們形成條件的旋鈕。
例如,當酶用其他化學基團(如帶電的磷酸鹽)修飾蛋白質時,可能會將蛋白質切換到形成凝聚物的模式,從而改變它們的形狀和粘性。或者,當細胞開始合成組成RNA時,可能會召喚這些斑點。例如,當我們自己的細胞製造一種稱為NEAT1的非編碼RNA時,似乎就會發生這種情況,NEAT1是稱為核旁斑的凝聚物的支架,在調節基因中起作用。
奇怪的是,科學家們早在知道活細胞時就已經有了凝聚物存在的證據——他們只是不知道該如何理解它們。早在1830年,早期的顯微鏡學家就在細胞核內看到了神秘的斑點。它們當時被稱為核仁,後來被發現是核糖體制造的地方。但直到2011年,布蘭溫尼、海曼和哈佛醫學院的資深細胞生物學家蒂姆·米奇森才闡明瞭核仁實際上是什麼:相分離的液滴。
這些特殊的斑點有很多工作要做。似乎它們有助於控制核糖體組裝的所有許多步驟——由許多蛋白質和RNA片段組成。布蘭溫尼和其他人已經表明,液態核仁(一種凝聚物)被細分為幾個具有不同成分的同心層,就像雞蛋的殼、蛋白和蛋黃一樣。“這種分層凝聚物允許不同處理步驟的空間隔離,”他解釋說。
現在醫學工作室
除了核仁外,凝聚物還與細胞的其他長期公認的區室和細胞器相關聯。其中之一被稱為高爾基體:細胞核附近的一組堆疊的帶狀脂質膜,充當蛋白質和其他分子的一種分揀中心。達拉斯德克薩斯大學西南醫學中心的張藝雲和約阿希姆·西曼已經表明,當細胞受到壓力時,這些帶狀物由一種稱為GM130的蛋白質形成的凝聚物來維持或修復。
該蛋白質在高爾基體膜上建立一個基質,然後將RNA和RNA結合蛋白聚集到液相中,這有助於將膜粘合成堆疊。然而,在壓力條件下,蛋白質和RNA分離,凝聚物解體,帶狀物開始瓦解。然後,釋放的GM130與RNA聚集形成凝聚物“應激顆粒”,將其儲存起來,以便在壓力過去後將膜重新粘合在一起。
這只是凝聚物如何幫助細胞度過困難時期的一個例子。一種常見的壓力源是熱,它會導致摺疊的蛋白質“變性”或解開。許多細胞在變得不舒服地溫暖時會產生熱休克蛋白,它可以充當分子伴侶,引導變性蛋白質回到其摺疊狀態。這很重要,不僅是為了使蛋白質正常工作,而且是為了防止未摺疊的蛋白質粘在一起形成粘稠的混亂。
但芝加哥大學的生物化學家D·艾倫·德拉蒙德認為,這種圖景總是有點不對勁。這意味著,如果細胞變得太熱並且需要製造熱休克蛋白,它們只有在損傷已經發生時才能感覺到。“這聞起來就不對勁,”他說。
相反,德拉蒙德懷疑細胞感知溫度——和其他形式的壓力——的方式是透過凝聚物形成。2017年,他和他的同事發現,酵母細胞中出現的應激顆粒,包含由一種稱為Pab1的RNA結合蛋白組成的凝聚物。當這種蛋白質被束縛在凝聚物中時,它會失去大部分結合編碼伴侶蛋白的信使RNA分子的能力,而伴侶蛋白是保護細胞免受熱休克所需的。
當研究人員將突變引入編碼Pab1的基因時,他們可以改變由此產生的蛋白質形成凝聚物的傾向,因此當變暖時,具有該突變的細胞表現不佳。因此,德拉蒙德認為,凝聚物形成——在特定閾值(例如,溫度)突然發生的相變——本身就是壓力感測器,它警告細胞問題並引發反應。“你將凝聚物新增到圖中,你徹底改變了你對此的思考方式,”他說。
對細胞的另一種常見威脅是DNA損傷,例如,由暴露於紫外線或環境毒素引起。阿爾貝蒂的研究小組發現,凝聚物可以充當超強膠水,將受損的DNA鏈固定在一起,同時酶修復它們。
長期以來,人們都知道DNA修復涉及一種稱為PARP1的蛋白質,在2024年初,阿爾貝蒂的團隊報告說,這種分子沿著DNA鏈移動,直到找到斷裂,然後它與DNA聚整合凝聚物,保護損傷免受細胞核其餘部分的侵害。“這種膠水非常牢固,”阿爾貝蒂說。然後,一種稱為FUS的蛋白質被摻入膠水斑點中並使其軟化,以便其他酶可以在凝聚物內工作,將鏈的末端重新連線在一起。由於DNA損傷對細胞可能是致命的,因此靶向癌細胞中PARP1並透過將膠水固定在其“固體”形式來阻止DNA修復的藥物可能會殺死它們。
組織複雜的生化過程和對應激的反應是凝聚物的兩個常見功能。帕普、他的同事戴一凡和他們的同事最近發現了另一個功能:凝聚物可以充當生化反應的催化劑,即使它們的組成蛋白質不充當催化劑。這是因為凝聚物在兩相之間建立了一個介面,從而在濃度上建立了一個梯度——例如,離子的濃度梯度,產生一個可以觸發反應的電場。研究人員已經證明了凝聚物誘導的廣泛生化反應的催化作用,包括涉及水解的反應(其中水將其他分子分裂開來)。
凝聚物也可能在生物學中最重要的過程之一中發揮作用:基因如何被調節以確定它們是否產生相應的蛋白質。在人類等複雜生物中,轉錄的初始過程——DNA中的基因被讀取以製造模板蛋白質的mRNA分子——是一個令人費解的複雜事件。它涉及許多參與者:基因本身以外的DNA區域,如增強子(通常位於鏈的相當遙遠的部分)、稱為轉錄因子的蛋白質(與DNA結合)、RNA製造酶等等。
所有這些成分如何聚集在一起並達成群體決策以調節轉錄仍然不清楚。“當我從物理學過渡到生物學時,”帕普說,“我會坐在那裡[在會議上]聽這些基因調控的演講——這激活了這個,這個招募了那個——我總是在想:‘這些分子是在互相打電話嗎?到底是怎麼回事?’”
似乎凝聚物狀聚集體可能是將這些成分聚集在細胞核DNA纏結中的原因。DNA鏈本身可能充當這種液滴的種子,就像大氣中的塵埃顆粒播撒雲滴的凝結一樣。這個斑點可以吸入DNA環上的遠處增強子區域,同時聚集所有其他需要的分子,並阻止它們漂移開來。
轉錄過程中的分子聚集比許多其他凝聚物中的分子聚集要小得多,並且很難在活細胞核內清楚地看到它們。因此,關於這種“轉錄中心”是否是真正的液滴,以及凝聚物形成是該過程的必要組成部分還是副作用,仍然存在爭議。德拉蒙德提出的另一種可能性是,所有這些分子一旦聚集到同一空間,就會組合成一個更有序的複合物來啟動轉錄,但它們的聚集也會產生凝聚物。
還有很多東西需要解開。“我告訴人們,我所知道的是,這些[轉錄]蛋白質真的想要相分離,”布蘭溫尼說。“我只是看不到另一種合理的模型。相分離是最簡約的解釋。”
蛋白質聚整合緻密的斑點似乎是生命運作方式的一個基本方面。但這個過程也有陰暗面。
長期以來,蛋白質纏結團塊一直與神經退行性疾病(如帕金森病和阿爾茨海默病)有關。這些固體狀結節,稱為澱粉樣蛋白,可能對細胞有毒並殺死神經組織。一些研究人員懷疑,這種有問題的蛋白質聚集體可能是由於對普遍存在的、短暫的凝聚物的不當控制而產生的,例如,由於基因突變以使其成分蛋白質易於凝結成長壽命固體腫塊的方式影響它們。
起初,研究人員的口頭禪是“液體好,固體壞”——但這顯然過於簡單化,因為健康的凝聚物具有一系列材料特性,其中可能包括固體狀。現在,真正區分“好”凝聚物和“壞”凝聚物的是該領域迫切需要解決的問題之一。
人們正在探索凝聚物與病理性澱粉樣蛋白之間可能的聯絡,以尋找治療神經退行性疾病的方法。反義寡核苷酸——可以與RNA結合的核酸短片段——可能被用來抑制與這些疾病相關的蛋白質的聚集。人們也在探索使用它們來停用形成凝聚物的RNA分子。
同樣,凝聚物(如核旁斑)在基因調控中的重要性意味著它們的失調可能導致各種疾病,包括癌症。現在,由初創公司Dewpoint Therapeutics(由海曼、麻省理工學院的生物學家理查德·揚和諾貝爾獎獲得者菲利普·A·夏普共同創立)和Nereid Therapeutics(建立在布蘭溫尼的工作基礎上)正在追求一個新興的凝聚物療法領域,這兩家公司都位於波士頓。“正在取得大量進展,”布蘭溫尼說。“凝聚物生物物理學現在正在將藥物推向臨床試驗。”
到目前為止,大多數注意力都集中在神經退行性疾病和癌症的治療上,但也正在努力透過凝聚物對抗病毒感染。一些病毒似乎“劫持”了形成凝聚物的蛋白質,以幫助它們複製——因此靶向這些凝聚物可能會阻止病毒。2021年,法國和中國的研究人員表明,一種使病毒誘導的稱為包涵體的凝聚物更固態化的藥物可以破壞人類呼吸道合胞病毒RSV的感染。
2023年,當布蘭溫尼和海曼因其工作獲得300萬美元的突破獎時,這無疑是凝聚物已經到來的訊號。“未來10年將會有很多很酷的東西,”阿爾貝蒂說。雖然關於生物分子凝聚物仍有許多問題,但在德拉蒙德看來,這些斑點是“我們一直期待的革命”。
似乎很奇怪,花了這麼長時間才認識到凝聚物的真實面目。至少部分答案是它們不符合已經流行了幾十年的分子生物學圖景。舊的正規化完全是關於分子如何透過選擇性相互作用(緊密編碼在其結構中)在細胞周圍傳遞資訊。凝聚物破壞了這種觀點。它們是鬆散的、短暫的和靈活的,它們表明細胞的許多關鍵過程是使用由數百名成員組成的分子委員會進行的。
施維勒懷疑,透過凝聚物實現分子組織可能在生命本身的起源中至關重要,那時核酸和蛋白質尚未進化到具有精確定義的結構。首先,它們展示了細胞樣區室如何透過液相分離從這些聚合生物分子的祖先中自發形成。
事實上,1929年,兩位荷蘭化學家報告了這樣的蛋白質斑點,他們稱之為凝聚層,幾年後,俄羅斯生物化學家亞歷山大·奧巴林將其稱為最早的原始“原生細胞”。施維勒說,這樣的區室透過將一些分子與其他分子隔離,可以建立濃度梯度,從而維持生物體在非平衡狀態下的生存。
帕普推測,在蛋白質本身能夠充當酶之前,催化凝聚物可能在這樣的原生生命實體中很重要。阿爾貝蒂說,未來的重大問題之一是進化隨後如何利用凝聚物。自然選擇的力量如何作用於所有分子參與者,以改變和調整它們形成凝聚物的能力?“研究它將會非常有趣,”阿爾貝蒂說。“你必須將進化生物學與物理學結合起來。”
然而,目前,凝聚物標誌著我們對生命如何在分子尺度上運作的理解進入了一個新階段。“我們現在意識到,[傳統的]生物化學和結構生物學不足以描述細胞中正在發生的事情,尤其是當我們處理涉及許多成分的過程時,”阿爾貝蒂說。我們需要了解所有這些成分如何協調它們的相互作用,以創造出作為統一實體的細胞。
這些斑點揭示了一個重要的尺度,協調發生在這個尺度上:介於多組分複合物(如染色體)的大小和整個細胞的大小之間。這是一個分子不再像精密的小機器一樣工作,而是聚集到一種物質實體中的尺度,這種實體受相變的集體物理學支配,但仍然對它們的分子成分的細節敏感。我們尚不清楚支配這些尺度上發生的事情的規則。但比以往任何時候都更清楚的是,生命依賴於它們。