加利福尼亞大學舊金山分校的微生物學家 Joe Bondy-Denomy 回憶說,這一切最初都像“有點愚蠢的事情”。在 2010 年代初的研究生期間,他試圖用病毒感染細菌,而從理論上講,這些病毒不應該有機會存活。他知道這些病毒,或噬菌體,很容易受到 CRISPR-Cas 細菌防禦系統的攻擊,科學家們已經利用該系統作為強大的基因編輯工具。在大多數情況下,他是對的:CRISPR 機制將入侵的噬菌體切成碎片。但在少數情況下,出乎意料的是,入侵者倖存了下來。
Bondy-Denomy 認為他搞砸了。“然後靈光一閃,”他說。也許細菌基因組內的某些東西正在解除其防禦。也許這種自我破壞的 DNA 片段來自以前的病毒入侵者。
DNA 序列的快速比較證明了 Bondy-Denomy 的直覺是正確的。巢狀在細菌基因組內的噬菌體基因完全關閉了 CRISPR-Cas 系統,使細菌變得脆弱1。
支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您正在幫助確保未來能夠繼續刊登關於塑造當今世界的發現和想法的有影響力的故事。
“Joe 得到了改變一切的結果,”多倫多大學的噬菌體生物學家 Alan Davidson 說,他當時是 Bondy-Denomy 的博士生導師。“他發現了一些我們從未期望過的驚人事物。”
Bondy-Denomy 與 Davidson、微生物學家 Karen Maxwell 和研究生 April Pawluk 一起,偶然發現了一種現在被稱為反 CRISPR 的工具。這些蛋白質就像 CRISPR 分子剪刀的石頭。很快,它們就無處不在:現在已經表徵了 50 多種反 CRISPR 蛋白,每種蛋白都有其自身阻斷 CRISPR 系統剪下和貼上作用的方法。
龐大的名單引發了許多關於細菌與其捕食者噬菌體之間古老軍備競賽的問題。但它也為科學家提供了一個工具包,用於控制基因編輯。
來源:《自然》
有些人正在使用這些蛋白質作為開關,以更精細地控制 CRISPR 系統在生物技術或醫學基因編輯應用中的活性。其他人正在測試它們或其他 CRISPR 阻斷分子是否可以作為最後手段的生物安全對策,能夠控制某些基因組編輯的生物武器或失控的基因驅動。
“對於您能想到的任何關閉 CRISPR 系統的理由,反 CRISPR 蛋白都能發揮作用,”華盛頓州西雅圖弗雷德·哈欽森癌症研究中心的微生物基因組學家 Kevin Forsberg 說。
然而,儘管實驗室中提出了越來越多的應用和概念驗證實驗,但研究人員尚未確定這些反 CRISPR 系統的治療潛力。加利福尼亞大學伯克利分校的生物化學家、CRISPR 基因編輯的先驅之一 Jennifer Doudna 提出了一個她說每個人都在關注的問題:“您實際上如何以提供有意義的控制的方式使用這些系統?”
“這當然是整個反 CRISPR 領域需要發展的方向,”她說。“只是還沒有發展到那裡。”
一切混亂爆發
儘管人們越來越關注反 CRISPR 蛋白——2019 年每週大約發表一篇關於該主題的論文——但 Davidson 和他的學生最初的發現卻鮮為人知。
對於大多數科學家來說,這似乎是進化戰爭的一個深奧的例子——特別是考慮到發現的反 CRISPR 蛋白都只針對一種特定形式的細菌防禦,即 I 型 CRISPR 系統。基因組編輯的寵兒一直是 II 型系統及其典型的 DNA 切割蛋白 Cas9。
“為了讓更廣泛的生物學界真正注意到,”現在是 Cell 編輯的 Pawluk 說,“它必須是 Cas9”。
2016 年 12 月,仍在 Davidson 實驗室工作的 Pawluk 和領導自己獨立研究小組的 Bondy-Denomy 各自鑑定出 Cas9 酶的抑制劑 2,3。這一次,世界各地的研究人員都抓住了這些發現。“就像 CRISPR 世界中的其他一切一樣,楔子的薄邊開始進入,然後您就知道一切混亂都爆發了,”馬薩諸塞大學醫學院的分子生物學家 Erik Sontheimer 說,他是 Pawluk 論文 2 的合著者。
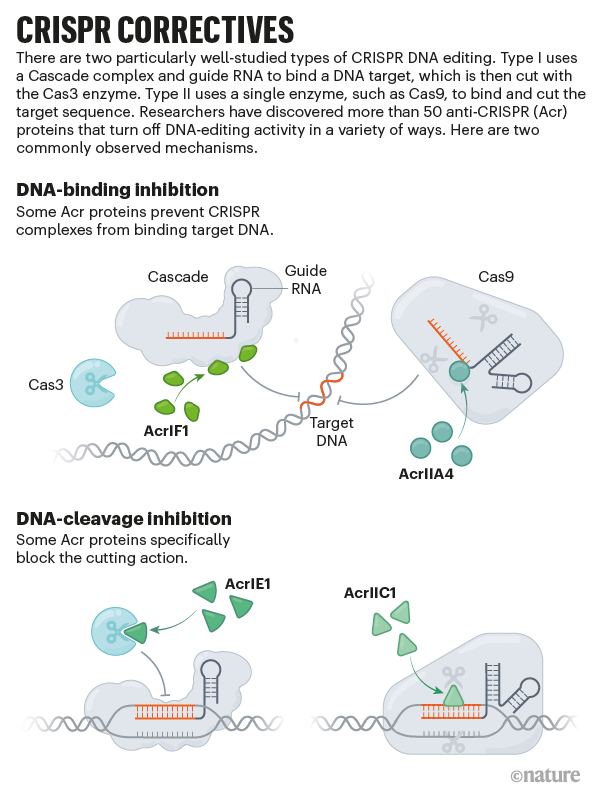
不到三個月,中國哈爾濱工業大學的結構生物學家就破譯了 Bondy-Denomy 的反 CRISPR 蛋白之一 AcrIIA4 關閉 Cas9 活性的分子機制 4(參見“CRISPR 校正”)。幾個月後,Doudna 與 Bondy-Denomy 和生物化學家 Jacob Corn(現任職於蘇黎世瑞士聯邦理工學院)合作,首次證明了反 CRISPR 蛋白具有實際價值:他們表明,將 AcrIIA4 與 Cas9 一起或緊隨其後遞送到人體細胞中,可以阻止基因編輯活動 5。
這很有用,因為如果 Cas9 保持活性時間過長,就會增加意外編輯的風險。Doudna 和她的合作者報告說,反 CRISPR 蛋白可以限制“脫靶”效應,自從 CRISPR 早期發展以來,研究人員和投資者一直對此感到擔憂。
總部位於伯克利的 Acrigen Biosciences 執行長兼與 Bondy-Denomy 的聯合創始人 David Rabuka 說,抑制脫靶活性將對 CRISPR 治療領域做出重大貢獻。該公司的宣傳語是:“我們將使基因編輯更高效、更安全,”Rabuka 說。
反 CRISPR 蛋白還可以幫助將編輯活動限制在體內的特定細胞和組織中。2019 年,德國、日本和美國的研究團隊各自獨立地嘗試將這些蛋白質與稱為 microRNA 的小調控分子串聯使用,以實現組織特異性編輯 6-8。由 Sontheimer 領導的美國團隊甚至表明,該方法可以在小鼠身上起作用——他們是迄今為止唯一發表的研究,證明反 CRISPR 蛋白可以在活體動物中起作用,而不僅僅是細胞 8。
Sontheimer 和他的同事希望允許在肝臟中進行編輯,同時抑制其在小鼠所有其他組織中的編輯。因此,他們設計了一種反 CRISPR 蛋白,該蛋白在除 microRNA-122 存在的情況下外都具有活性,microRNA-122 僅在肝臟中發現。在小鼠中,反 CRISPR 成功阻止了 Cas9 在全身的編輯,除了肝臟這個器官。
儘管該論文側重於肝臟定向編輯,但該平臺是“即插即用”的,Sontheimer 說:任何產生高表達水平的獨特 microRNA 的器官都可以透過這種方式靶向,前提是反 CRISPR 蛋白不會引發不良的免疫反應。
並非沒有挑戰的免疫
由於以前接觸過攜帶 CRISPR-Cas 系統的微生物,許多人的免疫系統已經準備好攻擊和停用 Cas9 蛋白。這可能會構成挑戰。在小鼠中,僅一劑基於 CRISPR 的藥物就可能引發足夠強的免疫反應,從而使後續治療無效。
Sontheimer 認為,反 CRISPR 蛋白可能容易出現相同的排斥問題,可能會危及該技術並引發患者危險的炎症反應。
其他型別的 CRISPR 抑制劑不應有相同的限制。去年 5 月,由馬薩諸塞州劍橋市麻省理工學院和哈佛大學博德研究所的化學生物學家 Amit Choudhary 領導的一個團隊描述了一種識別能夠破壞 Cas9 活性的小分子藥物的新方法 9。他的團隊鑑定的化合物不如天然反 CRISPR 蛋白有效,但它們更可能偷偷繞過免疫系統,穿過細胞屏障,並允許對 Cas9 活性進行可逆控制。
在其他地方,研究人員設計了短鏈核酸,這些核酸抓住 Cas9 複合物的兩個部分,並完全關閉人體細胞中的基因編輯 10。“我們非常肯定我們擁有的東西比目前所有最好的反 CRISPR 蛋白都更好,”南伊利諾伊大學卡本代爾分校的 RNA 生物化學家 Keith Gagnon 說,他領導了這項研究。包括加利福尼亞州利弗莫爾市桑迪亞國家實驗室的病毒學家 Brooke Harmon 領導的其他小組也合成了微小的蛋白質片段,這些片段顯示出作為反 CRISPR 劑的潛力。“有很多不同的選擇很好,”Harmon 說。
這種多樣性在醫學應用中可能很重要:例如,限制基因靶向藥物的編輯活性,或設計能夠消滅難以治療的細菌的噬菌體療法,而不會受到病原體自身 CRISPR 防禦的阻礙。它也可能有助於 CRISPR 阻斷技術的其他擬議應用。
以基因驅動系統為例,科學家們在其中部署 CRISPR 基因編輯,以將 DNA 修飾迅速傳播到整個人群中。一些公共衛生官員希望該技術可能完全根除攜帶疾病的蚊子或蜱蟲,例如。
但對不可預見的生態影響的擔憂比比皆是。許多政府官員和研究人員也擔心基因驅動被武器化以消滅農業系統或傳播致命疾病。
桑迪亞生物化學家 Joe Schoeniger 說,反 CRISPR 蛋白可以為這些潛在的生物攻擊提供分子安全網。“您需要有一個關閉按鈕,”他說。
目前,此類應用大多是假設性的。唯一發表的研究報告是研究人員使用反 CRISPR 蛋白來抑制酵母中的基因驅動 11。然而,這個想法正在獲得關注,包括希望透過迫使有害基因在整個蚊子種群中傳播來阻止瘧疾傳播的研究人員。
倫敦帝國理工學院的分子寄生蟲學家 Andrea Crisanti 說,他已經使用反 CRISPR 基因來阻止蚊子根除基因驅動系統。這種基因驅動會破壞雌性生育能力,可以在大約十代內消滅實驗室中的蚊子 12。但在未發表的工作中,他的團隊在混合物中添加了反驅動蚊子,“它們可以完全 100% 阻止驅動,”Crisanti 說。“我們可以阻止人口崩潰。”
保險單
當 Crisanti 展望他的絕育策略的實地測試時,他想象著準備好裝有反驅動蚊子的籠子,以防萬一出現問題。“這有點像購買保險,”他說。
但對 CRISPR 控制的需求不僅僅限於基因驅動。“如果在臨床試驗中發生不良事件或基因組編輯器的不正當使用,我們只有在發生時才會知道那是什麼樣子,”美國政府國防高階研究計劃局 (DARPA) 位於弗吉尼亞州阿靈頓的生物安全科學家 Renee Wegrzyn 說。
這就是為什麼 DARPA 在 2017 年啟動了“安全基因”計劃,這是一項為期四年、耗資 6500 萬美元的計劃,旨在應對 CRISPR 技術的危險。這包括髮現針對所有型別 CRISPR-Cas 系統的新抑制劑,並找到以獨特和有用的方式發揮作用的反 CRISPR 蛋白。Bondy-Denomy、Choudhary、Crisanti、Doudna 和 Sandia 團隊等都是這項基金的獲得者。
除了其生物技術應用外,反 CRISPR 策略也為基礎研究開闢了新的可能性。“它已成為我們最喜歡的工具之一,”紐約市哥倫比亞大學醫學中心的神經表觀遺傳學家 Shawn Liu 說。Liu 研究了一種改良的 CRISPR-Cas9 系統如何透過表觀遺傳修飾(即不改變基礎序列)改變基因的表達水平。反 CRISPR 蛋白幫助他展示了效果持續了多久 13。
當研究人員尋找能夠比標準菌株更有效地抵禦噬菌體攻擊的細菌突變株時,它們也派上了用場。由加拿大魁北克市拉瓦爾大學的噬菌體生物學家 Sylvain Moineau 領導的一個團隊專注於嗜熱鏈球菌,這是一種用於製作乳酪和酸奶的微生物 14:“我們使用含有反 CRISPR 蛋白的噬菌體作為工具來尋找其他防禦機制,”他解釋說。
其他科學家正在將反 CRISPR 蛋白納入生物感測器等工具中,這些工具可以跟蹤治療性基因編輯器在細胞內有多少活性,以及允許研究人員透過輕 flick 雷射束開啟 Cas9 基因組靶向的光遺傳學控制策略。
“其中很多仍處於‘玩具’系統階段,”德國維爾茨堡亥姆霍茲 RNA 感染研究研究所的生物工程師 Chase Beisel 說。“但至少概念是存在的。”
未決問題
隨著生物工程師繼續修補反 CRISPR 蛋白,以及 Acrigen 等公司開始將抑制劑引入治療平臺,一些生物學家也開始努力解決關於 CRISPR-Cas 系統最初進化的更深層問題。如果具有完整 CRISPR 保護的細菌通常攜帶噬菌體衍生的抑制劑序列來中和這種免疫力,那麼“CRISPR 顯然在許多情況下沒有發揮其防禦作用”,英國埃克塞特大學研究 CRISPR 系統生態學的 Edze Westra 說。然而,自然選擇似乎保持系統正常執行。因此,他問道,“除了為生物技術初創公司提供資金外,它的作用是什麼?”
一些研究表明,細菌使用 CRISPR-Cas 系統形成生物膜、修復 DNA 和進行其他參與增強毒力的調控過程。多倫多大學微生物學家 Maxwell 說,一旦反 CRISPR 蛋白消除了 Cas 酶的 DNA 切割能力,細菌就可能已將基因編輯器重新用於其他用途。
這些令人困惑的謎團不會阻止 CRISPR 基因編輯穩步邁向人類療法、害蟲控制等領域。對於許多人來說,這就是反 CRISPR 蛋白如此重要的原因。
“需要進行這種轉變,以真正控制這些編輯器,以確保您獲得所需的更改,而不會發生其他任何情況,”Doudna 說。她指出,正如開啟生物技術革命的 CRISPR-Cas 系統始於實驗室中的一些好奇的觀察一樣,抑制劑的發現也始於此,這可能是一種急需的糾正措施。
本文經許可轉載,並於2020 年 1 月 15 日首次釋出。