1907年,德國精神病學家阿洛伊斯·阿爾茨海默發表了一份關於一種影響大腦皮層的不尋常疾病的病例報告。一位居住在美因河畔法蘭克福一家精神病院的51歲婦女表現出的症狀,對於數百萬受如今被稱為阿爾茨海默病影響的家庭來說,都太熟悉了。症狀包括記憶喪失、意識模糊和迷失方向。
患者去世後,阿爾茨海默檢查了她的大腦,並做出了一些關鍵觀察。首先,它比平均水平小,或稱萎縮,並伴有相應的神經元損失。其次,神經元內部存在蛋白質纖維纏結,腦細胞外部存在另一種蛋白質沉積。在接下來的100年中,這兩種病理性蛋白質——被稱為 tau 蛋白和澱粉樣蛋白——一直是阿爾茨海默病病因研究的重點。
但阿爾茨海默在屍檢中注意到一個額外的、經常被遺忘的線索。在顯微鏡鏡頭下,他看到了某些非神經元細胞結構組成的明顯變化。這些細胞被稱為神經膠質細胞,約佔大腦細胞的一半。
支援科學新聞事業
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞事業: 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們當今世界的發現和思想的具有影響力的故事的未來。
自阿爾茨海默發現以來,神經膠質細胞僅受到少數科學家的研究,現在已成為關注焦點。其中一種稱為小膠質細胞的細胞是大腦中主要的免疫細胞型別,可能在疾病的早期和晚期以不同的方式影響疾病的進展。小膠質細胞也可能解釋澱粉樣蛋白和 tau 蛋白之間複雜的關係,這兩種異常蛋白會導致神經元退化和記憶喪失。
過去十年的研究已經確定了新的分子風險因素,這些因素表明這些大腦免疫細胞與阿爾茨海默病有關。在強大的基因測序方法的指導下,我們開始瞭解小膠質細胞以及免疫系統及其炎症過程在阿爾茨海默病中的作用。
儘管我們已經瞭解了很多關於 tau 蛋白和澱粉樣蛋白的生物化學,以及一些可能影響一個人患阿爾茨海默病風險的遺傳和生活方式因素,但幾乎沒有可以阻止或減緩疾病進展的治療方法。6 月 7 日,美國食品和藥物管理局批准了一種新藥 aducanumab,它可以清除大腦中的澱粉樣蛋白。但尚不清楚它在改善患者日益衰退的認知技能方面的效果如何。仍然需要更多的干預措施。最近關於小膠質細胞的見解提出了潛在的阿爾茨海默病新療法,目前正在開發幾種療法,其中一些已經進入臨床試驗階段。
斑塊、纏結和基因
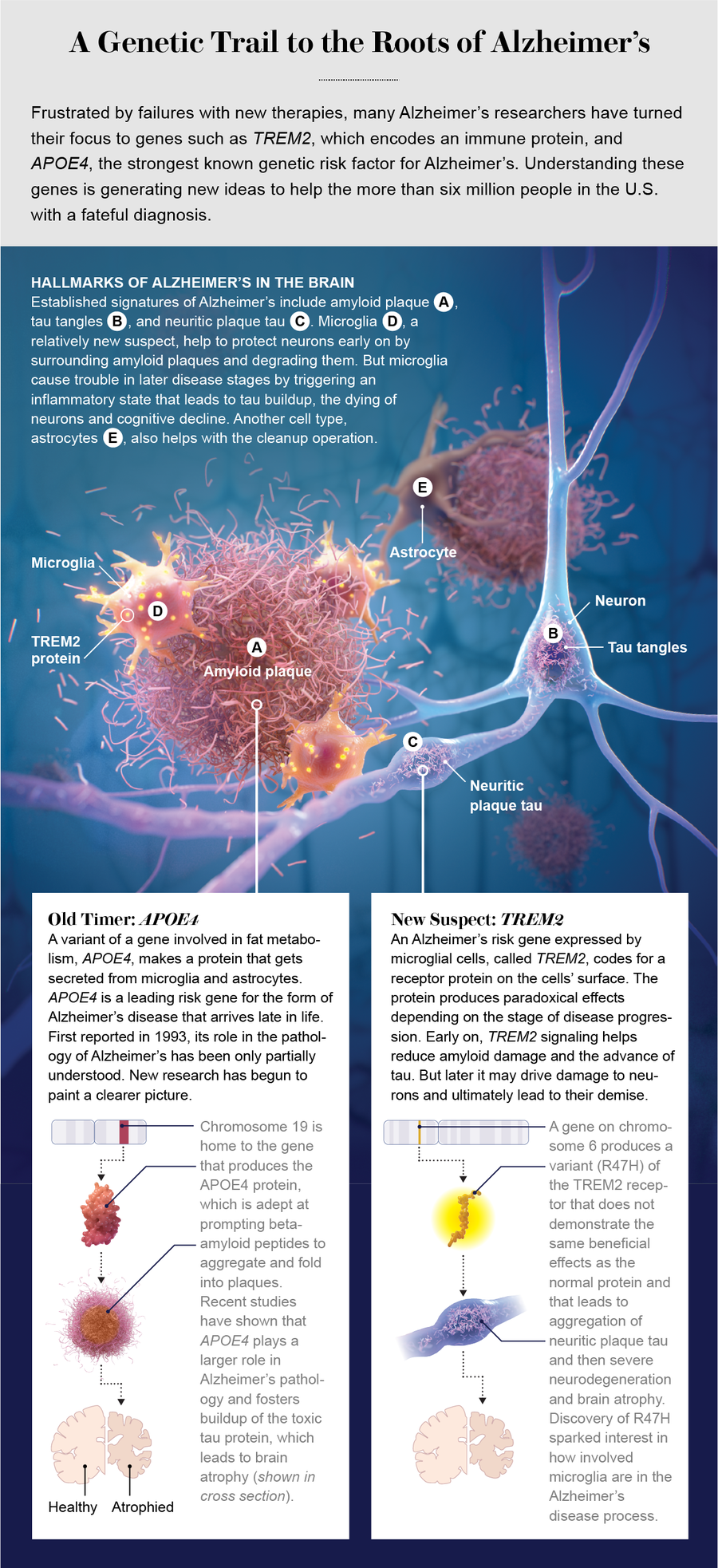
阿爾茨海默病是全球痴呆症的主要原因,其多種病理會在數十年內積累和匯聚。阿爾茨海默病有兩個獨特的分子特徵。第一個是斑塊,由一種稱為 β-澱粉樣蛋白的澱粉樣蛋白組成。這些肽,或小蛋白質,存在於細胞之間的空間中。
第二個是 tau 蛋白的扭曲或錯誤摺疊形式,大量的磷酸基團附著在其上,這個過程稱為過度磷酸化。tau 蛋白磷酸化的增加與蛋白質聚集和毒性的增加有關。tau 蛋白以扭曲的團塊形式存在於神經元的細胞體中,稱為神經原纖維纏結。一些 tau 蛋白也會出現在澱粉樣蛋白斑塊附近腫脹、受損的軸突中,軸突是從神經元主體延伸出來的長突起。這種形式被稱為神經炎性斑塊 tau 蛋白。
tau 蛋白和澱粉樣蛋白的較大前體蛋白在細胞功能中都具有正常作用,但在阿爾茨海默病患者的疾病過程中會被破壞。為了解澱粉樣蛋白和 tau 蛋白的病理形式所做的廣泛努力,使我們得出結論,我們應該將阿爾茨海默病分為兩個階段。第一階段是 15 至 25 年的症狀前階段,在此期間澱粉樣蛋白在大腦最外層大腦皮層中積聚,但沒有認知症狀。在第二階段,tau 蛋白纏結在大腦皮層中發展,神經退化開始,隨著腦細胞死亡,認知功能障礙出現。
阿爾茨海默病研究界已經知道幾十年了,遺傳風險因素強烈影響一個人患阿爾茨海默病的可能性,基因為理解疾病的潛在機制提供了寶貴的見解。與阿爾茨海默病相關的最主要風險基因是 APOE。它編碼載脂蛋白 E,該蛋白參與脂肪和膽固醇代謝。(基因的字母數字名稱通常用斜體表示,而它們編碼的蛋白質的名稱則以常規文字形式呈現。)
該基因與阿爾茨海默病的關聯,最早於 1993 年報道,與該基因的一個版本有關,稱為等位基因,它會顯著增加患病風險。人類群體中三種常見的 APOE 等位基因是 APOE2、APOE3 和 APOE4。APOE3 是最常見的,約佔所有等位基因的 78%,其次是 APOE4,約佔 14%,APOE2 約佔 8%。每個人都有兩個 APOE 等位基因,約 25% 的人攜帶至少一個 APOE4 等位基因。但在阿爾茨海默病患者中,約 60% 的人攜帶至少一個 APOE4 等位基因。
攜帶單個 APOE4 等位基因的人患阿爾茨海默病的風險增加三到四倍,而攜帶兩個 APOE4 副本的個體患病風險比攜帶兩個 APOE3 等位基因的人高約 12 倍。APOE4 攜帶者更早且更大量地沉積澱粉樣蛋白斑塊,因為他們的載脂蛋白 E 版本會減少 β-澱粉樣蛋白從大腦中的清除,並促進蛋白質的聚集。相反,APOE2 攜帶者患阿爾茨海默病的風險較低,並且不太可能發展出澱粉樣蛋白病理。
儘管 APOE4 的影響很強,但它並不能解釋阿爾茨海默病的所有遺傳易感性。遺傳學家一直在不懈地尋找可能解釋這種“缺失的遺傳性”的其他風險因素,利用基因測序技術的進步來篩查數千人 DNA 的變化,這些變化與患阿爾茨海默病風險的升高或降低有關。
大規模篩查已經確定了似乎影響疾病風險的遺傳區域和基因。其中包括基因變異體——CD33、BIN1、CR1 和 MS4A6A——它們編碼具有各種功能的蛋白質。例如,CD33 和 CR1 為細胞表面的受體提供遺傳指令,這些受體檢測來自其他細胞的訊號。透過人群篩查發現的這些基因對疾病風險的影響相對較小。
研究人員還對數千名阿爾茨海默病患者的基因組進行了測序,以尋找可能對疾病風險產生強烈影響的罕見變異。其中一些風險基因主要由小膠質細胞表達,小膠質細胞是大腦中主要的免疫細胞。2013 年,兩項研究確定了 TREM2 中的一種罕見變異,TREM2 是一種編碼穿過小膠質細胞膜的受體的基因,該變異會顯著增加患阿爾茨海默病的風險。
測序資料揭示了一種變異,該變異用稱為組氨酸的氨基酸取代了精氨酸。發現這種突變會損害小膠質細胞的功能,並將患阿爾茨海默病的風險增加約兩到四倍。有趣的是,與其他幾種新的風險因素基因一樣,TREM2 僅在大腦中的小膠質細胞中表達。這些遺傳線索表明,小膠質細胞可能積極地參與疾病過程,但如何參與呢?
監視小組
小膠質細胞與稱為巨噬細胞的免疫細胞有關,巨噬細胞在體內巡邏以對抗病原體或幫助修復受損組織。研究人員正在瞭解到,它們參與從抵抗感染到修剪發育中的大腦中多餘的突觸(神經元相遇的連線點)的方方面面。在正常情況下,小膠質細胞具有小的細胞體,其分支狀突起延伸遍佈腦組織。這些免疫細胞吞噬——或更正式地說,是胞吞作用——不需要的突觸和碎片,並尋找損傷或病原體入侵的跡象。
如果確實發生損傷,小膠質細胞的形狀和功能會發生變化。細胞體變大,從細胞體延伸出的分支變短且數量減少。小膠質細胞遷移到損傷部位以啟動炎症反應。幾十年來,研究人員觀察到澱粉樣蛋白斑塊周圍的小膠質細胞。然而,尚不清楚它們是幫助限制澱粉樣蛋白的積累,還是啟動有毒的炎症。小膠質細胞和 tau 蛋白之間的關係也知之甚少。
一些研究表明,小膠質細胞作用於神經元以損害軸突和突觸,阻礙沿軸突傳輸的訊號,並導致細胞中 tau 蛋白的積累。
其他研究表明,小膠質細胞分泌的稱為細胞因子的炎症蛋白顯著增加了過度磷酸化的破壞性過程。TREM2 和 CD33 等遺傳風險因素的發現指出了小膠質細胞中可能與阿爾茨海默病有關的不同分子。研究人員希望瞭解這些蛋白質的功能將有助於深入瞭解這些細胞在疾病過程中發揮的更廣泛的作用。
致謝:AXS 生物醫學動畫工作室
實驗小鼠是研究遺傳因素如何影響人類阿爾茨海默病痴呆症中觀察到的大腦變化的寶貴工具。到目前為止,很少有實驗動物能夠重現阿爾茨海默病的所有方面(例如,澱粉樣蛋白斑塊積聚,然後是病理性 tau 蛋白的擴散以及伴隨的神經退化的小鼠)。但研究人員已經建立了數十個“模型”——基因工程小鼠,它們會發展出澱粉樣蛋白斑塊或 tau 蛋白。
透過將這些轉基因小鼠與經過基因工程改造以表達阿爾茨海默病風險基因改變的小鼠雜交,研究人員可以確定基因變異如何影響阿爾茨海默病樣病理的不同方面。例如,二十年前,經過基因工程改造以表達人 APOE4 蛋白的澱粉樣蛋白小鼠模型被證明比具有 APOE3 或 APOE2 基因變異的小鼠發展出更多的澱粉樣蛋白斑塊。近年來,研究人員透過刪除澱粉樣蛋白病理小鼠模型中的 Trem2 基因,評估了人 TREM2 蛋白在阿爾茨海默病中的作用。幾個實驗室一致地發現,在這些小鼠中,澱粉樣蛋白斑塊周圍的小膠質細胞數量急劇減少。
聖路易斯華盛頓大學馬可·科隆納實驗室的一系列研究發現,在沒有 Trem2 基因的小鼠中,小膠質細胞無法適當地提高其新陳代謝。當靠近澱粉樣蛋白斑塊時,它們沒有產生足夠的腺苷三磷酸 (ATP),ATP 是一種為細胞活動提供能量的分子。由於能量匱乏,細胞無法包圍澱粉樣蛋白斑塊。然後,研究人員觀察到腫脹的、受損的軸突增加,稱為營養不良性神經突觸,這是由澱粉樣蛋白造成的損害引起的。
這些關鍵觀察結果——斑塊周圍的小膠質細胞較少以及軸突損傷增加——也在患有阿爾茨海默病且具有 TREM2 基因罕見突變(稱為 R47H,即 2013 年發現的突變)的人的死後腦切片中觀察到。這一發現增強了人們的信心,即在小鼠中觀察到的結果可能與 TREM2 在人體中的作用有關。此外,耶魯大學傑米·格魯岑德勒小組的工作表明,包圍斑塊的小膠質細胞越少,附近軸突受到的損害就越大。
該研究進一步證明了小膠質細胞在保護區域性區域免受斑塊周圍澱粉樣蛋白毒性作用的潛在作用。它還表明,小膠質細胞與微小的澱粉樣蛋白纖維末端相互作用,可能阻止其生長或保護周圍神經元免受澱粉樣蛋白的不良影響。
有毒種子
如果小膠質細胞保護軸突免受澱粉樣蛋白斑塊損害,它們是否也能防止 tau 蛋白病理?如果是這樣,危險的 TREM2 突變(如 R47H)可能會使神經炎性斑塊 tau 蛋白更容易在澱粉樣蛋白斑塊附近發展,從而加劇阿爾茨海默病病理。檢驗這一假設仍然具有挑戰性,但一些線索來自探索 tau 蛋白病理如何像朊病毒一樣傳播的研究,朊病毒是克雅氏病等疾病的特徵,其中一種形式與“瘋牛病”有關。
在過去十年左右的時間裡,研究人員發現 tau 蛋白和澱粉樣蛋白摺疊成類似於朊病毒樣“種子”的異常形狀,然後導致正常結構的蛋白質也發生錯誤摺疊。透過這種方式,病理性 tau 蛋白可以隨著阿爾茨海默病的進展傳播到相連的腦區。賓夕法尼亞大學弗吉尼亞·曼-伊·李實驗室發表的一系列論文表明,將從阿爾茨海默病病理大腦中分離出來的聚集 tau 蛋白種子注射到正常小鼠大腦中,會導致小鼠 tau 蛋白錯誤摺疊成神經原纖維纏結。已經患有澱粉樣蛋白病理的小鼠發展出神經炎性斑塊 tau 蛋白,即損害軸突形式的蛋白質。後一個過程類似於阿爾茨海默病中的一系列事件。儘管小鼠沒有發生明顯的神經退化,“播種”方法為研究澱粉樣蛋白和 tau 蛋白病理提供了一種可靠的方法。
當 tau 蛋白不參與阿爾茨海默病病理時,它通常位於神經元的軸突中,在那裡它有助於穩定稱為微管的結構蛋白,微管有助於將細胞物質從神經元的一部分運輸到另一部分。李的團隊發現,澱粉樣蛋白斑塊附近腫脹軸突中的 tau 蛋白與微管脫離,使其可能更容易發生扭曲。本質上,這些受損的軸突變成了肥沃的土壤,周圍富含澱粉樣蛋白皮層的病理性 tau 蛋白種子可以在其中生根發芽。
由於小膠質細胞上具有破壞性的 R47H 突變型 TREM2 蛋白會增加軸突損傷,我們推斷,更常見的 TREM2 形式可能有助於免疫細胞遮蔽澱粉樣蛋白斑塊附近的軸突,防止 tau 蛋白種子刺激進一步的 tau 蛋白積累或侵入大腦皮層的其他區域。在我們實驗室當時的成員謝麗爾·萊恩斯和莫德·格拉圖茲領導的一項研究中,我們將來自阿爾茨海默病大腦的 tau 蛋白種子注射到表達和不表達功能性 TREM2 蛋白基因的小鼠模型中,發現沒有該蛋白的小鼠在腫脹的軸突中發展出更多的神經炎性斑塊 tau 蛋白。這種損害透過相連神經元的網路傳播到大腦的其他區域。
我們還使用了科隆納開發的小鼠模型,該模型表達正常人 TREM2 或 R47H 形式。同樣,當注射 tau 蛋白種子時,具有 R47H 變異的澱粉樣蛋白小鼠模型在澱粉樣蛋白斑塊附近發展出更多的神經炎性斑塊 tau 蛋白病理。為了證實來自小鼠模型的發現,我們還檢查了人腦,發現患有阿爾茨海默病相關 TREM2 變異的人有更多的神經炎性斑塊 tau 蛋白。從這些觀察結果中,我們得出結論,正常 TREM2,或許還有一般的小膠質細胞,可以防止澱粉樣蛋白誘導的 tau 蛋白播種和tau 蛋白在大腦中的擴散。
在阿爾茨海默病第一階段典型的富含澱粉樣蛋白的皮層中,小膠質細胞似乎可以防止 tau 蛋白病理的擴散。但是,一旦神經原纖維纏結在大腦皮層中發展並且神經退化在疾病的症狀期開始,它們是否仍然具有保護作用?兩項有影響力的研究——一項來自以色列雷霍沃特魏茨曼科學研究所伊多·阿米特實驗室,另一項來自布萊根婦女醫院奧列格·布托夫斯基及其同事——研究了不同神經退行性疾病小鼠模型中小膠質細胞基因活性的變化,並發現了這些基因如何被啟用的顯著相似之處。
他們發現,在具有類似於 tau 蛋白病理發生的神經退行性損傷的小鼠大腦中,小膠質細胞開啟了多種基因,其中許多基因編碼用於降解細胞中不需要物質的蛋白質。此時,小膠質細胞強烈增加了小鼠版本 APOE4 風險基因的表達。看來 APOE 和 TREM2 在決定神經元開始死亡和症狀首次出現時是否啟用小膠質細胞反應方面都起著關鍵作用。
這一發現促使我們將表達不同版本人 APOE 的小鼠與同時發展出 tau 蛋白病理和嚴重神經退化的小鼠模型雜交。在我們聖路易斯華盛頓大學實驗室楊石領導的一項研究中,我們發現表達 APOE4 的 tau 蛋白小鼠模型比 APOE3 或 APOE2 小鼠具有更多的神經退化和更晚期的 tau 蛋白病理。接下來,我們評估了患有阿爾茨海默病或其他具有大量 tau 蛋白積累的神經退行性疾病的人的細胞死亡情況。我們發現,APOE4 攜帶者比攜帶其他等位基因的人遭受更大的大腦損傷。
此外,APOE4 攜帶者的阿爾茨海默病患者比非 APOE4 攜帶者的患者病情惡化得更快。這對我們和其他研究人員來說是一個驚喜,因為多年來,人們一直認為 APOE4 的主要作用是大量澱粉樣蛋白的積累。然而,這些研究表明,APOE4 不僅在調節澱粉樣蛋白病理中發揮作用,而且還在決定神經元對 tau 蛋白病理反應的死亡速度中發揮作用。這意味著“阿爾茨海默病基因”(APOE4 的別稱)不僅影響澱粉樣蛋白沉積,還影響因 tau 蛋白積累而導致的神經損傷,這兩個是主要的疾病階段。
對 APOE4 不斷深入的瞭解促成了下一個小鼠實驗。我們發現,刪除小鼠版本的 APOE 基因對神經退化具有很強的保護作用,並延緩了 tau 蛋白病理的進展——更重要的是,延緩了 tau 蛋白積累引起的大腦損傷。如果刪除 APOE 基因在小鼠模型中具有神經保護作用,那麼或許降低人腦中 APOE 水平可以減緩神經退化,尤其是在攜帶 APOE4 變異的人中。
在另一項實驗中,我們使用了 tau 蛋白小鼠模型,該模型也表達人 APOE4,以測試降低載脂蛋白變異體的水平是否可以防止神經退化。我們與 Ionis Pharmaceuticals 合作,使用反義寡核苷酸(修飾 DNA 的短片段,可以降解信使 RNA(細胞製造特定蛋白質的分子指令)),將小鼠大腦中 APOE4 的含量降低一半。我們發現,當 tau 蛋白病理開始紮根時,降低 APOE4 水平可以保護神經元,並減少小鼠大腦中的炎症和小膠質細胞啟用。
一個新興的圖景表明,小膠質細胞在阿爾茨海默病痴呆症的進展過程中發揮著兩種不同的作用。在澱粉樣蛋白病理的小鼠模型中,斑塊周圍小膠質細胞活性的增加似乎可以保護大腦。在 tau 蛋白病理的小鼠中,異常 tau 蛋白強烈增加了與神經退化相關的小膠質細胞基因的表達,而 APOE4 似乎進一步加劇了大腦的炎症。所有這些都表明小膠質細胞對 tau 蛋白病理產生了強烈的免疫反應,這種反應與損害的增加有關,而不是對大腦的保護。
當然,相關性並不等同於因果關係,在我們研究的那個階段,尚不清楚在表達 APOE4 的 tau 蛋白模型中觀察到的強烈免疫反應是驅動了退化,還是僅僅是對退化的一種反應。接下來,我們詢問小膠質細胞表面受體 TREM2 的缺失是否會增加大腦中的神經退化和炎症。如果小膠質細胞有助於保護神經元,即使在疾病的相對晚期,這也不會完全令人驚訝。
再一次,降低基因活性的實驗正在進行中。敲除 tau 蛋白小鼠模型中的 TREM2 降低了小膠質細胞的反應,並降低了神經退化水平。這一發現表明,降低小膠質細胞活性導致 tau 蛋白病理造成的損害和腦萎縮減少。
雙刃劍
更多證據表明,小膠質細胞是導致疾病後期認知能力下降的神經元損失的驅動因素,這些證據來自 2019 年的兩項研究。給小鼠服用一種阻斷關鍵蛋白集落刺激因子 1 的藥物,這種蛋白是小膠質細胞生存所必需的,結果表明可以去除大腦中約 90% 的小膠質細胞。在 tau 蛋白小鼠模型中,接受該藥物的小鼠表現出 tau 蛋白病理和神經退化顯著減少,這表明小膠質細胞是 tau 蛋白依賴性神經退化所必需的。這些發現表明,TREM2 訊號傳導似乎會產生矛盾的影響——保護性或有害性——具體取決於疾病進展的階段。
從這項研究來看,TREM2 訊號傳導在阿爾茨海默病的症狀前階段以及可能的早期症狀階段(澱粉樣蛋白積累時)可能有助於減少澱粉樣蛋白對附近軸突和突觸造成的損害。它還阻止了 tau 蛋白穿過皮層的推進。然而,一旦 tau 蛋白病理明確確立,小膠質細胞可能會驅動突觸丟失和神經元死亡。
假設小膠質細胞在 tau 蛋白小鼠模型中的破壞性作用在人類阿爾茨海默病中也成立——這仍然是一個很大的假設——靶向小膠質細胞可能是一種可行的治療策略。在疾病的症狀前和早期症狀階段,最好促進小膠質細胞的啟用,尤其是在澱粉樣蛋白斑塊周圍。相反,在 tau 蛋白病理的更晚期階段,降低小膠質細胞反應可能會減緩神經退化,以及認知能力下降的速度。
或許,隨著我們更多地瞭解小膠質細胞對澱粉樣蛋白和 tau 蛋白病理反應的行為方式,可以為開發治療這種毀滅性疾病的療法確定新的靶點。一項人體臨床試驗目前正在測試 TREM2 啟用是否可以減緩早期阿爾茨海默病的程序,並且多種其他靶向小膠質細胞的療法正在進入藥物開發渠道。如果這些方法被證明是成功的,那麼阿爾茨海默在著名的屍檢中第三個被忽視的發現——在更廣為人知的斑塊和纏結之後——可能會被證明在減輕對患者大腦的可怕影響方面發揮重要作用。

