拉澤爾·科隆(Razel Colón)從記事起就飽受疼痛折磨。疼痛撕裂他的頸部和背部,射穿他的腿部,蔓延到他的腳,常常讓他痛苦地扭動,喪失行動能力。他偶爾會發作“急性胸痛”,呼吸會突然變得困難。“感覺像一頭大象坐在我的胸口,疼痛緊繃,”科隆告訴我。去急診室和醫院是家常便飯。“如果我幸運的話,”他說,“我可以一個月不去。”
科隆來自新澤西州霍博肯市,年僅 19 歲,但導致這些症狀的鐮狀細胞病一直是他不請自來的伴侶。但他現在講述他的故事,是從一個已經一年半沒有經歷過那種痛苦的人的角度。他可以做以前想都不敢想的事情:打籃球、舉重、在冷水中游泳。他的長期醫生,哈肯薩克大學醫療中心的兒科血液腫瘤學家斯泰西·裡夫金-澤嫩伯格(Stacey Rifkin-Zenenberg)說,他的治療“讓他從患病者變成了攜帶者”。
科隆的案例代表了一項新興技術曲線上的一個點,這項技術可能會永遠改變我們治療鐮狀細胞病等疾病的方法。基因組創新療法的尖端世界再次處於爆炸性變革之中——而定製 DNA 正是這場對話的核心。
關於支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您將幫助確保有關塑造我們當今世界的發現和想法的具有影響力的故事的未來。
這是大膽的新領域。一些策略,如基因療法,已經存在一段時間,包括基因改造細胞以產生治療效果的能力——即將校正後的基因新增到基因組中,以嘗試治療疾病。傳統上,病毒被用來將健康基因傳遞到細胞中,但過去十年見證了深刻的變革。多種基因療法已被批准用於治療多種疾病:鱗狀細胞皮膚癌、一種罕見的遺傳性失明、黑色素瘤、血液疾病等等。
正是這種型別的治療,作為由Bluebird Bio領導的最大的慢病毒持續基因治療試驗的一部分,有效地阻止了科隆的鐮狀細胞病病情。來自 19 名參與者的未發表的中期資料顯示,這些參與者至少隨訪了六個月,並且有嚴重的血管閉塞事件 (VOE) 或類似於科隆的鐮狀細胞危象病史,所有患者的嚴重 VOE 均完全緩解,公司發言人表示。該試驗仍在進行中,資料尚未完成,因此謹慎是明智的,但“前景非常廣闊”,發言人說。
下一代技術,基因編輯,又上了一個層次。基因編輯使科學家能夠精確地靶向許多生物(細菌、植物、動物)的異常基因,剪斷 DNA,然後在切口部位去除、替換或新增新的 DNA。“想象一下,你有一輛汽車輪胎癟了,”加州大學伯克利分校和創新基因組學研究所的基因編輯專家費奧多爾·烏爾諾夫(Fyodor Urnov)說。“基因療法是拿一個備用輪胎,把它放在汽車的某個地方,希望它能跑起來。基因編輯是修理癟了的輪胎。”
隨著2012 年一種名為 CRISPR 的基因編輯工具的問世,這項技術獲得了巨大的推動,CRISPR 是 Clustered Regularly Interspaced Short Palindromic Repeats(規律間隔性短迴文重複序列簇)的縮寫。CRISPR 技術比舊的基因組編輯方法更易於使用、更便宜、更高效,使科學家能夠快速改變 DNA 序列以修飾基因功能。這可能對生物體的健康產生積極影響,甚至逆轉疾病症狀。
“它通常被描述為‘分子剪刀’,”其共同發明者、諾貝爾化學獎得主詹妮弗·杜德納(Jennifer Doudna)說。“科學家可以利用 CRISPR 不僅切割任何生物 DNA 中的特定位置,還可以提供模板來修復 DNA。”
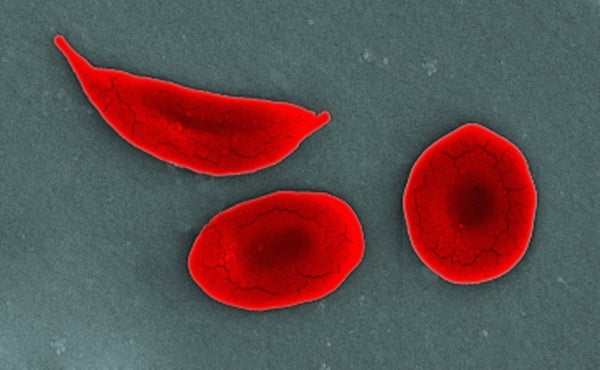
在鐮狀細胞病(SCD)中,β-血紅蛋白基因中的單個突變導致紅細胞變成新月形或鐮刀形。這些鐮刀狀細胞具有粘性,它們會堵塞動脈,阻止足夠的氧氣輸送到身體組織。這可能導致急性衰弱性疼痛發作,例如科隆經歷的那種,並可能導致許多併發症:貧血、中風和累及肺、心臟、腎臟、脾臟等器官的損傷。
由於反覆住院和輸血,患者的生活質量通常很差,並且面臨早逝的風險。在非洲和中東等醫療資源非常有限的地區,許多兒童在五歲之前死於 SCD。
CRISPR 正在加速透過基因工程治療此類疾病的步伐。基因編輯先驅、CRISPR Therapeutics 創始人、斯坦福大學醫學院兒科學教授馬修·波特斯(Matthew Porteus)說,研究人員目前採用兩種主要的基因編輯策略來嘗試治癒鐮狀細胞病患者。一種型別使用 CRISPR 來從根本上翻轉基因組開關,再次開啟健康的胎兒血紅蛋白的生產,這種血紅蛋白在生命早期被關閉。優勢是什麼?胎兒血紅蛋白不會鐮刀化。
第二種基因編輯策略,基因校正,直接修復導致疾病的缺陷基因中的突變。就鐮狀細胞而言,校正使身體能夠簡單地產生正常的血紅蛋白。研究人員已經記錄了大量的工作,試圖達到這一點。
雖然在批准了幾種新藥來幫助緩解 SCD 症狀方面取得了進展,但它們並非治癒性的。骨髓(幹細胞)移植是唯一的治癒選擇,但找到健康的供體匹配可能具有挑戰性。基因組療法應運而生,加州大學聖地亞哥分校的西奧多·弗裡德曼(Theodore Friedmann)於 1972 年首次提出用於治療遺傳疾病,同年,斯坦福大學的保羅·伯格(Paul Berg)生產重組 DNA,使基因組療法朝著現實邁進了一步。在 20 世紀 80 年代,科學家們展示瞭如何將 DNA傳遞到細胞中,到 2003 年,整個人類基因組已被破譯。
也曾出現過挫折,即使當基因編輯系統在新世紀開始時出現,使用它們仍然具有挑戰性和耗時。然後,CRISPR出現了,它以切片和切塊的方式進入臨床領域,有望潛在地改變的不僅是治療,還有疾病的預防。科學家們已經將這項技術用於研究癌症、淋巴瘤、艾滋病、囊性纖維化等疾病,用於包括SARS-CoV-2 檢測在內的診斷,甚至在農業工作中用於培育更大的西紅柿、不易褐變的蘋果和保質期更長的蘑菇。
即時看來,希望基因編輯將為一種非常常見且使人衰弱的遺傳病——鐮狀細胞病提供治癒方法。與我交談的幾位專家首次表示,SCD 的治癒方法可能即將出現。
這是一個令人震驚的想法。在實踐中,切除無法工作的基因並用正常工作的基因替換它們的能力可能有助於減輕多種疾病的最壞影響。當 2020 年諾貝爾化學獎授予詹妮弗·杜德納和埃瑪紐埃爾·卡彭蒂耶(Emmanuelle Charpentier),以表彰她們發明這項技術時,瑞典皇家科學院秘書長戈蘭·K·漢松(Goran K. Hansson)直言不諱地說:“今年的獎項是關於重寫生命程式碼。”
科學家們已經在研究更精確的下一代 CRISPR 技術。“鹼基編輯器”最近被證明可以治療小鼠的鐮狀細胞病,它可以在不切割 DNA 雙螺旋的情況下校正單字母 DNA 突變。還有“先導編輯器”,它可以替換更大的 DNA 錯誤。
這一切都非常了不起——而且還處於早期階段。“血紅蛋白病基因組療法領域並非零和博弈,”烏爾諾夫說。“我確信最終會有多種獲批藥物。會有多種基因療法獲得批准,也會有多種基因編輯獲得批准。”
仍然有許多問題需要考慮,包括基因編輯等概念可能發展到何種程度的道德影響,以及成本、安全性和可及性(專家表示,目前的治療費用可能高達 200 萬美元)。杜德納說:“真正的治癒意味著為每個需要它的人提供治療,這就是為什麼我們正在努力開發下一代療法,以降低成本並使其更易於獲得。”而且,由於基因編輯並非完美,“所有基因修飾療法的長期安全性都必須仔細研究,”波特斯說。
在未來幾個月,加州大學聯盟(加州大學舊金山分校、加州大學伯克利分校和加州大學洛杉磯分校)將進行首次人體開放標籤 I-II 期試驗,使用在創新基因組學研究所開發的非病毒傳遞 CRISPR 技術。科學家們希望透過用校正後的基因替代鐮狀細胞病試驗參與者有缺陷的 β-珠蛋白基因(導致該疾病的基因),直接修復他們血液幹細胞中的突變,從而減輕他們的痛苦。
“糾正並在健康紅細胞中繁殖的突變越多,治癒的可能性就越大,”該試驗的首席研究員、加州大學舊金山分校兒科教授馬克·沃爾特斯(Mark Walters)說。“鐮狀細胞病將透過基因組療法治癒。”畢竟,這是該技術的最高用途——即使在我們繼續瞭解該領域的同時,它也可能成為現實。
這是一篇觀點和分析文章;作者表達的觀點不一定代表大眾科學的觀點。