大腦依賴於被稱為神經遞質的化學信使系統,將資訊從細胞傳遞到細胞。當一切正常時,這些通訊使大腦能夠協調各種功能,從複雜的思維到快速的、下意識的反應——但當系統失調時,可能會導致嚴重的疾病或障礙。
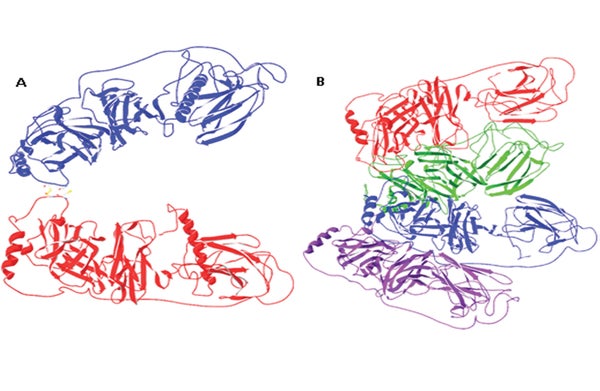
丹麥技術大學(D.T.U.)和牛津大學的一個研究團隊首次確定了多巴胺β-羥化酶(DBH)的分子結構,這種酶控制著多巴胺和去甲腎上腺素(兩種主要的神經遞質)之間的轉化。瞭解該酶的晶體結構可能為藥物開發提供理想的靶點。
多巴胺和去甲腎上腺素在許多大腦功能中起著關鍵作用,如學習、記憶、運動和戰鬥或逃跑反應。這些神經遞質水平的失衡——以及DBH在調節它們方面所起的作用——與多種疾病有關,包括高血壓、充血性心力衰竭、焦慮、抑鬱、創傷後應激障礙、阿爾茨海默病、精神分裂症、帕金森病,甚至可卡因成癮。
關於支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們今天世界的發現和想法的具有影響力的故事的未來。
DBH長期以來一直引起生物化學家的興趣,但執行確定蛋白質結構所需的分析一直具有挑戰性。“這種酶尤其困難,”D.T.U.的化學家、該研究的主要研究員漢斯·克里斯滕森說。“在我們最終成功之前,我們嘗試了許多不同的表達系統。現在我們有了結構,就很清楚為什麼了——[它]非常複雜,酶的不同部分之間相互作用非常緊密。”
克里斯滕森和他的團隊使用X射線晶體學(一種用於確定蛋白質結構的技術)發現,DBH包含兩個潛在的結合位點:首先是一個口袋,另一個分子可以在其中結合,這在DBH所屬的酶類別中很常見。然而,還有一個金屬離子結合位點是完全出乎意料的。“我們在酶的結構中看到的是,它與人們一直期望的完全不同,”克里斯滕森說。
事實上,之前已知的結構部分只涉及執行催化反應的酶部分——現在研究人員發現,該區域可能採取第二種形式,其中兩個銅結合位點比預測的更靠近。“這實際上可能是酶的活性形式,”克里斯滕森說。“如果是這樣,那麼[將]更容易理解酶的實際工作方式,但還需要更多的研究來闡明這一點。”
約翰·霍普金斯大學的生物物理學家馬里奧·阿姆澤爾沒有參與這項研究,但他研究過相關酶的晶體結構,他對這一假設表示懷疑。“總的來說,我認為兩個銅位點的接近程度不會[在未來的研究中]被跟進,”他說。即便如此,阿姆澤爾對這一發現持樂觀態度。“這個結構是一項重大成就,”他補充道。“該分子比催化核心大得多。可以預期的是,分子的其他部分以多種方式參與活動的調節或調製。這些其他部分如何控制活動是該領域將開始發展的一個非常重要的方向。”
瞭解酶的結構可能導致開發針對研究人員定位的兩個結合位點的藥物。“我們的下一步是與生物技術行業聯絡,嘗試幫助他們開發藥物,”克里斯滕森說。之前的研究表明,在大多數情況下,這將意味著降低DBH的活性,儘管某些疾病實際上可能需要該酶做更多的工作。DBH抑制劑已經在可卡因依賴、高血壓和PTSD的臨床開發中——儘管這些抑制劑僅針對銅結合位點。最新的發現可以促進更有針對性的新療法研究。