1月10日,當中國研究人員公佈一種神秘的、快速傳播的病毒的基因組時,這證實了丹·巴魯克最擔心的事。該基因組與導致 2003 年 SARS 爆發的冠狀病毒的基因組相似,但也存在顯著差異。“我立刻意識到,沒有人會對它免疫,”波士頓貝斯以色列女執事醫療中心病毒學和疫苗研究主任巴魯克說。
幾天之內,他的實驗室和全球其他數十個實驗室開始設計疫苗,他們希望這些疫苗能夠保護數十億人免受 SARS-CoV-2 病毒的侵害,這是自第二次世界大戰以來對全球健康和繁榮的最大挑戰。到 4 月初,19 個國家的近 80 家公司和研究所正在研發疫苗,其中大多數是基於基因的疫苗,而不是使用傳統方法,例如 70 多年來用於流感疫苗的方法。實驗室預測,到 2021 年初,商業疫苗可能會用於緊急或同情用藥——考慮到針對全新病原體的疫苗需要十年才能完善和部署,這速度快得令人難以置信。即使是快速通道的埃博拉疫苗,也花了五年時間才進入廣泛試驗階段。如果巴魯克和他的同行們能在一年內提供一種安全有效的混合物,“這將是歷史上最快的疫苗開發,”他說。
然而,這是一個很大的“如果”。儘管實驗室已經為其他病毒研製了幾種基於基因的疫苗,但沒有一種已商業化用於人類疾病。
支援科學新聞事業
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞事業: 訂閱。透過購買訂閱,您將有助於確保未來能夠繼續報道關於發現和塑造我們當今世界的想法的具有影響力的故事。
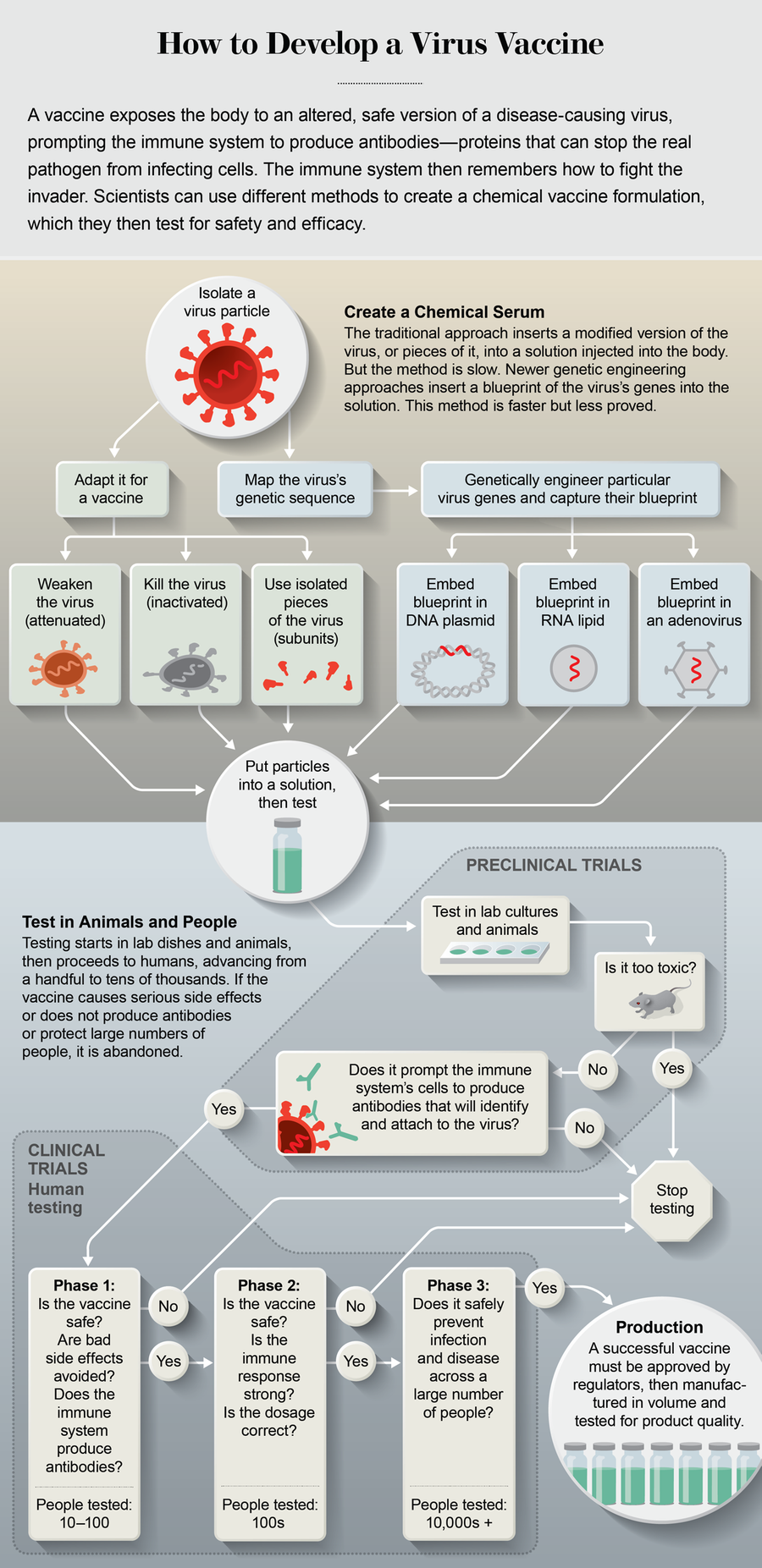
傳統疫苗透過注射進入人體,將病毒的特定片段插入注射部位附近的細胞中。免疫系統將這些片段上的分子(稱為抗原)識別為威脅,並透過產生抗體來做出反應,抗體是可以在體內任何地方找到病毒並中和它的分子。一旦發生這種演練,免疫系統就會記住如何消滅入侵者,從而阻止未來的感染。
既定方法是在雞蛋中(或最近在哺乳動物或昆蟲細胞中)培養減毒病毒,並提取所需的片段。對於每年都會變化的常見病毒(如流感),獲得合適的抗原可能需要四到六個月的時間。對於一種新的病原體,可能需要多年多次嘗試。對於已經蔓延到大流行程度的病毒來說,這太慢了。
相反,實驗室正在轉向基於基因的疫苗。科學家們利用病毒基因組的資訊來建立選擇性抗原的藍圖。該藍圖由 DNA 或 RNA 構成——這些分子攜帶遺傳指令。然後,研究人員將 DNA 或 RNA 注射到人體細胞中。細胞的機制使用這些指令來製造病毒抗原,免疫系統會對這些抗原做出反應。細胞對指令的反應是其日常存在的一部分。這與傳染性病毒利用的特性相同;它們無法自行繁殖,因此它們利用細胞的機制來複制自身。它們從細胞中爆裂出來並感染更多細胞,擴大感染範圍。
圖片來源:Jen Christiansen
幾乎所有實驗室都希望找到一種方法來訓練人體細胞產生一種名為刺突蛋白的抗原。它像輪胎上的螺柱一樣從 SARS-CoV-2 中突出,使病毒能夠與人體細胞結合並潛入內部。幾乎所有實驗室都使用三種方法之一來傳遞刺突藍圖。第一種是 DNA 質粒,通常是一個小的環狀分子。質粒是一種方便的工具,因為如果病毒發生變異,研究人員可以很容易地換入新的藍圖。DNA 質粒疫苗已用於魚類、狗、豬和馬的獸醫用途,但人類應用一直滯後,主要是因為疫苗難以穿過細胞的保護性外膜到達內部機制。最近的一項改進是用一種儀器注射疫苗,該儀器對注射部位附近的細胞施加短暫的電荷,從而在細胞膜上開啟孔隙,使疫苗能夠進入。
Inovio Pharmaceuticals 公司總部位於賓夕法尼亞州普利茅斯會議,正在採用 DNA 質粒方法。幾年前,該公司啟動了針對另一種冠狀病毒疾病——中東呼吸綜合徵 (MERS) 的刺突蛋白的臨床試驗。據執行長 Joseph Kim 稱,疫苗接種者體內的抗體水平“與我們在從 [自然] 康復的 MERS 患者的血液樣本中看到的抗體水平一樣好或更好”。該公司調整了其平臺——質粒及其測試方法——以製造 SARS-CoV-2 疫苗。
DNA 質粒疫苗的工作原理是將遺傳藍圖轉移到細胞機制中的 RNA,從而產生刺突抗原。但科學家們可以透過將藍圖嵌入 RNA 鏈中來跳過質粒步驟——第二種方法稱為 RNA 疫苗。RNA 攜帶在脂質中,脂質被注射到體內;脂質是脂肪分子,可以很容易地進入細胞。研究表明,RNA 疫苗可能比 DNA 質粒在動員免疫系統產生抗體方面更好。它們似乎還能誘導更強大的免疫力——免疫系統中更強的記憶力——因此需要更低的劑量。一些 RNA 疫苗正處於其他病毒性疾病(包括狂犬病、HIV 和寨卡病毒)的早期臨床試驗階段。位於馬薩諸塞州劍橋市的 Moderna 公司正在將這種方法用於 SARS-CoV-2。
RNA 疫苗不如 DNA 質粒疫苗穩定;體內常見的酶可以快速降解它們。熱量也會破壞它們。RNA 疫苗通常必須冷凍或冷藏儲存,這會造成後勤障礙,尤其是在較貧窮的國家。DNA 質粒疫苗在較高溫度下是穩定的。
巴魯克和他在強生公司的合作者正在使用第三種方法:將 DNA 藍圖插入普通感冒病毒中。當注射時,這種所謂的腺病毒載體感染人體細胞並傳遞它所攜帶的藍圖。腺病毒擅長進入細胞,但過去的研究表明,人體免疫系統很容易識別某些腺病毒並在它們潛入之前攻擊它們。巴魯克正在使用一種經測試表明不太可能被識別的腺病毒。一些專家還擔心腺病毒本身可能會在體內複製並引起疾病。為了解決這種可能性,巴魯克的團隊正在使用一種工程病毒,該病毒是非複製性的——它無法在人體細胞內複製自身,因為它需要一種人體不提供的複製物質。4 月下旬,牛津大學開始對另一種非複製性腺病毒進行有限的人體試驗。
一旦疫苗的基本功能在實驗室培養中得到證實,就會在動物身上進行評估,以檢視其是否安全以及是否能引起免疫反應。接下來,它會在人體中進行測試——首先是小群體,以檢查安全性和副作用,然後是越來越多的群體,以檢視其有效性。Inovio 的 DNA 質粒於 4 月 6 日進入小規模人體試驗——僅在 SARS-CoV-2 基因組釋出三個月後。Moderna 更早地於 3 月 16 日開始了其 RNA 疫苗的小型人體試驗,4 月,美國政府承諾提供高達 4.83 億美元的資金,以加快大規模生產(如果試驗進展順利)。巴魯克的實驗室在短短四周內設計出了一種原型腺病毒疫苗。強生公司與巴魯克的實驗室合作,目前正在小鼠、雪貂和恆河猴身上進行測試。3 月 30 日,美國和強生公司承諾投入超過 10 億美元,為大型人體臨床試驗提供資金,如果有限的測試證明有效,這些試驗計劃於 9 月開始。
儘管從疫情爆發到小型測試的時間比使用雞蛋方法要快得多,但不能保證基因工程疫苗的擴充套件試驗不會花費數年時間。幸運的是,SARS-CoV-2 的變異速度似乎不如流感那麼快,這表明一旦開發出有效的疫苗,可能會提供長期的保護。
除了有效性之外,專家們還在關注試驗中是否會出現“疾病增強”——疫苗可能會意外加重 COVID-19 症狀的可能性,COVID-19 是 SARS-CoV-2 引起的疾病。2004 年,接受實驗性 SARS 疫苗的雪貂出現了破壞性炎症。Kim 說,接受實驗性 SARS 疫苗治療的人類沒有出現疾病增強。但這些配方從未進入大規模人體試驗,因為疫情——在近 30 個國家感染了約 8,000 人——在一年多一點的時間內就消退了。
公司正在加快 SARS-CoV-2 疫苗的開發時間,部分原因是同時在多種動物物種中測試疫苗,並與少量人群並行進行。通常,該過程是一次一種動物,然後是人,以確保副作用小、免疫反應大以及疾病實際上被擊敗。時間緊迫值得冒更大的風險。
保護全球免受 COVID-19 侵害將需要巨大的生產能力。DNA 質粒疫苗和 RNA 疫苗從未擴大到數百萬劑的規模,Inovio 和 Moderna 等小型公司也不會在內部擁有這種能力。根據巴魯克的說法,腺病毒疫苗在開始時更耗時,但一旦被證明有效,“可以快速擴大規模”。強生公司使用腺病毒方法生產了數百萬劑埃博拉疫苗,目前該疫苗已在廣泛的人體試驗中。一些小組正在研究其他可能需要更長時間的 DNA 技術。
亞利桑那州立大學的病毒學家和冠狀病毒專家 Brenda G. Hogue 表示,目前還沒有明顯的首選原型疫苗。但她說,基因研究的速度以及公司全力投入的力度令人鼓舞:“我感到非常樂觀。”
閱讀更多關於冠狀病毒爆發的資訊 請點選此處訪問《大眾科學》。並閱讀我們 國際雜誌網路的報道,請點選此處。