保護主義者和生物倫理學家通常以驚奇、興奮和恐懼的複雜心情看待被稱為“基因驅動”的工程 DNA 包裹。基因驅動違反了正常的遺傳規則,確保它們傳遞給宿主生物體的所有後代,而不僅僅是一半;因此,它們具有令人不安的潛力,可以快速且不可撤銷地改變種群。關於基因驅動的大部分爭議都集中在使用它們來控制危險昆蟲害蟲的實用性(和狂妄自大),因為昆蟲幾乎是唯一被證明基因驅動有效的動物。
現在情況已經改變。在今天發表在自然雜誌上的一篇論文中,加州大學聖地亞哥分校的生物學家首次證明,當前的基因驅動技術在哺乳動物(小鼠)身上也有效——至少在一定程度上是有效的。他們的發現突出了基因驅動在現實世界中應用的潛力,但也指出了其顯著的侷限性。在未來相當長一段時間內,這些“主動遺傳學”技術可能更適合作為實驗室工具,而不是改造自然的工具。
關於支援科學新聞
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道: 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們今天世界的發現和想法的具有影響力的故事的未來。
弗雷德·古爾德,北卡羅來納州立大學的昆蟲學家和進化生物學家,將基因驅動比作庫爾特·馮內古特的小說《貓的搖籃》中的虛構物質冰-九:一種奇怪的冰的形式,可以凍結它接觸的所有其他水。基因驅動傳播迅速,因為它們是遺傳元件的集合,這些元件可以自發地從母本染色體複製到匹配的父本染色體,反之亦然。在自我複製的過程中,基因驅動還可以在其插入點新增、刪除或修改基因。早在 2003 年,基因驅動就被認為是一種理論上的可能性,但 2012 年 CRISPR/Cas9 基因組編輯技術的出現突然使其變得更加可行。
儘管法律限制、倫理擔憂和對意外後果的恐懼阻礙了基因驅動在野外的測試,但它們可能帶來的假設性好處的誘惑促使科學家繼續研究它們。例如,一個受到良好監管的基因驅動可能透過使按蚊對瘧疾寄生蟲感染產生抗性,從而挽救數百萬人的生命。
人們對開發基因驅動來控制大鼠和小鼠的興趣也很高,因為作為入侵物種,它們經常嚴重威脅野生動物。在北太平洋重要的信天翁繁殖地中途島,大約一個世紀前到達的掠食性老鼠幾乎將這些鳥類消滅殆盡。1995 年進行的大規模毒殺運動消滅了老鼠,拯救了信天翁——但保護主義者寧願有一種不那麼粗暴的武器來阻止其他情況下的有害哺乳動物。(根據一年前的報道,中途島上的小鼠現在正成為鳥類的新威脅。)
然而,最初吸引發育生物學家金伯利·庫珀涉足小鼠基因驅動技術的並非保護,而是進化。在她位於 UCSD 的實驗室中,她和她的同事研究跳鼠的進化,這是一種長腿齧齒動物,具有跳躍的雙足步態,在數千萬年前從小鼠譜系中分離出來。庫珀和她的同事正試圖透過讓實驗小鼠攜帶越來越多的跳鼠特徵,來尋找導致這種進化轉變的未知基因變化組合。
然而,對於哺乳動物來說,這種專案非常繁瑣,因為透過傳統的育種方式將所需的基因匯入個體動物涉及到很多工作。遺傳實驗通常需要對於某種性狀為純合的動物,這意味著它們在母本和父本染色體上都攜帶相關基因的複製。為了創造一隻對於僅僅三個感興趣的突變為純合子的小鼠,研究人員可能需要將數百甚至數千只具有單染色體突變的小鼠進行雜交。庫珀的跳鼠專案很容易最終需要對於 10 個或更多基因為純合子的小鼠。
“我一直認為這是不可能的,因為在小鼠中,將多種事物組合在一起的遺傳學是一團糟,”她說。“你需要很多動物。這需要大量的時間和大量的金錢。”
但三年前,她受到 UCSD 同事 瓦倫蒂諾·甘茨 和 伊桑·比爾 的啟發,開始效仿他們的做法。這兩位生物學家最近證明了他們在果蠅身上稱之為“主動遺傳學”的技術。主動遺傳學指的是使用遺傳元件將特定性狀的遺傳率提高到超過格雷戈爾·孟德爾首次觀察到的正常 50% 的比率;甘茨和比爾將基因驅動歸類為一種自我永續的主動遺傳學形式。
“我認識到相同的技術可以用於實驗室,理想情況下可以提高工程改造基因版本的遺傳率,”庫珀說。它還可以讓她引入來自小鼠以外物種的基因。“你可以製造出以前可能無法制造的基因複雜的動物。”
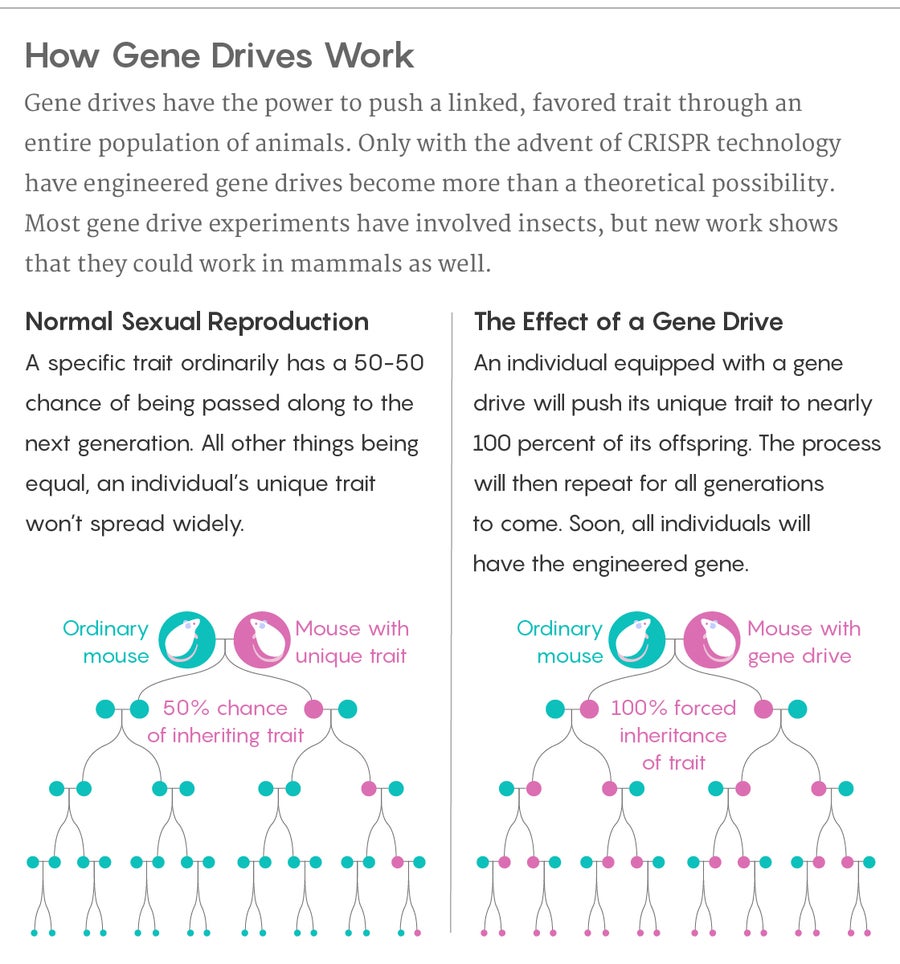
來源:露西·雷丁-伊坎達 量子雜誌
正如他們在他們的新論文中描述的那樣,庫珀和她的團隊設計了一種主動遺傳學機制,使一個“標記”基因能夠在小鼠譜系中快速傳播。庫珀強調,他們製造的在技術上不是基因驅動:作為一項安全措施,她的機制的兩個組成部分——一個負責切割 DNA,另一個負責靶向切割——被分離到基因組的不同部分。這種分離阻止了該機制在多代中不受控制地傳播。然而,它的成功證明了基因驅動在哺乳動物中的概念可行性。
即便如此,這種成功也伴隨著一些限制。出乎意料的是,庫珀的主動遺傳學系統在雄性小鼠身上不起作用,只在雌性小鼠身上起作用。即使在雌性小鼠中,該機制也最多隻有約 70% 的時間有效。
“如果現在有人試圖使用這種型別的機制構建基因驅動,它不會非常迅速地在種群中傳播,並且可能不會持久,”庫珀說。對雌性的限制也會降低基因驅動開發新的實驗動物品系的效率,但至少可以加快育種過程。
她和她的同事懷疑,基因複製機制在雄性和雌性中表現不同,是因為精子和卵子的產生方式存在細微差異。在卵子生成細胞中,染色體對可能在生產過程中更早地排列在一起,如果其中一條染色體被切割,細胞將使用來自其夥伴的所需 DNA 對其進行修復的可能性會更高。“如果我們能夠掌握好時機,我們或許能夠提高效率,並使其在雄性中也起作用,”庫珀說。
安東尼·詹姆斯,加州大學歐文分校的分子遺傳學家說,經過一些改進,主動遺傳學最終應該能夠用於生產不同領域遺傳學研究所需的複雜實驗動物,從而為今天的技術提供更有效的替代方案。(詹姆斯在 2015 年與甘茨和比爾合作開發了一種實驗性的蚊子抗瘧疾基因驅動。)他說,過去使用傳統育種方法培育具有許多基因特定組合的小鼠可能需要十年時間;而主動遺傳學可能會將時間縮短到一到兩年。
使用 CRISPR 將基因逐個插入小鼠體內是另一種方法,但他認為主動遺傳學也將優於這種方法。“普通舊式 CRISPR 非常適合修改已經存在的基因,”他說。“但是,如果你想新增基因,或者將它們換出並替換掉,基因驅動系統會更好。”
布魯斯·康克林,舊金山格萊斯頓研究所的遺傳學家,他為自然雜誌撰寫了一篇關於庫珀研究的評論,他對主動遺傳學表達的熱情更為謹慎。“這很有價值,但藉助 CRISPR,我們[已經]可以非常快速地構建非常複雜的模型,”他說。儘管如此,他讚揚這項工作突出了雄性和雌性細胞生物學中被忽視的差異,並且他認為它所倡導的主動遺傳學方法可能有助於理解 DNA 修復和分子生物學中的其他基本機制。
庫珀看到了基因驅動在哺乳動物中似乎比在昆蟲中更難創造的光明一面,考慮到圍繞其潛在用途的爭議。提高主動遺傳學在哺乳動物中的效率還需要幾年時間。“與此同時,我們可以就[基因驅動]在野外可以而且應該做什麼進行認真的對話,”她說。
經量子雜誌許可轉載,量子雜誌是西蒙斯基金會的編輯獨立出版物,其使命是透過報道數學以及物理和生命科學的研究進展和趨勢來增進公眾對科學的理解。
