沒有任何根本性的障礙阻止我們開發出治療阿爾茨海默病的有效療法。人性的其他問題,如暴力、貪婪和不寬容,有著令人眼花繚亂的複雜原因和不確定性。但阿爾茨海默病,其核心是一個細胞生物學問題,其解決方案應該完全在我們力所能及的範圍之內。科學界很可能已經有一種未被識別的療法,儲存在實驗室冰箱裡眾多化學試劑瓶中。而重大的見解可能就存在於大型資料庫或臨床記錄、神經心理學特徵、腦成像研究、血液和脊髓液中的生物標誌物、基因組、蛋白質分析、神經元記錄或動物和細胞培養模型的登錄檔中,等待被人們注意到。
但我們錯過了這些線索,因為幾十年來,我們花了太多時間追逐阿爾茨海默病研究中每一個光鮮的新發現,卻很少深入思考這種疾病的潛在生物學機制。相反,我們的工作受到了一些假設的驅動。這些假設中,β-澱粉樣蛋白片段的核心和主導作用一直是其中之一。大量資料支援β-澱粉樣蛋白在該疾病中起重要作用的觀點。我們已經開發出可以降低阿爾茨海默病患者體內該蛋白質片段濃度的藥物,但總的來說,它們並沒有以任何有意義的方式阻止患者的認知能力下降。
現在看來,簡單地斷定消除或抑制β-澱粉樣蛋白就能治癒或治療那些患有這種疾病的人,尤其是對疾病如何發展和進展缺乏更深入、更全面的瞭解的情況下,是過於簡單化了[參見“更深入地審視阿爾茨海默病的病因和治療方法”]。我們並沒有完全走錯研究方向,但我們的熱情導致我們忽視了其他方向,甚至忽視了這個特定方向的根源。
支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您正在幫助確保關於塑造我們當今世界的發現和想法的具有影響力的故事能夠擁有未來。
現在是迴歸基礎的時候了。我是一位參與阿爾茨海默病研究三十年的科學家,參與了大型專案,研究具有阿爾茨海默病高風險的家庭、預防策略以及作為該疾病一部分的大腦細胞損傷的生理學。我和我的同事們,他們來自許多科學和醫學學科,認為我們需要重新審視阿爾茨海默病的基本生理學和生物學,並重新評估資料庫和實驗室冰箱的內容,尋找我們可能忽略的線索。這種方法將使我們能夠開發出關於這種疾病進展方式的理論和模型,我們可以利用這些想法來衍生出對抗該疾病的新策略。
至少有五個潛在的富有成效且及時的研究方向——這些領域基於過去幾年中取得的重要發現——可以擴充套件我們的知識,而且我認為它們很可能產生找到有效治療方法所需的見解。這些領域包括腦細胞清除問題蛋白質的方式出現故障,炎症造成的損害,以及細胞之間傳送電訊號的方式出現問題。這些是不同的領域,但在一個人身上,它們重疊在一起,導致大腦疾病,並且單獨或共同地可能潛藏在阿爾茨海默病造成的可怕損害背後。

圖片來源:加倫·達拉
蛋白質處理問題
從1900年代初期開始,幾位神經病理學家——包括以他的名字命名該疾病的阿洛伊斯·阿爾茨海默——描述了死於各種形式痴呆症的患者大腦中的微觀病變。今天我們知道這些是形狀異常的蛋白質團塊。就阿爾茨海默病而言,一些團塊由β-澱粉樣蛋白片段組成。它們位於神經元之間,被稱為老年斑。其他團塊位於神經元內部,由一種稱為tau蛋白的蛋白質組成,被稱為神經原纖維纏結。
一百多年後,我們仍然不知道的是,為什麼細胞無法清除這些異常的腫塊。細胞清除受損蛋白質的機制與生命本身一樣古老。在阿爾茨海默病的情況下,哪裡出了問題?這個問題與細胞增殖失控對於癌症進展的重要性一樣,是疾病過程的核心。來自聖路易斯華盛頓大學和其他機構的研究人員最近的一些觀察表明,異常蛋白質可能會找到從細胞中逸出的途徑,可能逃避了它們天然的壞分子檢測系統。我們不知道它們是如何做到的,但弄清楚這一點可能是一個非常有用的方法,可以開始一項新的搜尋,尋找阿爾茨海默病如何以及為何進展。
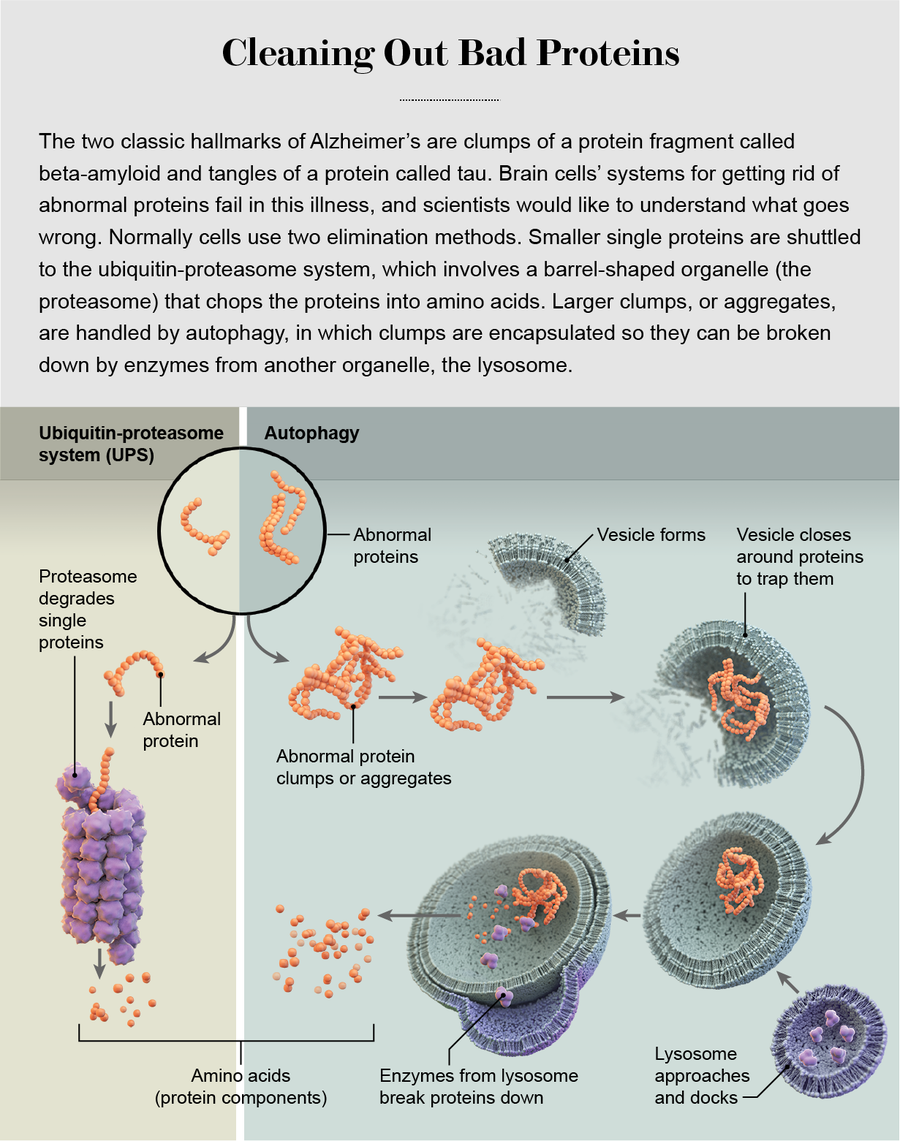
細胞有兩種主要的系統來清除異常蛋白質:泛素-蛋白酶體系統(UPS)和自噬。在前一種系統中,蛋白質被插入到一個桶狀細胞結構中,稱為蛋白酶體,在那裡它們被分解成可重複使用的部分;在後一種系統中,細胞包裹住異常蛋白質並完全摧毀它們。在神經元中,這些系統被共同選擇來控制細胞訊號連線的組成——由稱為軸突、樹突和突觸的解剖結構形成——因為它們在學習過程中被加強或減弱。(有時神經元會擠出受損的蛋白質,並將其破壞任務交給小膠質細胞,小膠質細胞是免疫系統的一部分。)
關於是將異常蛋白質轉移到UPS還是自噬的決定主要基於蛋白質的大小。蛋白酶體在每一端都有一個狹窄的、類似孔的開口,可以接受小的、細的、線狀的蛋白質鏈。在內部,有酶將蛋白質分解成其組成的氨基酸,這些氨基酸被回收用於合成新的蛋白質。不適合蛋白酶體的大分子,例如蛋白質團塊和舊的、形狀異常的、具有與年齡相關的損傷的蛋白質,會被轉移到自噬系統及其更強大的破壞引擎——溶酶體。
在阿爾茨海默病中,某些東西出了問題,導致腦細胞中留下這些tau蛋白和澱粉樣蛋白塊,進一步損害或窒息它們。因此,如果我們瞭解這些系統的細節,我們就可以對阿爾茨海默病的病理學有巨大的瞭解。我們需要檢查不同神經元亞型中降解途徑的具體差異,以及這些處理系統識別異常蛋白質的精確機制。tau蛋白等蛋白質的畸形並非一步到位。蛋白質可能攜帶突變並積累修飾,從而使其易於錯誤摺疊,隨後可能在多階段過程中聚整合越來越大的結構。隨著蛋白質沿著這條途徑進展,在哪個時間點,監視系統會啟動並識別它們為異常?深入瞭解這些過程可能引導我們採取更具戰略意義的藥物治療和干預方法。
一項有趣的發現與我們對這種逃避的理解有關,那就是tau蛋白可以從細胞中轉移到細胞之間的空間,並從那裡被鄰近細胞吸收。這種運輸系統的目的是什麼尚不清楚。細胞之間的蛋白質交換是正常的嗎?還是細胞排出異常的tau蛋白以擺脫有毒物質?我們認為,在阿爾茨海默病中,至少一些細胞外的tau蛋白已經錯誤摺疊。我們這樣認為是因為,當這種tau蛋白進入鄰近細胞時,它會形成一個模板,一種異常模式,該細胞中的其他tau蛋白會利用該模板以類似的奇怪方式塑造自身。當它擴散時,鄰近細胞中的tau蛋白會複製進入的tau蛋白的特定形狀。
對細胞外tau蛋白的觀察促使一些人推測,可以透過遞送給患者的抗體在該點攔截並清除該蛋白質。但是,除非我們確切知道tau蛋白在造成損害時的形狀,否則這種方法不太可能奏效。這種精確的結構是設計高度特異性抗體的必要資訊。另一個懸而未決的問題是tau蛋白在細胞之間複雜空間中的位置。更具體地說,它是否會穿過突觸,即兩個神經元傳遞訊號的地方?突觸間隙是一個狹窄的間隙,抗體不易進入。可能更有希望的方法是確切瞭解tau蛋白如何從細胞中擠出,以及鄰近細胞用來拾取該蛋白質的受體;我在實驗室最近進行的實驗可能指向了一個此類受體的身份。
識別蛋白質變化
阿爾茨海默病研究的近期一項重大進展是在前所未有的細節水平上對細胞內異常tau蛋白(纏繞在神經原纖維纏結中)進行成像。這張非凡的影像於2017年在《自然》雜誌上發表,顯示數千個tau蛋白排列成對,緊密鎖定在C形結構中。在這種固體內含物中看到的特徵可能為設計小分子提供必要的資訊,這些小分子可以嵌入異常蛋白質的裂縫中,並將其拉開以破壞疾病過程。
但是,由於多種原因,分解這些結構是一個具有挑戰性的目標,其中最不重要的原因是整個纏結是如何牢固地結合在一起的。一個更成功的方向可能是確定將這些tau蛋白從其典型的液態轉變為該影像中看到的更剛性和固態的微觀事件序列,並發現使tau蛋白易於發生這種變化的蛋白質修飾。
圖片來源:坎貝爾醫學插畫
從液態到固態的轉變稱為相變。生物學家現在對活細胞中此類轉變的興趣正在激增,因為它們可能在疾病中發揮作用。物理化學家多年來一直在研究相分離,例如油滴在水中的凝聚。油和水都是液體,但由於吸引力和排斥力的平衡,它們仍然分離。相分離對於活細胞的優勢在於,它將一組特定的分子集中在一個地方,這有助於某些細胞活動。例如,基因附近的多個蛋白質可以凝聚以控制該基因的表達,正如2018年《科學》雜誌上的一篇論文所示。這種凝聚的蛋白質組,雖然仍處於液態,但不會擴散開來;它們透過微弱的物理力結合在一起形成液滴。這種配置允許蛋白質組一起移動和工作,而無需包裹在膜中,這將需要細胞付出代價高昂的維護。
有些蛋白質,如tau蛋白,當它們位於液滴內時,會緊密堆積,高濃度可能會使它們容易聚整合纏結。以這種方式形成液滴的蛋白質具有一個稱為內在紊亂的特性。像希臘神普羅透斯一樣,它們可以呈現多種形狀,這與僅限於少數特定形式的更有序的蛋白質形成對比。不同的形狀需要不同的能量水平。有時,一些內在紊亂的蛋白質會摺疊成如此低的能量狀態,以至於它們無法從中移出,這實際上增加了它們的剛性。這可能會加劇它們纏結在一起的趨勢。
細胞還將易於相變的蛋白質和其他分子包裝在稱為應激顆粒和RNA顆粒的無膜細胞器中。當某些蛋白質和RNA在這樣的顆粒中聚結時,它們會緊密地堆積在一起,但通常保持液態。然而,在一定的密度下,它們可能會更容易發生更多的結塊,併發生向固體的相變,這種轉變會增加它們造成腦損傷的能力,並使細胞處理系統更難清除它們。這就是為什麼我們需要更好地瞭解觸發這一過程的條件。
基因的影響
在中年人中,阿爾茨海默病可能由三個基因(APP、PSEN1 和 PSEN2)的基因突變引起,這些突變會導致一種罕見的家族性疾病,這是一種可怕的遺傳,代代相傳。但在絕大多數情況下,阿爾茨海默病出現在65歲以上的個體中,並且不涉及這些基因。透過梳理數萬個基因組,遺傳學家現在已經發現了其他DNA變化,大約二十幾個基因變異,這些變異會少量增加風險。這些替代形式中最有影響力的是稱為e4變異的APOE基因的一個版本。幾種風險基因變異的組合會增加一個人患上該疾病的可能性。(由於基因變異通常與種族有關,我們需要比目前主要基於高加索人的基因分析和登錄檔更具包容性的資料集,以便對所有人群的遺傳風險進行可靠的評估。)
每個變異都打開了一扇不同的門,透過這些門,我們可以探索我們基因組中的微小變化如何增加我們患上阿爾茨海默病的可能性。一些更常見的變異,因此也是最有趣的門,是小膠質細胞中的基因或其他DNA片段。在2019年《科學》雜誌上發表的一篇研究這些免疫系統細胞的論文中,科學家們在一種稱為BIN1的基因中發現了一種與阿爾茨海默病風險相關的變異。該基因通常參與小膠質細胞吞噬潛在有害的外部分子並將其移動到細胞內部的方式,從而保護附近的神經元。該變異會影響小膠質細胞清除遊離蛋白質的效率。
在小膠質細胞和其他細胞中,某些基因變異也與年齡和性別有關。例如,男性和女性在22對非性染色體上的基因以及在X和Y染色體上表達的基因方面存在差異。這些變異的影響可能與女性阿爾茨海默病發病率較高有關,即使在校正女性壽命更長的情況下也是如此[參見“更年期使五分之一的女性易患阿爾茨海默病”]。總的來說,與阿爾茨海默病相關的任何單個基因變異的微小影響可能以其自身有限的方式,促成我們在處理澱粉樣蛋白和tau蛋白積累方面的個體差異。我們需要確定這些貢獻的方式和原因。
馴服炎症
當大腦檢測到損害源(如澱粉樣蛋白斑塊或tau蛋白神經原纖維纏結)時,它會發出警報並釋放大量稱為細胞因子的免疫系統分子,以及各種攻擊細胞。這種反應主要源於小膠質細胞,它會引起炎症反應,旨在摧毀任何藏匿麻煩點的組織。這種粗暴的“先天性”系統與更精細的“適應性”免疫系統的工作方式截然不同,後者產生僅對特定入侵者(如細菌或病毒)起反應的免疫細胞和抗體,並進行更狹窄、更精確的防禦。更廣泛的先天性反應在阿爾茨海默病中占主導地位。隨著病變擴散超出神經元內部機制清除碎屑的能力,這種一般的炎症反應就會啟動,但不幸的是,它通常會擊中大腦中仍然健康的細胞。加州大學歐文分校的科學家最近發現,消除老年小鼠體內衰老的小膠質細胞促使動物用新鮮的小膠質細胞重新填充它們的大腦。這種再生改善了空間記憶,逆轉了與年齡相關的神經元基因表達變化,並增加了新神經元的誕生以及樹突的密度。
這種由澱粉樣蛋白和tau蛋白引發的攻擊可能發生在隨著年齡增長自然發生的大腦低水平炎症之上。許多老年人體內促炎細胞因子(如腫瘤壞死因子(TNF))的濃度升高,這表明在人生的這個階段,全身都存在輕微的炎症狀態。人類的衰老差異很大,這些差異意味著阿爾茨海默病的進展和影響也差異很大。這種多樣性可能部分歸因於人類免疫系統的個體差異。不同的人繼承了參與免疫反應的不同基因配置。此外,在我們的一生中,我們的系統受到非遺傳因素的影響。我們在腸道等地方接觸到不同的共生微生物,以及來自我們周圍環境的病原微生物。所有這些都表明,免疫系統暴露於各種病原體,以及我們的基因差異,可能透過建立個體免疫譜或“免疫型別”來促成阿爾茨海默病的發展。
對於想要阻止廣泛炎症造成的大腦損傷的研究人員來說,挑戰在於區分大腦用於對抗發展中的問題和普通年齡誘導的退化的理想免疫反應,與針對阿爾茨海默病進展病理學的其他、更魯莽的免疫反應。研究界希望馴服由該疾病引起的大腦炎症,但尚不知道如何精確地進行干預。
電連線中斷
大腦是一個電氣器官:其最顯著的特徵是其編碼和傳遞資訊的能力,資訊以神經元之間傳遞的電訊號的形式存在,通常透過稱為神經遞質的化學物質傳遞。阿爾茨海默病如何損害腦細胞的訊號傳導並擾亂它們組裝成功能性記憶迴路的方式尚未得到充分研究。但現在,由於技術進步使我們能夠以精細的細節視覺化這些連線,因此檢測結構和功能連線的能力正在蓬勃發展。
其中一些進展涉及光遺傳學,這是一種科學家使用光刺激動物大腦中特定神經元的方法。研究人員可以給動物提供獎勵或恐懼體驗,然後檢測哪些基因變得更活躍。這種方法以令人印象深刻的成就,現在使研究人員能夠觀察和操縱編碼特定記憶(稱為記憶印跡)的特定神經元,正如2020年《科學》雜誌上的一篇論文所述。當這些細胞在最初的體驗之後僅透過光刺激時,就會回憶起對它的記憶。如果我們能夠弄清楚驅動這些電記憶連線形成的生物學機制,那麼這些資訊對於幫助我們理解阿爾茨海默病病理學如何中斷這種神經迴路至關重要。

圖片來源:加倫·達拉
神經科學家在今年取得了另一項進展,他們發現小膠質細胞似乎參與透過消除通常連線神經元的突觸來使大腦忘記這些記憶印跡。
我們也知道,神經遞質受到一些與阿爾茨海默病病理學相關的蛋白質的不同方式的影響。例如,tau蛋白會在使用神經遞質穀氨酸並努力激發訊號的神經元中積累。但是,其他抑制訊號的神經元——訊號傳導依賴於良好的啟動和停止機制——釋放不同的神經遞質GABA,並且受tau蛋白積累的影響較小。這種細胞選擇性的基礎及其後果尚不清楚,我們需要更好地理解它。科學家們還發現神經元活動增強了tau蛋白的擴散,這可能是阿爾茨海默病難題的另一個重要組成部分。
不僅訊號細胞型別受到疾病過程的不同影響,而且不同的大腦區域的影響也不同。例如,與記憶、情緒和睡眠相關的大腦區域受到嚴重損害,而與主要運動和感覺功能相關的中心則相對倖免。一項研究發現,當我們走神時啟用的大腦區域,即所謂的預設或靜息狀態,與澱粉樣蛋白斑塊首次沉積的地方相同。但我們在得出結論時必須謹慎——走神不一定會導致澱粉樣蛋白沉積。
睡眠是大腦的另一種電狀態,人們越來越認識到它是阿爾茨海默病發展的一個因素。澱粉樣蛋白和tau蛋白的水平在正常的睡眠-覺醒週期中都會波動,睡眠剝奪會急劇增加澱粉樣蛋白的產生並減少其清除。深度睡眠會喚起有節律的腦脊液波,這可能有助於清除大腦中的毒素,包括澱粉樣蛋白。不幸的是,這種睡眠會隨著年齡的增長而減少。這一觀察結果可能會刺激旨在專門恢復深度睡眠的藥物方法的研究。
共同的想法
這些研究領域並非重振阿爾茨海默病科學議程的全部和最終目標。肯定還有更多。但這五個途徑是相互交織的,並且像生物學本身一樣,可以用多種交叉施肥的方式進行研究。我希望之一是,隨著基礎科學填補缺失的資訊——特別是定量資訊——計算建模者和理論家將介入,以幫助預測阿爾茨海默病病理學對大腦回路和細胞途徑的影響。我還希望看到這些研究方向促使研究人員集體和系統地思考,並以建設性的方式分享他們的想法。這就是我們如何共同努力,以消除我們對這種可怕疾病的無知。

