美國食品藥品監督管理局(FDA)週五批准了一種新藥,以減少與鐮狀細胞病這種罕見血液疾病相關的併發症。
該藥物 Endari 由私人控股公司 Emmaus Medical 生產,是近 20 年來首個獲得 FDA 批准的鐮狀細胞病新療法。然而,Endari 中的活性成分 L-谷氨醯胺是一種可以在櫃檯購買的舊化學物質,這可能會使 Emmaus 難以獲得保險覆蓋。
在 Emmaus 的關鍵臨床試驗中,與安慰劑相比,使用 Endari 治療 48 周可減少因鐮狀細胞疼痛危機而住院就診的頻率和時長。該藥物常見報告的副作用包括便秘、噁心和頭痛。
支援科學新聞
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您正在幫助確保有關當今塑造我們世界的發現和想法的具有影響力的故事的未來。
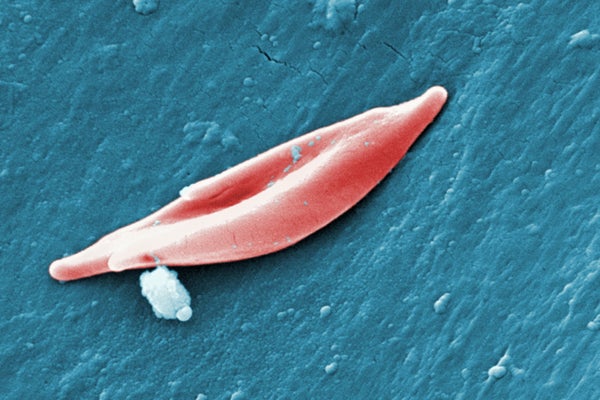
鐮狀細胞病是一種罕見的遺傳性疾病,其特徵是紅細胞呈異常鐮刀狀。這些畸形的紅細胞會堵塞血管,切斷身體組織的氧氣供應,導致劇烈疼痛和器官損傷。
根據美國國立衛生研究院的資料,美國約有 10 萬人患有鐮狀細胞病。
雖然 Endari 專注於減少鐮狀細胞病的併發症,但 Bluebird Bio 正在開發一種基因療法來治療該疾病的根本原因並可能治癒患者。使用 CRISPR 基因編輯技術的研究旨在實現相同的目標。
其他致力於開發針對鐮狀細胞病的新型藥物的公司包括 Global Blood Therapeutics 和 Novartis。