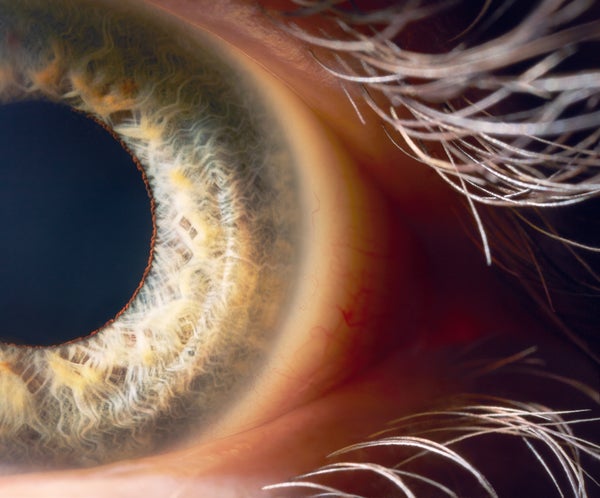
美國食品藥品監督管理局週二批准了一種首創的基因療法,用於治療一種罕見的、遺傳性的兒童失明。
Spark Therapeutics 公司的Luxturna獲得 FDA 的上市許可,在科學和經濟方面都具有歷史意義。Luxturna 是美國批准的首個針對特定基因突變引起的疾病的基因療法。
Spark 發言人表示,公司將在 1 月初才會公佈 Luxturna 的價格。華爾街分析師預計該基因療法的價格將達到 100 萬美元,這也是一個首例,但不一定受歡迎。在藥品價格受到嚴格審查的時候,Spark 需要說服保險公司、政界人士和製藥批評家,Luxturna 為患者帶來的益處足以證明其高昂的成本是合理的。
關於支援科學新聞
如果您喜歡這篇文章,請考慮透過 訂閱來支援我們屢獲殊榮的新聞報道。 透過購買訂閱,您將有助於確保有關當今塑造我們世界的發現和想法的具有影響力的故事的未來。
臨床與經濟審查研究所 (ICER) 是一個有影響力的非營利組織,負責研究新藥的成本效益,它將於 1 月 25 日舉行會議審查 Luxturna。
美國食品藥品監督管理局局長斯科特·戈特利布在一份宣告中說:“今天的批准標誌著基因治療領域又一個首例——無論是在治療方式上,還是在將基因治療的使用範圍從癌症治療擴大到視力喪失的治療方面——這一里程碑也加強了這種突破性方法在治療各種具有挑戰性的疾病方面的潛力。”
與其他基因療法一樣,Luxturna 將一個功能性的 DNA 片段插入細胞中,以替換或覆蓋有缺陷的、致病的基因。對於 Spark 來說,注射部位是患有由一種名為 RPE65 的基因突變引起的遺傳性視網膜疾病的人的眼睛,其中大多數是兒童和年輕人。出生時就帶有突變 RPE65 基因的人會遭受嚴重的視力問題,包括夜盲症。隨著疾病的進展,人們會失去所有功能性視力,最終可能會完全失明。
Luxturna 在技術上不是治癒方法。手術注射——每隻眼睛一次——旨在阻止疾病進展並恢復一些功能性視力。
據彭博社報道,華爾街分析師平均預測,2018 年 Luxturna 的銷售額為 7800 萬美元,到 2019 年將增至 2.38 億美元,峰值將達到 4.45 億美元。然而,由於 Luxturna 的價格和報銷存在不確定性,這些估計的準確性比正常情況要低。
在 FDA 宣佈這一訊息後,Spark 的股價上漲了 4%,達到 50.82 美元。