CRISPR,這項革新了生物研究的基因編輯技術,終於在獲得監管批准後成為一種醫療手段。12月8日,美國食品和藥物管理局批准了首個CRISPR療法,用於治療鐮狀細胞病。
該療法名為exa-cel,由Vertex和CRISPR Therapeutics公司生產,它編輯一個與紅細胞形狀和功能相關的基因。該療法似乎在功能上治癒了該疾病至少一年。FDA的決定使美國成為繼英國在11月批准exa-cel用於治療鐮狀細胞病之後,第二個批准CRISPR療法的國家。
範德堡大學血液學家邁克爾·德保恩表示,從科學角度來看,exa-cel是“一項令人難以置信的資產”。但他補充說,現在判斷該療法是否具有永久性且無副作用還為時過早。
關於支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您將幫助確保未來能夠繼續報道有關塑造我們當今世界的發現和思想的具有影響力的故事。
FDA今天還批准了另一種用於治療鐮狀細胞病的基因療法,名為lovo-cel,由bluebird bio公司生產。
什麼是鐮狀細胞病?新型CRISPR療法是如何起作用的?
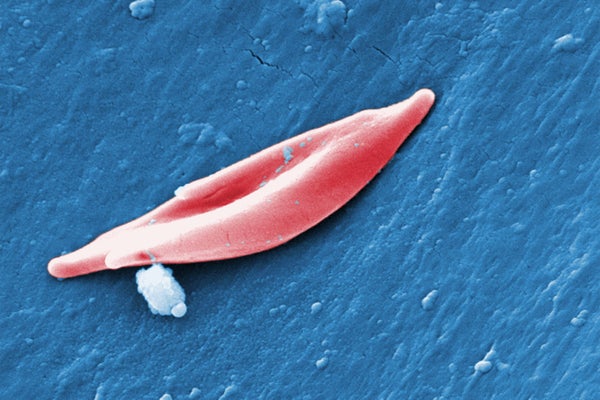
exa-cel中使用的CRISPR系統靶向產生血紅蛋白的基因,血紅蛋白是血液細胞中攜帶氧氣的蛋白質。在一種稱為鐮狀細胞貧血症的鐮狀細胞病中,HBB基因的突變會影響蛋白質的結構,導致其將通常為圓形的紅細胞扭曲成彎曲的鐮刀形狀。這些鐮狀細胞會堵塞血管,導致劇烈疼痛和疲勞。在一種相關的疾病,即β-地中海貧血症(有時與鐮狀細胞貧血症同時發生)中,身體無法產生足夠的血紅蛋白或紅細胞,導致低血氧水平引起的症狀。這些症狀包括疲勞和兒童生長問題。
Exa-cel引導一種名為Cas9的酶到一個名為BCL11A的基因,該基因通常阻止身體產生一種僅在胎兒中發現的血紅蛋白。Cas9透過切割BCL11A的DNA,使其在骨髓幹細胞(紅細胞的產生地)中失活,細胞開始產生胎兒血紅蛋白並建立具有正常圓形形狀的紅細胞。在新療法中,醫生取出患者自身的骨髓幹細胞,用exa-cel對其進行編輯,破壞患者剩餘的未經治療的骨髓,然後重新輸注編輯後的細胞。
由於這些編輯後的細胞最終會重新populate身體,exa-cel被認為是一種“治癒性”療法,理論上將持續接受者餘生,儘管Vertex和CRISPR Therapeutics對他們的大部分試驗參與者的隨訪時間不到兩年。
治療效果如何?
到目前為止,exa-cel僅在約100名患有鐮狀細胞貧血症或β-地中海貧血症的人身上進行了測試。儘管如此,FDA在2019年還是給予了這些公司“快速通道”批准,允許他們在比通常要求更小的人群中測試該療法。
在這些仍在進行的試驗中,30名鐮狀細胞貧血症研究參與者中有29人在接受exa-cel輸血後的18個月內,一年內沒有疼痛。42名β-地中海貧血症患者中有39人在接受exa-cel干預後一年內不再需要輸血或骨髓移植(該疾病的標準治療方法)。Vertex和CRISPR Therapeutics正在繼續追蹤尚未達到此時點的剩餘參與者,並將對所有參與者進行長達15年的隨訪。
有哪些風險?
提交給FDA的結果表明,exa-cel沒有重大的不利健康影響,儘管它可能會引起噁心和發燒等副作用。但德保恩指出,參與者僅被追蹤了很短的時間,問題可能會在以後出現。
FDA提出的另一個擔憂是,Cas9酶可能保持活性並在BCL11A以外的位點切割基因組,從而產生所謂的脫靶突變。這些公司模擬了酶可能切割的基因組中最可能的位置,但沒有發現證據表明這在試驗參與者中發生過。“鑑於任何新療法,我們仍然保持謹慎樂觀,”德保恩說。
除了exa-cel,還有哪些其他有前景的鐮狀細胞病療法?
Bluebird bio的lovo-cel是今天獲得FDA批准的另一種基因療法,它使用病毒載體遞送成人血紅蛋白生成基因的功能版本,並將其永久插入人體基因組。Bluebird bio提交給FDA的資料顯示,lovo-cel對36名受試者有效,這些受試者接受了平均32個月的隨訪。數十項研究正在調查其他型別的鐮狀細胞貧血症和β-地中海貧血症基因療法,這些療法將正常版本的HBB或其他基因遞送到體內。
研究人員發現,一種稱為半相合移植的技術也可以治癒鐮狀細胞貧血症。在這種療法中,人的骨髓細胞被替換為來自父母或兄弟姐妹的骨髓細胞,後者在基因上與接受者有50%的相同,但沒有該疾病。這種療法已廣泛用於治療某些癌症。將在下週美國血液學學會年會上公佈的結果顯示,88%接受這些移植的成年人在兩年後繼續產生正常的紅細胞。德保恩表示,這項技術在低收入和中等收入國家可能特別有用,因為它可能比基因編輯或基因療法便宜得多。
exa-cel或lovo-cel是否適用於所有鐮狀細胞病患者?
與大多數基因編輯療法一樣,exa-cel和lovo-cel可能非常昂貴。Vertex、CRISPR Therapeutics和bluebird bio均未說明各自療法的費用,但估計每種療法的價格可能高達每位患者200萬美元。目前尚不清楚保險公司,特別是醫療補助等政府服務機構,是否會承保這些療法,或者在哪些情況下會承保。鐮狀細胞病對非洲裔人口(包括非裔美國人)的影響尤為嚴重,與美國大多數其他群體相比,他們更有可能透過醫療補助獲得公共保險。
德保恩表示,決定是採用CRISPR基因編輯還是其他方法(如半相合移植)需要由患者、其家人和醫生共同決定。即使基因編輯被證明在永久治癒該疾病方面更有效,它也可能不如供體移植那樣普及,並且可能需要更長的時間。
儘管如此,德保恩表示,exa-cel是一個良好的開端,他預計隨著未來十年對CRISPR療法的瞭解不斷深入,這項技術將得到改進。“這只是馬拉松的第一英里,”他說。