新加坡、臺灣和香港在限制嚴重急性呼吸綜合徵冠狀病毒 2 (SARS-CoV-2) 的影響方面取得了非凡的成功,這表明透過對大流行準備工作的大量投資,有可能對疫情做出有效反應。儘管與中國鄰近,但這三個地區已設法將病例數和死亡人數保持在較低水平。透過從先前這些地區首當其衝的冠狀病毒爆發中吸取教訓,他們能夠迅速部署廣泛的檢測,將其與數字監控相結合以追蹤個人的活動,並在可疑病例中實施嚴格的隔離,此外還建立了大量的個人防護裝備儲備。
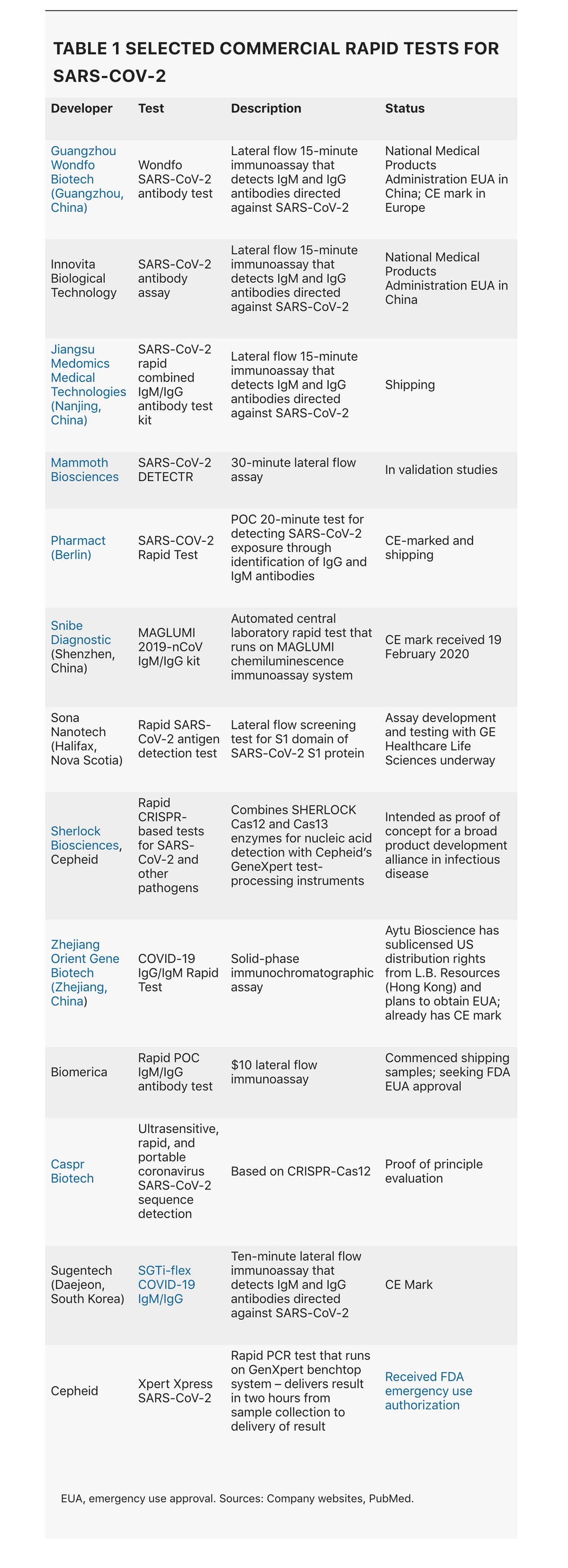
在世界其他地方,大多數國家都對病毒的猛烈襲擊毫無準備。因此,在有足夠的檢測來允許隔離和追蹤之前,許多醫療保健系統已經面臨社群傳播。儘管公共衛生部門採取了嚴厲的措施和隔離策略,但在驗證、實施和分發 SARS-CoV-2 診斷測試以及建立分散的即時(POC)檢測方面,許多部門都措手不及。現在,這種情況開始發生變化,第一批此類測試(表 1)已經開始運送。更重要的是,目前的危機可能是基於 CRISPR 技術的診斷方法的一個決定性時刻——基於 CRISPR 基因編輯技術的第一個診斷測試可能僅需幾周即可問世。然而,為了阻止病毒傳播,需要大規模努力擴大易於使用的 POC 測試的生產,然後廣泛部署它們。
到目前為止,對 SARS-CoV-2 爆發的第一線反應是聚合酶鏈反應 (PCR) 檢測。PCR 是診斷傳染性病原體的金標準,它的優勢在於,一旦已知病毒序列,就可以相對快速地生產此類檢測所需的引物。世界衛生組織 (WHO) 於 1 月份在識別出該病毒後不久,設計並分發了第一批用於檢測 SARS-CoV2 的定量逆轉錄酶 PCR (RT-PCR) 檢測。然而,該測試協議複雜且昂貴,主要適用於大型集中式診斷實驗室。測試通常需要 4-6 小時才能完成,但運輸臨床樣本的後勤要求意味著週轉時間最快也要 24 小時。在美國,美國疾病控制中心選擇開發自己的測試,而不是採用世界衛生組織的測試。美國食品和藥物管理局在授權公共衛生或醫院實驗室執行測試方面的拖延,疾病控制中心在 2 月初開發和分發的初始 RT-PCR 測試中使用的一種試劑出現故障,以及 RNA 提取試劑的短缺,進一步延遲了全國範圍內的測試推廣。
關於支援科學新聞
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您將有助於確保有關當今世界重大發現和塑造我們世界的想法的有影響力的故事的未來。
儘管存在這些缺點,但多重 RT-PCR(同時檢測多個目標序列)仍將是檢測的支柱,尤其是在集中式實驗室中。羅氏診斷、賽默飛世爾科技、凱傑(即將被賽默飛世爾收購)和奎斯特診斷等大型供應商正在透過推出自動化 SARS-CoV-2 檢測系統和服務來提高執行此類檢測的能力。
還需要 POC 測試來加速臨床決策並減輕集中式測試實驗室的一些工作量。上個月在日內瓦召開的世界衛生組織專家組確定了在社群層面使用的快速 POC 測試是八項研究優先事項中的第一項。支援向低收入國家開發和交付診斷方法的日內瓦非營利組織創新新診斷基金會 (FIND) 正在透過邀請化驗開發人員提交其產品進行獨立評估來幫助這項廣泛的努力。它已收到 220 份提交的材料,正在進行評估,並將在本月底之前與符合條件的製造商聯絡。FIND 還編制了一份廣泛的 SARS-CoV-2 診斷開發人員名單,其中主要是開發基於 PCR 的核酸檢測或免疫分析的公司。新加坡國立大學邵逸夫公共衛生學院也在密切跟蹤商業公司和學術實驗室的診斷開發情況。
免疫分析可以提供有關病毒暴露的歷史資訊以及診斷證據。它們利用抗體-抗原識別,或者透過使用單克隆抗體 (mAb) 檢測臨床樣本中的病毒抗原,或者透過使用克隆的病毒抗原檢測患者針對該病毒的抗體。側向流動分析形式(本質上是一個裝在盒式磁帶中的試紙)包含固定在硝化纖維素膜上特定位置的捕獲試劑(針對病毒抗原的 mAb 或患者抗體識別的病毒抗原),以及識別相同目標的標記檢測器 mAb。陽性結果是由分析物與捕獲 mAb 之間的結合以及檢測器 mAb 的結合觸發的,可見為一條彩色線。從針刺中取出的兩滴血就足以檢測到病毒。它們本質上與家用驗孕試劑盒相同。
然而,PCR 和免疫分析技術都不是理想的。PCR 測試非常準確,可以快速開發,但它們使用複雜,並且交付結果的速度很慢。免疫分析的準確性較低,開發時間較長,但它們易於使用,並在 20-60 分鐘內提供結果。而且,由於免疫分析檢測患者對病原體的抗體,因此它們必然必須應對多克隆人類抗體反應的固有變異性。“這種抗體反應需要時間來表徵,”FIND 首席科學官 Ranga Sampath 說。因此,在驗證測試期間獲得的結果不一定能在臨床環境中複製。“這些測試往往不是最終的——這是免疫分析的最大挑戰,”他說。
即便如此,免疫分析的速度和多功能性使其成為寶貴的測試;而且大規模生產它們的努力正在開始加強。臺灣台北中央研究院基因組研究中心的研究員楊安遂及其同事聲稱是第一個開發出針對 SARS-CoV-2 核衣殼 (N) 蛋白的 mAb 的人,該 mAb 可以構成快速抗原測試的基礎。它還產生了識別 SARS-CoV-2 和原始 SARS-CoV N 蛋白或僅 SARS-CoV N 蛋白的其他抗體。沒有 mAb 與其他人類冠狀病毒株的核衣殼蛋白結合。“如果成功製造和驗證,快速的基於免疫的檢測試劑盒可以在 20 分鐘內檢測出冠狀病毒抗原,而無需儀器和經過培訓的人員,其成本和效用與快速流感 LFIA [側向流動免疫分析] 測試相當,”他說。楊的團隊僅用了 19 天就完成了這項壯舉,他們使用了抗體-抗原相互作用的人工智慧模型,他們用它來生成人工抗體庫。預測的抗體 DNA 可以化學合成,並且可以在細菌中的噬菌體展示系統中表達產生的 mAb。避免免疫動物以獲得單克隆抗體,然後必須對其進行結合活性分類(傳統方法)可將通常的時間縮短大約兩個月。該小組目前正在開發 LFIA 裝置的原型,但也希望將抗體組授權給第三方。
對於其免疫分析,位於新斯科舍省哈利法克斯的 Sona Nanotech 選擇了 SARS-CoV-2 刺突蛋白的 S1 域作為其正在與 GE Healthcare Life Sciences 合作開發的基於抗原的 LFIA 的基礎。刺突 (S) 蛋白透過結合表達在其表面的血管緊張素轉換酶 2 (ACE2) 來促進病毒進入氣道上皮細胞。“我們預計將在未來六到八週內推出僅供研究使用的產品,”執行長 Darren Rowles 說。除此之外,該公司還計劃為下一個北半球流感季開發一種雙重產品,該產品將在單次測試中結合 SARS-CoV-2 和流感病毒檢測。
與檢測病毒本身的測試相比,檢測患者體內針對 SARS-CoV-2 的多克隆抗體的測試開發速度更快,因為它們僅包含固定的重組病毒抗原(比針對該病毒的 mAb 更容易產生)。它們還提供與基於 mAb 的測試相似的準確度水平。
總部位於柏林的 Pharmact 已經開始發運一種 20 分鐘的免疫分析,其中包含三種 SARS-CoV-2 抗原:N 蛋白以及 S 蛋白的 S1 和 S2 域。它旨在檢測任何識別這些蛋白質結構的患者抗體。其目標是在 4 月份將產量擴大到 100 萬次測試。與此類測試的典型情況一樣,它檢測在感染的初始和後期分別釋放的免疫球蛋白 (Ig) M 和 IgG 抗體。它進行了驗證研究,將測試結果與 PCR 進行了比較,使用了來自 114 名感染患者和 126 名未感染對照的樣本。該測試在特異性方面得分很高。“我們的真陰性率為 100%——零假陽性,”Pharmact 的醫學主任 Gunther Burgard 說。然而,它的靈敏度較低,因為 IgM 反應沒有提供強烈的初始訊號。在感染的早期階段(第 4-10 天),該測試的 IgM 部分的靈敏度僅為 70%。在第 11 天到第 24 天之間,靈敏度迅速上升到 92.3%,並且在該感染階段,該測試的 IgG 部分的靈敏度為 98.6%。Burgard 說,總體而言,該測試的假陰性率為 13%。
將分散式檢測與流行病學監測相結合,將進一步增強公共衛生部門對抗 SARS-CoV-2 爆發的能力。由華盛頓大學領導的西雅圖流感研究正在將一種創新方法應用於當前的危機,該方法旨在在全市範圍內追蹤季節性流感爆發。出現呼吸道症狀的參與者可以電子方式請求鼻拭子試劑盒,該試劑盒由快遞員送達。招募、同意和資料收集均以電子方式進行,但該協議依賴於集中式實驗室檢測,而不是即時檢測(POC)。在芬蘭,一項研究表明,透過將自動化即時檢測與實驗室資訊系統相結合,可以實現即時流行病學監測。由芬蘭圖爾庫的 ArcDia 公司開發的即時檢測系統 mariPOC Respi 現在透過雲傳輸資料。它目前涵蓋十一種呼吸道病原體,包括十種病毒(其中包括冠狀病毒 OC43,三種僅引起輕微疾病的人類冠狀病毒之一)和一種細菌。該公司現在計劃在幾個月內將 SARS-CoV-2 納入其檢測範圍。mariPOC Respi 系統不是高通量裝置:它依賴於一臺臺式分析儀,每天可以處理大約一百個樣本,但試劑成本約為 PCR 檢測的三分之一。它主要面向社群環境,例如大型初級保健中心。儘管它在芬蘭擁有 50% 的市場份額,但到目前為止在其他地方的普及程度有限。“核心實驗室更喜歡多重 PCR,”ArcDia 公司戰略與業務發展高階副總裁 Aleksi Soini 說。這些設施的負責人是診斷領域的意見領袖,他們不願放棄對分散式檢測制度的控制權。“這是一個結構性問題,”Soini 說。Scanwell Health 正在準備推出一種更加分散的檢測——一種送貨上門的免疫測定和配套的智慧手機應用程式,這將允許使用者與醫生或執業護士分享結果。它已獲得中國唐山 Innovita Biological Technology 公司的抗體免疫測定的美國權利(表 1)。
當然,PCR 是基於現在已經有幾十年的科學發展而來的。Mammoth Biosciences 和 Sherlock Biosciences 是分別由 CRISPR 先驅 Jennifer Doudna 和 Feng Zhang 共同創立的公司,它們都旨在透過利用 CRISPR-Cas 編輯的特異性和敏感性來開發快速的 POC SARS-CoV-2 檢測,從而在實現真正的 POC 檢測速度的同時,達到 PCR 的準確性。Mammoth 的科學家與來自加利福尼亞大學舊金山分校和加利福尼亞州公共衛生部的合作者最近報告了其 SARS-CoV-2 DETECTR 的設計和效能,該檢測是一種橫向流動檢測,耗時 30 分鐘——或者包括 RNA 提取步驟在內大約 45 分鐘。該測試採用病毒 RNA 的同步逆轉錄和環介導擴增,這是一種簡化的核酸擴增技術,使用 PCR 式引物,但不需要重複的加熱和冷卻迴圈。然後將擴增的核酸與靶向 SARS-CoV-2 包膜 (E) 和 N 基因序列的引導 RNA (gRNA) 分子以及 lbCas12a 酶一起孵育,該酶在 gRNA 介導的靶位識別後,會無差別地切割附近的單鏈 DNA (ssDNA)。這允許新增基於 ssDNA 的報告分子,以確認病毒 RNA 的存在。
根據對來自 6 名感染 SARS-CoV-2 的患者、來自 12 名感染季節性流感或引起輕微症狀的三種冠狀病毒毒株(OC43、HKU1 和 NL63)的患者以及來自 5 名健康志願者的樣本進行的 RT-PCR 初始驗證測試,該檢測的陽性預測值為 100%,陰性預測值為 91.7%。“我們正處於額外驗證的中間階段,”Mammoth 聯合創始人兼執行長 Trevor Martin 說。該公司旨在儘快運送該檢測。“在理想情況下,是幾周,而不是幾個月,”他說。它被專門設計為具有簡化的試劑,以便於製造。“除了 CRISPR 蛋白本身之外,你使用的東西沒有太特別的地方,”他說。凍幹試劑並開發用於執行測試的行動式微流控晶片盒將使其能夠在實驗室環境之外進行部署。
Sherlock Biosciences 也在研究幾項 SARS-CoV-2 計劃。“擁有快速部署的技術是一回事,”Sherlock 執行長兼聯合創始人 Rahul Dhanda 說,但“要將一項檢測推向市場,需要的不僅僅是讓檢測起作用。”該公司旨在利用合作伙伴來獲得他們的監管專業知識以及製造和分銷能力。它已與 Cepheid 建立了聯盟,為一系列傳染病(包括 COVID-19)開發基於 CRISPR 的檢測,這些檢測將在後者的 GeneXpert 自動化分子診斷系統上執行。在當前危機爆發之前,雙方已經在討論合作關係,但將 SARS-CoV-2 納入其中是顯而易見的一步。鑑於當前危機的緊迫性,Sherlock 也在調查是否可以在更短的時間內將更簡單的檢測推向市場。“我們開始與試劑盒製造商接觸,以確定我們是否可以組裝一個試劑盒,”Dhanda 說。“我們需要考慮的是急性反應和全面的應對措施。”
鑑於當前大流行病發展軌跡的不確定性,目前尚不清楚 CRISPR 技術是否將為全球追蹤 SARS-CoV-2 進展的努力做出重大貢獻。但對這種技術的需求似乎迫在眉睫。“這暴露了分子診斷市場的一個巨大差距,”Martin 說。這只是大多數國家為應對病毒大流行病所做的準備工作中的眾多差距之一。
本文經許可轉載,於 2020 年 3 月 24 日首次發表。
在此處瞭解更多關於冠狀病毒爆發的資訊。
