生物學家長期以來一直在研究基因,以瞭解生命之樹分支的歷史,這棵樹將地球上所有生物——無論是狨猴還是微生物——聯合起來。在這棵龐大的祖先樹上,猿類中依偎著一片葉子,那就是智人。我們物種中的每個個體都是細胞的集合,這些細胞協同作用以生成我們的身體。
通常,細胞遵守一項契約,這項契約是在6億多年前的多細胞生命最初形式中透過反覆試驗建立的。該契約規定,如果細胞要共同生活,它們必須遵守基本規則:修復受損的DNA;聽取鄰居關於是否分裂的意見;並留在它們應該在的組織中。通常情況下,導致細胞違反這些限制並開始持續生長和擴散的突變——惡性癌症的標誌——會被受控死亡所壓制。突變細胞會檢測到自身的問題並啟動自殺程式,或者在它們造成任何傷害之前被免疫系統殺死。
然而,有時會積累一些突變,細胞監視系統對這些突變不起作用,腫瘤會生長和擴散。一個惡性的進化樹在內部萌芽。
支援科學新聞事業
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞事業 訂閱。透過購買訂閱,您正在幫助確保關於塑造我們今天世界的發現和想法的具有影響力的故事的未來。
研究人員知道一些驅動腫瘤發生(即初始腫瘤的形成)的突變。然而,使癌症特別緻命的是轉移,即病變細胞從原發腫瘤逃逸到以前健康的組織中,並在那裡駐留以產生新的腫瘤。由於認為需要進一步的突變才能推動轉移,並且這些突變相對較晚才發生在原發腫瘤的歷史中,因此腫瘤學家經常試圖識別它們並用藥物靶向它們。
然而,大約在2010年,技術進步使科學家能夠廉價地對整個人類基因組進行測序(即,推斷基因組的鹼基排序,或DNA的組成單元)。幾家機構的研究小組開始全面研究腫瘤的基因序列。令他們沮喪的是,研究人員發現,即使在單個患者體內,腫瘤通常也包含令人困惑的多種突變。
然而,像我這樣的進化生物學家將多樣性視為寶貴資訊的來源。我與耶魯大學和其他機構的同事一起,決定研究這些突變是如何相互關聯的。我們對癌症患者的基因組表達部分(已知控制蛋白質生產並因此決定細胞特性的DNA片段)進行了測序。此外,我們使用該資訊建立了與該疾病相關的突變的進化樹。這些樹的分支說明了腫瘤內的基因如何隨著癌症從少數細胞生長成轉移性怪物而發生變化。
錯綜複雜的分支
我們的研究表明,將原發腫瘤與患者體內轉移灶連線起來的分支大量且看似隨機地從彼此中 Sprout 出,就像神話中的毒樹的分支一樣。更令人驚訝的是,這棵進化樹的第一個分支可以從原始腫瘤球的深處出現。原發腫瘤中不同的細胞可能已經準備好進化成更具侵略性的形式——每種形式都有其自身的傳播遺傳機制——早在最初的腫瘤首次被診斷出來之前很多年。
這些發現令人恐懼,但也帶來了新的希望。它們暗示,癌症研究人員應該優先研究在原發腫瘤或種子中早期改變的基因,而不是專注於後期的突變,原發腫瘤或種子是癌症樹的誕生之源。用藥物靶向這些突變基因可能會給患者帶來更好的康復機會。
線性模型指導癌症研究數十年。它指出,一系列特定的突變導致腫瘤發生。只有在那之後,原發腫瘤中的一些細胞才會獲得一種或多種進一步的突變,從而賦予轉移的能力。如果可以構建突變的進化樹,它將類似於典型的草:高而直,並擁有一個單一的核心,從這個核心的頂部附近,會冒出一些葉子和種子。
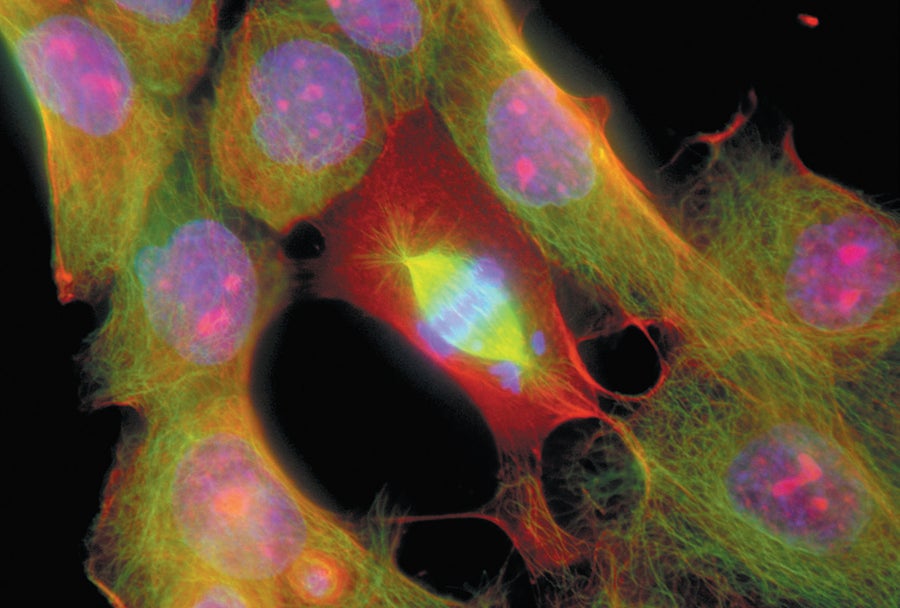
轉移性肝癌細胞,在偏振光顯微照片中可見。中心是一個分裂的細胞。圖片來源:Jennifer C. Waters 科學來源
這種理論與進化生物學家對生命形式歷史的瞭解不符。持續的突變和選擇推動生物體不斷地彼此分化,產生遺傳譜系的多樣性,而不是單一的同質種群。事實上,倫敦癌症研究所的馬可·格林格 (Marco Gerlinger) 和其他人的早期研究暗示,即使在原發腫瘤內,腫瘤細胞的不同區域也具有不同的基因序列。
2010年,我在耶魯大學公共衛生學院的實驗室成員和我,連同耶魯大學醫學院的病理學家大衛·裡姆 (David Rimm)、遺傳學家理查德·利夫頓 (Richard Lifton) 和藥理學家約瑟夫·施萊辛格 (Joseph Schlessinger),著手回答以下觀察結果提出的三個問題。首先,是否有一種或多種特定的突變是轉移所必需的,並且存在於所有患者中?其次,轉移譜系是否可以在原發腫瘤歷史的早期,在大多數突變積累之前相對較早地分化?第三,如果我們在原發腫瘤和轉移灶中發現了突變的多樣性,我們能否使用進化樹來計算它們傾向於何時發生?回答這些問題將揭示導致原發腫瘤及其轉移灶誕生的遺傳軌跡。
毒果
我們不知道我們的進化工具會變得多麼強大。裡姆從40名死於13種不同型別癌症的患者身上獲得了原發性和繼發性腫瘤的屍檢組織,以及來自受累器官附近健康部分的組織。對於每個樣本,我們的團隊對已知在任何組織和任何時間表達的基因組所有部分進行了測序。我們的研究揭示了患者的種系或正常基因序列(他或她從單個受精卵遺傳而來)與一個或多個癌組織樣本之間存在數十到數千種不同的突變。
為了理解這些樣本是如何相互關聯的,當時我在實驗室的博士後研究員趙子明構建了分子進化樹。這種型別的樹用於理解我們與黑猩猩、大猩猩和猩猩的關係;猿類與其他哺乳動物的關係;哺乳動物與鳥類和其他動物的關係;以及動物與真菌、植物和細菌的關係。科學家透過比較生物體的性狀(或其DNA中的鹼基序列)在不同物種之間如何分化,並找到最合理的圖表來計算這些樹,其中每個有問題的生命形式都在樹的分支上佔有一席之地。
然而,將這些技術應用於癌症是很棘手的。通常,我們只使用當前的序列作為資料,並利用這些資訊弄清楚我們能瞭解到的關於祖先的資訊。然而,在癌症樹中,我們知道祖先的序列:它是從健康組織獲得的種系序列。如果不進行修改,傳統方法會假設正常序列是一個額外的“後代”譜系——產生的樹無法反映我們感興趣的歷史。我們修改了經典方法,要求健康組織的基因序列成為原發和轉移譜系的祖先,並計算了最有可能解釋變化演替的樹。
這些重新定向的進化樹揭示了一些驚人的東西。根據長期以來的線性模型,所有轉移灶都將從一個細胞譜系衍生而來,該譜系從原發腫瘤中脫離出來並擴散到其他部位。如果轉移確實以這種方式發生——源於DNA變化的單行佇列中的最終突變——我們預計從每個繼發性腫瘤衍生的基因序列將比原發腫瘤的任何部分更密切地與其他繼發性腫瘤的基因序列相關。
這不是我們看到的。當我們開始研究腫瘤“樹”時,我們發現一些患者的原發腫瘤組織與某些轉移組織密切相關,但與其他轉移組織無關。這一發現暗示,並非一個,而是原發腫瘤內的多個遺傳譜系在某些時候發生了轉移。事實上,這種模式在我們核心的、解析良好的樹集中出現超過三分之一的時間。
時間樹
我們震驚地意識到,經典的線性模型與實際資料不符。證據表明,不是單一的罕見事件誘發轉移,而是啟動腫瘤增殖的早期基因變化也與譜系的轉移能力有關。
此外,在進化為轉移灶的細胞譜系中,我們無法指出任何單個基因是罪魁禍首。除了已知驅動腫瘤發生的關鍵基因(例如KRAS基因,幾乎所有胰腺癌患者的原發腫瘤中都發生了突變)之外,在轉移組織中沒有在多名患者中發生突變的特定基因。事實上,在導致繼發性腫瘤的分支中發現的突變與從未離開原發腫瘤的譜系中的突變無法區分。除了突變之外的其他因素,例如原發腫瘤細胞中的表觀遺傳變化(基因表達方式的改變)——或其微環境的細節——更可能是轉移的原因。
.png?w=777)
圖片來源:Matthew Twombly
原發腫瘤細胞簇中的表觀遺傳修飾,例如偶然暴露於致癌物,可能會增加細胞遷移的傾向。與細胞的其他型別相關的特定細胞的位置也很重要。例如,一些腫瘤細胞可能會透過身體擴散,因為它們恰好靠近血管或淋巴管,而其他具有相同突變的細胞可能不會,因為它們不夠靠近。這些可能影響轉移的其他因素可能與我們的進化樹中顯示的後期突變幾乎或完全無關。
一旦明確原發腫瘤內的不同譜系有時會產生不同的轉移灶,我們就想知道這些轉移譜系在患者一生中的哪個早期階段分化。我們的分子進化樹無法回答這個問題:分支的長度對應於區分癌症不同部分(例如原發腫瘤和轉移灶)的突變數量,而不是真即時間。它們沒有告訴我們一個腫瘤產生另一個腫瘤需要多長時間。
我們想知道是否可以使用進化生物學的另一種技術——時間樹的構建——來了解癌症在人體內進展的歷史。與分子進化樹相反,時間樹中分支的長度衡量的是一個生物從另一個生物進化之前經過的時間量。這種圖表透過比較感興趣的性狀(例如基因序列)並將它們與時間資訊(例如突變率)相結合而獲得,使科學家能夠測量關鍵變化發生的時間。例如,它們已被用於化石資料,以揭示寒武紀大爆發的時間,當時各種多細胞生命在近5.5億年前出現。
當然,我們沒有埋藏的化石來校準某人一生中的癌症進化。然而,我們可以做得更好。在許多情況下,我們有在屍檢前提取的原發組織。此外,我們還有每個病例的醫療記錄——提供出生日期、診斷日期、活檢日期、腫瘤手術切除日期和屍檢日期。這些日期充當校準點。例如,癌症不可能在出生年份之前起源,並且肯定在原發腫瘤被診斷出來時就已存在。來自活檢的組織,以及已提取的腫瘤組織,為我們提供了癌症進化的快照。相應的日期使我們能夠計算突變率。我們還訪問了放射科醫生過去收集的關於原發腫瘤中細胞典型分裂速率的已發表資料。(放射科醫生收集這些資訊是為了衡量透過放射療法摧毀腫瘤所需的輻射量。)
當時我在實驗室的另一位博士後研究員阿蒂拉·伊亞馬裡諾 (Atila Iamarino) 使用所有這些資訊將分子進化樹變成了時間樹。我們第一次瞥見了癌症的進化如何與患者的壽命以及他或她接受治療的時間長短相關。例如,我們可以估計癌症細胞與健康組織區分開來的第一個基因突變何時出現。在年輕患者中,這種分化通常發生在診斷前幾年;在年長患者中,這可能發生在幾十年前。
根深蒂固
從基因上區分腫瘤組織和正常組織的第一個突變通常在癌症確診前幾年——有時甚至幾十年——就出現了。同樣令人不安的是,在我們的十分之九的研究物件中,至少有一個轉移譜系在那時已經分化。在七個病例中,這個惡性分支在原發腫瘤起源的時間比患者死亡的時間更早地從樹幹上分離出來。
這些觀察結果讓我們感到意義重大。進行轉移的細胞可以在癌症的進化和時間歷史的早期從原發腫瘤中的其他細胞中進行基因分化。事實上,早到它們經常在原發腫瘤被診斷出來之前就已經分化。
我們曾希望識別出關鍵的轉移誘導突變,這些突變將是藥物干預的合適靶點。然而,由於轉移譜系的遺傳學沒有什麼特別之處,我們將注意力從分支轉移到原始腫瘤的進化。我們想知道進化樹的樹幹是否在癌症的起源中起著特殊作用。為了回答這個問題,我們檢查了樹幹中的突變是否發生在DNA中,而DNA會改變已知在癌症中起作用的基因的細胞功能。
它們確實是。例如,眾所周知的腫瘤抑制基因p53(抑制細胞增殖)在許多患者的各種腫瘤的早期進化中發生了突變。原癌基因KRAS也是如此。(原癌基因是一種基因,如果發生突變,就會變成癌基因,從而促使細胞持續分裂。)例如,幾乎每位胰腺癌患者都在KRAS基因的第12位點發生了早期突變。
關鍵基因在癌症譜系根部的頻繁存在意味著它們在腫瘤的起源及其轉移中起著形成性作用。我們推測,隨著腫瘤發生的遺傳驅動因素的積累,轉移的可能性幾乎變成了一個數字遊戲:存在的癌細胞數量越多,它們發現自己處於某個位置或採用促進擴散的表觀遺傳狀態的可能性就越大。
還需要進一步的研究來闡明這些關鍵基因如何影響腫瘤發生和轉移的可能性。即便如此,早期的驅動因素值得加倍關注。靶向它們的藥物可能是癌症治療的關鍵——無論是在原發腫瘤的早期發展中還是在晚期癌症中。
再生
最近的臨床試驗表明,也有可能釋放人體自身的免疫系統來摧毀癌細胞。然而,對於靶向藥物和免疫療法,腫瘤似乎都會產生耐藥性。耐藥性是否像原發腫瘤一樣源於特定的突變?還是像轉移一樣,它是微環境和其他因素的症狀?我們尚不清楚,但進化樹可以闡明這個問題。
我們的時間樹研究表明,一些不太知名的、也被懷疑會驅動癌症的基因也發生了突變,但這些變化往往發生在疾病歷史的後期。也就是說,它們不在樹幹上,而是在癌症樹的分支上——因此這些基因的突變通常僅存在於患者的某些腫瘤中,而不存在於其他腫瘤中。因此,針對此類突變的療法(一些腫瘤學家可能更喜歡)可能會殺死突變的分支,但癌症樹的其餘部分將繼續增殖並威脅患者的生命。使用此類靶向藥物的醫生最好用旨在殺死其他型別癌細胞的治療方法來補充它們。
另一方面,如果一種藥物靶向存在於所有癌組織中的早期突變,則耐藥性可能源於具有特定新突變的細胞的生長。耶魯大學醫學院的病理學家卡特琳娜·波利蒂 (Katerina Politi) 及其同事已經確定了EGFR基因(另一種主要的癌症驅動因素,特別是肺癌)的變化——當發生突變時——確實在耐藥性中起著重要作用。為了瞭解耐藥性為何以及如何隨著患者接受治療而進化,我們的研究小組已開始使用進化技術。我們正在計算患者的癌症樹,並掃描導致耐藥組織的(例如複發性腫瘤)分支上的突變。令人興奮的是,我們的初步研究表明,耐藥性似乎確實是由可能源於患者正在接受的治療型別的基因變化驅動的。
每年,為靶向特定突變而開發的治療藥物數量都在增加,傳統化療、放療和免疫療法的複雜組合的處方潛力也在增加。腫瘤學家不再將一種型別的癌症視為同質疾病。相反,每個病例都是其自身的實體。研究個體患者的基因組學將對未來的癌症護理產生巨大影響。為了明智地使用這些新工具,腫瘤學家將不得不成為事實上的進化生物學家,檢查每位患者的癌組織中存在的遺傳變異,並設計一種摧毀癌症樹(包括根和分支)的策略。

