當談到 CRISPR 時,關於我們是否可以編輯人類胚胎的問題正在迅速讓位於更側重於“但我們應該這樣做嗎?”和“何時?”的討論,因為使用基因編輯技術的壯舉已經開始積累。
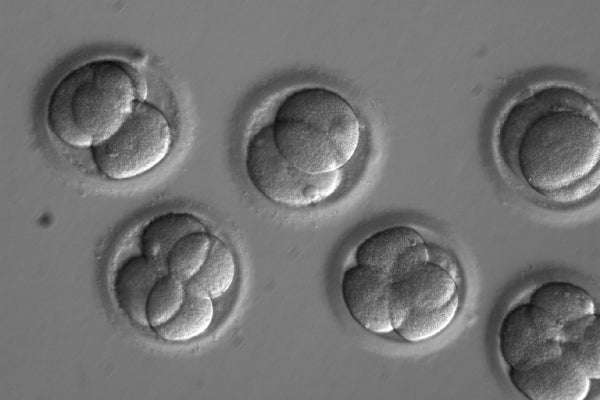
今天,俄勒岡州的生物學家在《自然》雜誌上報告說,他們在使用基因編輯技術改變早期、可存活的人類胚胎方面取得了前所未有的成功。這一進展使該領域遠遠超越了中國研究人員早期的嘗試,並強調了提出一些答案的需求——研究人員表示,而且要快。儘管美國食品和藥物管理局目前被禁止批准任何希望在懷孕期間使用這項技術的人,但《自然》雜誌的研究表明,這種工作是可能的,加州大學伯克利分校的生物化學家和 CRISPR 專家詹妮弗·杜德納說。但她和許多其他人表示,這將是不恰當地使用這項技術。“我並不完全反對所有人類種系編輯,”杜德納說,“但我認為需要有一個理由來做這件事,以證明風險和成本是合理的。”
俄勒岡健康與科學大學團隊編輯了數十個胚胎的 DNA,以糾正一種經常導致心力衰竭的基因突變。然後,他們使用基因組測序檢查了編輯後的胚胎,發現該過程沒有引起明顯的錯誤。該小組還設法幾乎完全消除了嵌合現象——一種編輯失敗,其中只有一些目標細胞被修復。“這些是每個人在早期胚胎工作中都擔心的事情,”哈佛醫學院 CRISPR 專家和遺傳學家喬治·丘奇說,他沒有參與這項工作。
關於支援科學新聞業
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞業 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們當今世界的發現和思想的具有影響力的故事的未來。
基因編輯的成功似乎很大程度上歸功於一個程式上的改變:研究人員在將攜帶突變的精子注入實驗室中健康的卵子中的同時,引入了編輯系統——酶 Cas9 和一個幫助編輯機制找到其目標的引導 RNA 序列—。這使得更早的編輯得以發生——顯然在任何細胞複製之前。這與中國其他研究小組早期的做法不同,他們是在精子使卵子受精後才引入編輯元件。“注射方案的這個小變化導致了比之前所有胚胎工作和細胞培養工作更好的結果,”丘奇說。
到目前為止,透過使用 CRISPR–Cas9 改變人類種系——人類胚胎、卵子或精子——來預防疾病仍然極具爭議,原因是擔心在不知不覺中引入錯誤或留下偷偷摸摸的、未編輯的致病突變,這將使後代面臨患病風險。到目前為止,CRISPR 尚未在美國的人類胚胎上進行過嘗試。但俄勒岡州的舒赫拉特·米塔利波夫和他的同事們比早期的中國工作更進一步,編輯了數十個胚胎,效率更高。
“這是未來趨勢的先兆,”同樣沒有參與這項工作的杜德納說。“這突顯了現在需要進行的重要討論,”她說。哈佛醫學院的幹細胞研究員兼院長喬治·戴利對此表示贊同:“這篇論文確立了我們可以進行胚胎基因編輯。現在的問題仍然是我們是否應該這樣做——以及為了什麼目的,是否應該允許某些應用而禁止其他應用?”
國家科學院、工程院和醫學院的專家工作組今年早些時候審議了這些有爭議的問題。它釋出了指導意見,稱除非在公眾對這項工作的安全性和優點達成廣泛共識的情況下,否則不宜進行任何人類種系編輯的臨床工作——而這尚未實現。美國科學院委員會指出,在嘗試推進諸如啟動妊娠之類的事情之前,還需要進行大量的研究。《自然》雜誌的這篇論文僅僅是該報告所考慮的研究的開始,威斯康星大學法學院的法學學者和生物倫理學家 R. 阿爾塔·查羅說,她曾共同主持美國科學院委員會,但表示她僅代表自己而非專家組發言。“瞭解基因編輯在人類胚胎中如何工作需要在人類胚胎中進行研究,”猶他大學的生物化學教授達納·卡羅爾指出,他研究 CRISPR,因為例如,小鼠胚胎具有物種特異性的發育差異。(米塔利波夫團隊只允許人類胚胎髮育到囊胚階段——即它們只有幾天大時——並且沒有嘗試將它們植入女性體內。)
在他們的研究中,米塔利波夫和同事們編輯掉了與肥厚型心肌病 (HCM) 相關的MYBPC3突變,這是一種影響約 500 人中 1 人的心肌疾病。即使是該突變的單個複製也可能導致疾病,約 40% 的 HCM 患者攜帶該突變。目前,通常可以透過植入前基因診斷(在實驗室中篩選胚胎)來發現問題基因,但他們表示,使用 CRISPR 可以增加可用胚胎的數量。此外,這種 CRISPR 技術最終可能成為一種重要的干預措施,適用於父母想要生育有基因血緣關係的孩子,但患有純合子疾病的情況——例如,父母雙方都攜帶兩個導致疾病的突變複製,例如導致鐮狀細胞病的突變——這將導致所有胚胎都受到該疾病的影響。
在 CRISPR 能夠解決純合子疾病之前,還有無數技術障礙需要克服。其中一個很大的障礙是:“並非所有人都瞭解 CRISPR 技術的工作方式——它會在 DNA 中切開,但它不負責修復——因此我們依賴細胞的基本機制來完成這項工作,”杜德納說。在最新的實驗中,米塔利波夫小組專注於剪除雜合子細胞中的突變基因——這種情況是仍然有一個“良好”的非突變複製可供胚胎中的天然細胞修復系統在研究人員編輯掉有問題的一個後用作修復模板。但在他們的工作中,該團隊注意到 CRISPR 在純合子疾病研究中可能存在一個障礙——一旦純合子突變被編輯掉,可能很難修復它們,因為它們沒有這些內建的藍圖來了解它們應該是什麼樣子。事實上,米塔利波夫小組發現,至少在他們的實驗中,細胞修復機制對研究人員新增的合成修復模板的引入反應不佳。杜德納認為,這表明未來的純合子研究將具有挑戰性——可能比科學家預期的要困難得多。