去年 12 月,一種名為 neratinib 的實驗性藥物的乳腺癌試驗引起了業界的關注,但引起轟動的原因不僅僅是這種藥物。
不尋常的是試驗本身。該試驗名為 I-SPY 2,它並行評估多種候選藥物,而不是通常一次評估一種藥物的做法。這種方法是改革藥物審批這一耗時且成本高昂的過程的眾多努力的一部分,該過程通常未能考慮到癌症生物學的複雜現實。
在 I-SPY 2 中,每種藥物都在腫瘤具有特定分子特徵的患者中進行篩選。該試驗在積累資料的同時“學習”,因此,它不是隨機地將新患者分配到治療組或對照組,而是利用早期結果來調整招募。Neratinib 由位於加利福尼亞州洛杉磯的 Puma Biotechnology 公司生產,只是正在測試的五種靶向化合物之一,所有化合物都旨在選擇性地阻斷參與腫瘤生長的訊號通路。
支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道: 訂閱。透過購買訂閱,您將有助於確保有關塑造我們當今世界的發現和思想的具有影響力的故事的未來。
藥物審批的標準途徑包括證明 I 期試驗的安全性、II 期試驗的臨床效果,然後進行 III 期隨機對照試驗 (RCT),以確認實驗性治療是否比目前的護理標準提供具有統計學意義的改善。RCT 促成了有價值的治療方法的發現,這些方法既能延長生存時間,又能提高生活質量。“我們早期確實取得了一些傑出的成功——比如兒童白血病,我們看到各種藥物的少量改進不斷累積,直到這種疾病變成通常可以治癒的疾病,”倫敦英國醫學研究委員會臨床試驗部門的醫學腫瘤學家理查德·卡普蘭說。
此後,抗擊癌症的進展有所放緩,但許多腫瘤學家充滿希望,認為它有望再次加速。由於對遺傳學和細胞生物學的更深入瞭解,細胞毒性化療這種不加選擇地靶向所有快速分裂細胞的鈍器,現在正在被專門為具有特定分子特徵或生物標誌物的腫瘤而開發的藥物所補充。但臨床研究設計尚未跟上步伐。許多 RCT 仍然傾向於採取廣闊的視角,對兩個大致相同的患者組中的藥物效能進行相對簡單的比較。但它們未能考慮個體遺傳學,這意味著它們可能會產生誤導性的結果。
以吉非替尼的故事為例,這是一種由倫敦阿斯利康公司開發的靶向藥物,以易瑞沙為商品名上市。在一些非小細胞肺癌 (NSCLC) 患者中顯示出早期希望後,該藥物在 2005 年的 III 期試驗中失敗(參考文獻 1)。該試驗的近 1,700 名患者並未根據其腫瘤突變譜進行選擇。“該公司採取了嘗試治療所有 NSCLC 的策略,”德克薩斯州休斯頓 MD 安德森癌症中心的生物統計學家唐納德·貝里說。“它希望這個小亞群的獲益能夠推動事情的發展。”該試驗的不良結果導致美國食品和藥物管理局 (FDA) 對可以開具該藥物處方的人員施加了嚴格限制。後來的分析
2 然而,揭示了該藥物對特定亞群患者有效,吉非替尼現在在歐洲可供具有適當突變的患者使用。
批評者指出吉非替尼的故事是新藥與舊試驗設計之間發生衝突的例證。他們斷言,傳統的隨機試驗成本過高,延誤了良好療法的識別,並掩蓋了僅對一部分患者有效的良好藥物的益處。
張開雙臂
然而,在某種程度上,吉非替尼是更快地將藥物提供給患者的進展的一個例子。它是透過 FDA 的加速審批計劃獲得批准使用的多種腫瘤藥物之一。該計劃允許藥物在 II 期研究中顯示出臨床效果的有力證據後即可上市,只要隨後進行 III 期試驗以確認該效果即可。(這就是吉非替尼失敗並受到嚴格限制的地方)。
由於管道中有眾多候選藥物,製藥公司必須就如何投資其資源做出艱難的決定。當並行進行許多單獨的試驗時,它們會爭奪有限的患者群體。一項研究
3 表明,要填補 2011 年美國所有胰腺癌試驗,需要 83% 的可手術治療腫瘤患者參與。然而,根據美國癌症協會的資料,只有約 5% 的患者自願參加試驗。
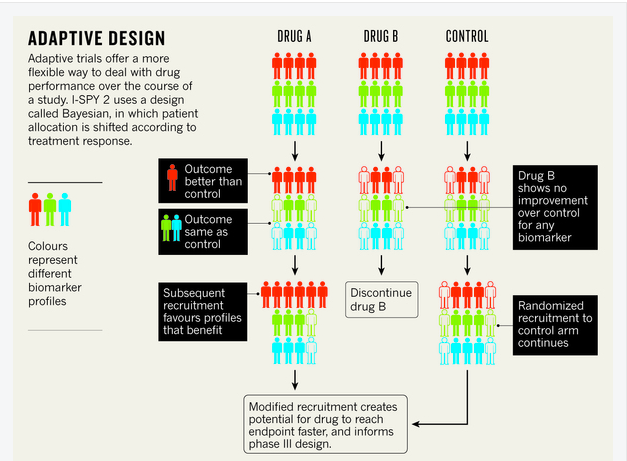
多臂適應性試驗(如 I-SPY 2 和 FOCUS4,一項於 1 月開始招募的結直腸癌試驗)提供了一種解決公司資源和可用患者數量限制的方法。這些 II 期試驗同時研究多種標誌物和候選藥物,透過擴大有希望的治療方法的研究並停止那些未顯示任何效果的治療方法來響應結果(見下文)。
I-SPY 2 根據乳腺癌患者腫瘤的分子特徵將其分為十個亞組。然後,每個亞組在治療組和對照組之間進行劃分。將每種藥物的反應與單個對照組進行比較。未來的招募並非嚴格隨機,而是根據輸入的試驗資料進行。這樣,早期有希望的藥物-生物標誌物組合將分配給更多具有相同生物標誌物特徵的患者。
“這關係到隨著時間的推移更新知識,並根據這些知識修改你的行動,”貝里說,他與加利福尼亞大學舊金山分校的乳腺癌專家勞拉·埃瑟曼共同組織了該試驗。I-SPY 2 有第二位畢業生進入 III 期試驗——來自伊利諾伊州北芝加哥艾伯維公司的藥物 veliparib。其他五種化合物仍在測試中。
FOCUS4 正在招募患者進入四個治療組。與 I-SPY 2 不同,患者被分配到與其生物標誌物特徵被認為匹配的治療方法。每個治療組都有自己的對照組,由具有相同生物標誌物的患者組成。在其生物標誌物匹配組中表現良好的藥物也將給予腫瘤缺乏該標誌物的個體,以測試更廣泛的效果。一個單獨的僅化療組將治療因任何原因無法參加其他組的患者,以及那些對試驗中的治療沒有反應但可能從未來靶向其腫瘤亞型的藥物中獲益的患者。
與通常的做法不同,I-SPY 2 側重於初始治療,而不是將自身限制於晚期、轉移性或耐藥性疾病預後不良的患者。“在癌症中,總是首先關注轉移性疾病,如果沒有任何效果,你就不會繼續,”貝里說。“我們必須更早地關注。”I-SPY 2 中的女性接受“新輔助”治療,旨在在切除腫瘤之前縮小腫瘤。試驗設計者傾向於避開可能已經可以透過標準治療治癒的早期患者,但早期腫瘤通常突變較少且更同質,因此可能更容易靶向。
加利福尼亞大學聖地亞哥分校個性化癌症治療中心主任 Razelle Kurzrock 說,這種早期階段的測試已導致慢性粒細胞白血病 (CML) 的預後得到改善。CML 已經有一種有效的靶向藥物:伊馬替尼,諾華公司以格列衛或格列維克為商品名銷售。當醫生僅將這種藥物作為最後手段使用時,伊馬替尼的回報有限。但 Kurzrock 說,當醫生開始在診斷時就給患者服用該藥時,療效的提高是巨大的。“緩解率不再僅僅是 10%,”她說。“接近 100%。”
令人鼓舞的是,FDA 在 2012 年年中宣佈,它將考慮加速批准可以消除無需手術即可檢測到的腫瘤組織的乳腺癌藥物
4,部分依據來自 I-SPY 2 等試驗的資料。2013 年 9 月,該機構首次批准了帕妥珠單抗的新輔助用途,羅氏公司以帕捷特為商品名銷售。
這些試驗設計透過為幾乎所有來者建立治療組,而不是簡單地拒絕不符合單一生物標誌物標準的患者,從而為患者參與提供了更多機會。此外,與為每種治療方法設定一個對照組的費用相比,I-SPY 2 的唯一對照組節省了大量費用。FOCUS4 和 I-SPY 2 還透過尋求比臨床試驗中通常尋求的收益更大的藥物收益來提供更大的成本削減潛力——通常,治療藥物的無腫瘤進展生存期是對照組的兩倍。這減少了獲得可靠 III 期資料所需的患者數量,並確保只有高效能的候選藥物才能進入下一階段。“如果一種藥物在期中分析期間未能達到其預先設定的結果,我們將關閉該組,”卡普蘭說。
從 I-SPY 2 成功畢業需要預測一種藥物有 85% 的機會在 300 名患者的 III 期試驗中獲得成功,如果參與公司選擇繼續,FOCUS4 中的治療組可以無縫過渡到 III 期。這也是肺癌主協議的一個特點,該協議是由華盛頓特區癌症研究倡導組織之友開發的鱗狀細胞肺癌適應性試驗。該試驗預計很快開始招募。
重新定義疾病
隨著基因組研究開始提供關於不同癌症突變譜的更多資訊,並且隨著更多生物標誌物的出現,研究人員正在重新評估癌症分類(參見“第二次機會”)。例如,與具有不同突變的兩種乳腺癌相比,與乳腺癌共享突變的結直腸癌可能具有更多共同點。如果事實證明如此,那麼這些應該成為指導藥物測試的相似之處。
Kurzrock 是許多贊成分子譜分析而非基於組織的定義的人之一。“如果你有一種靶向特定異常的藥物,你就會想關注這種異常——而不是你是否正在處理乳腺癌,”她說。支援這種模型的證據正在增加。例如,儘管 FDA 已批准克唑替尼(輝瑞公司以賽可瑞為商品名銷售)用於 NSCLC,但臨床研究表明,該藥物也可能對具有相同突變的侵襲性腦腫瘤兒童有效
5.
此類批准現在必須透過針對不同疾病的試驗逐步獲得。為了加快速度,幾家公司正在開展“籃子”試驗,在具有常見基因破壞的多種癌症中測試治療方法。葛蘭素史克公司正在九種癌症(包括腦癌、甲狀腺癌和腸癌)中測試兩種黑色素瘤藥物達拉非尼和曲美替尼,這些癌症都具有 BRAF 基因突變,這可能使它們容易受到這些藥物的影響。該公司腫瘤研究和開發高階副總裁拉斐爾·阿馬多認為,這種方法為患有罕見癌症的患者帶來了希望,否則他們可能會被遺漏。透過進行從腫瘤組中獲取資料的分析,即使是小規模的陽性結果也可能在統計學上變得有意義。阿馬多說,因此,“我們不必在這些超罕見人群中進行非常大規模的隨機試驗”。
美國國家癌症研究所正在透過其“分子分析指導治療選擇”計劃探索這種方法,該計劃使用靶向基因測序將各種藥物與患有實體瘤或淋巴瘤且疾病在現有治療方法上已進展的人員進行匹配。“我們一開始將有大約 20 個組,目標是您可能在癌症中發現的常見可疑突變,”該研究所癌症診斷計劃副主任芭芭拉·康利說。“如果我們能夠讓 35% 或更多的跨腫瘤型別的患者存活六個月或更長時間,那將是一個有趣的訊號。”這些本質上是尋找可能證明轉向 III 期合理的跡象的 II 期試驗,但監管機構表示,他們願意正式承認跨腫瘤療效的有力證據。“FDA 可以根據分子定義的群體而不是特定於疾病部位的適應症批准藥物,”該機構腫瘤和血液學產品辦公室主任理查德·帕茲杜爾說。
然而,額外的複雜性可能會使這種廣泛的生物標誌物知情的研究變得更加複雜。例如,在某些黑色素瘤中有效的 BRAF 抑制劑在具有相同突變的結直腸腫瘤中無效。但 Kurzrock 認為,普遍有效性是不切實際的期望。“如果你看看為肺癌批准的藥物,緩解率通常在 15-20% 的患者範圍內,”她說。“我們不能期望根據基因組分類接受治療的 100% 的患者都能做出反應。”
事實上,腫瘤通常包含可能驅動耐藥性的多種突變——靶向藥物的常見障礙表明,每位患者的癌症可能需要專門的藥物組合。“我們將需要測試一種新的個性化患者和以患者為中心的護理策略,”Kurzrock 說,“而不僅僅是測試一種藥物或藥物組合的舊方法。”
這種複雜性意味著研究人員和腫瘤學家將面臨陡峭的學習曲線。貝里認為,腫瘤學最終將經歷一場廣泛的轉型——將藥物測試視為洞察疾病的機會,而不僅僅是驗證現有假設。“未來實際上是將臨床實踐和臨床試驗相結合,並在試驗中同時具有學習和確認的概念,”他說。“這將意味著完全不同的監管視角和公司完全不同的商業模式。”
本文經許可轉載,最初於 2014 年 5 月 28 日首次發表。
