病毒學家 Sissy Sonnleitner 追蹤了奧地利崎嶇的東蒂羅爾地區幾乎每一例 COVID-19 病例。因此,當那裡的一名婦女持續數月檢測呈陽性時,Sonnleitner 決心弄清楚發生了什麼。
在 2020 年底感染 SARS-CoV-2 之前,這位 60 多歲的婦女一直在服用免疫抑制藥物來治療淋巴瘤復發。COVID-19 感染持續了七個多月,引起了相對輕微的症狀,包括疲勞和咳嗽。
Sonnleitner 在奧地利 Außervillgraten 的一家微生物學機構工作,她和她的同事隨著時間的推移從這位婦女身上採集了 20 多個病毒樣本,並透過基因測序發現該病毒已積累了約 22 個突變(見“追蹤刺突蛋白的演變”)。其中大約一半會在數月後在全球範圍內激增的高度突變的 SARS-CoV-2 奧密克戎變異株中再次出現。“當發現奧密克戎時,我們感到非常驚訝,”Sonnleitner 說。“我們的變異株中已經存在這些突變。”
關於支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您將有助於確保未來能夠繼續刊登關於塑造我們當今世界的發現和想法的有影響力的報道。
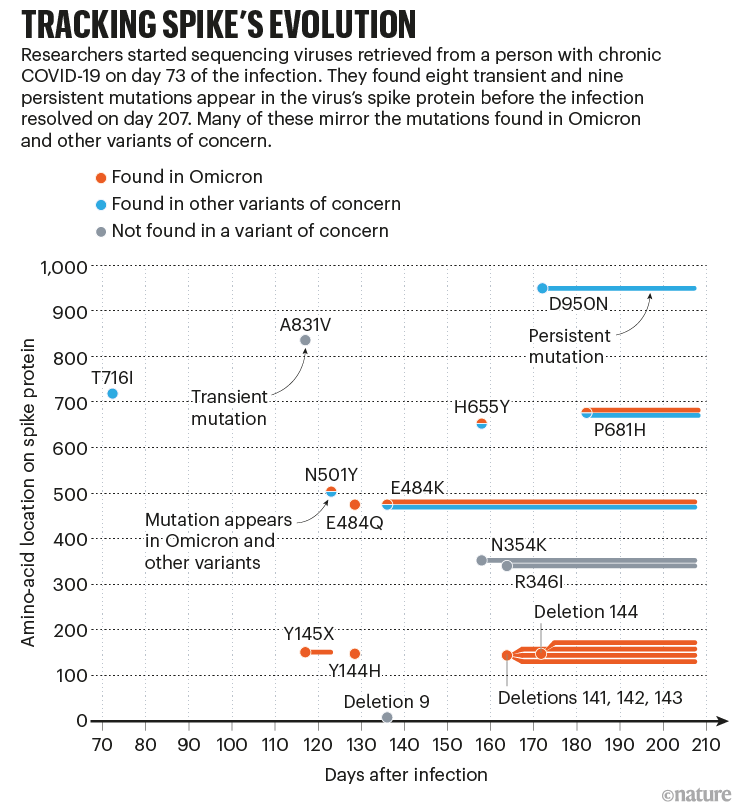
致謝:Ewen Callaway 在《自然》雜誌第 606 卷(2022 年 6 月)發表的“長達數月的 COVID 感染可能如何播下危險的新變異株的種子”
奧密克戎並非源於這位婦女的感染,她的感染似乎也沒有傳播給任何人。儘管尚未確定與個別病例的明確聯絡,但像她這樣的慢性感染是導致奧密克戎和其他推動全球 COVID-19 激增的變異株起源的主要候選因素。“我認為,任何人都不應該懷疑這些是新變異株的來源,”英國劍橋大學病毒學家 Ravindra Gupta 說。
研究人員希望瞭解病毒如何進化出更容易在人與人之間傳播、逃避免疫反應或變得更嚴重或更輕的能力。其中一些或全部特性可能在慢性感染過程中形成。“我們不太瞭解在個體中會進化出什麼——以及什麼不會,”南非德班非洲健康研究所病毒學家 Alex Sigal 說。
這種知識不太可能有助於預測下一種致命毒株,甚至追蹤奧密克戎等變異株的起源。不過,病毒學家希望,透過提高他們對病毒進化的理解,他們將能夠預測未來變異株可能是什麼樣子,並可能找到更好的方法來治療慢性感染。“鑑於我們不希望出現另一種我們無法控制的變異株,這是一個非常重要的問題,”Sigal 說。
致命的競爭
自 2019 年底以來,科學家們已經對從人類身上採集的超過 1100 萬個 SARS-CoV-2 樣本進行了基因組測序。這些努力繪製了一棵進化樹,其廣度令人矚目,顯示了病毒在全球蔓延過程中如何發生變化,平均每月僅獲得幾個穩定的突變,因為它從一個人傳播到另一個人。
“但這只是進化故事的一部分,”加拿大溫哥華不列顛哥倫比亞大學的進化生物學家 Sarah Otto 說。每個人的感染都是一個獨立的宇宙,當感染從細胞傳播到細胞時,新的突變就會產生。大多數這些變化對病毒來說無關緊要,許多變化會對病毒造成損害。但有些變化可能會使病毒在感染者的體內相對於其他版本的病毒略有優勢,增強其傳播能力或提供對免疫防禦的某些抵抗力。這兩個特性——傳染性和免疫逃逸——是 SARS-CoV-2 自 2019 年首次出現以來進化的主要方式。
在急性 SARS-CoV-2 感染中,通常持續一兩週,然後被免疫系統清除,具有有利突變的病毒版本幾乎沒有時間戰勝那些缺乏有利突變的病毒。因此,具有這種優勢的病毒傳播給另一個個體的機率很小。研究表明,只需要少量病毒顆粒——甚至可能只有一個——就可以引發新的感染。“在某人走過並吸入時,你打噴嚏噴出的氣溶膠液滴中恰好有哪些病毒,這很大程度上取決於運氣,”華盛頓州西雅圖弗雷德·哈欽森癌症中心進化生物學家 Jesse Bloom 說。“因此,患者體內產生的大多數有益突變都會丟失,然後進化必須重新開始。”
這種“傳播瓶頸”是 SARS-CoV-2 全球平均每月獲得約兩個突變的原因。但在持續數週至數月的慢性感染中,具有有利突變的病毒有時間戰勝其他病毒。
與急性病例相比,這些長期感染也為更多病毒多樣性的發展提供了時間。英國愛丁堡大學進化生物學家 Andrew Rambaut 說,透過一種稱為重組的過程,可以將 SARS-CoV-2 顆粒的基因組混合在一起,在身體某個部位(如上呼吸道)有益的突變可能會出現在具有其他有用特性的病毒中。“如果結果是更適應的病毒,它可能會突然爆發。”
Otto 說,由於慢性感染,在全球範圍內,“這種病毒不僅有機會朝一個方向進化,而且還可能在數月內朝著數千甚至數萬個方向進化”。
靶向刺突蛋白
沒有兩個慢性感染是相同的。但在數十份病例報告中,研究人員已經開始識別長期感染的常見特徵。Otto 說,最引人注目的特徵之一是病毒刺突蛋白中積累的大量氨基酸變化,這有助於病毒感染細胞,並且是人體免疫反應的主要靶標。
許多這些突變都對映到刺突蛋白中抗體靶向的區域,例如其受體結合域 (RBD) 和 N 端域,它們參與識別和感染宿主細胞。南非開普敦大學進化病毒學家 Darren Martin 說,這很有道理。如果一個人的免疫系統未能完全清除感染,那麼倖存的病毒很可能帶有幫助它們在攻擊中倖存下來的免疫逃逸突變。一項尚未經過同行評審的研究發現,慢性感染中最常見的突變是刺突蛋白 RBD 中稱為 E484 的位置。該位點的變化可以阻止一些有效的感染阻斷抗體附著到病毒上。
一些突變單獨作用效果不佳。去年,Gupta 和他的團隊描述了一名 70 多歲免疫系統受損的男性持續 102 天的感染,該男性最終死於感染。在醫生用恢復期血漿(從 COVID-19 康復者捐獻的血液中含有抗體的部分)治療他後,Gupta 的團隊發現,帶有一對刺突蛋白突變的病毒在該男子的氣道中大量繁殖。
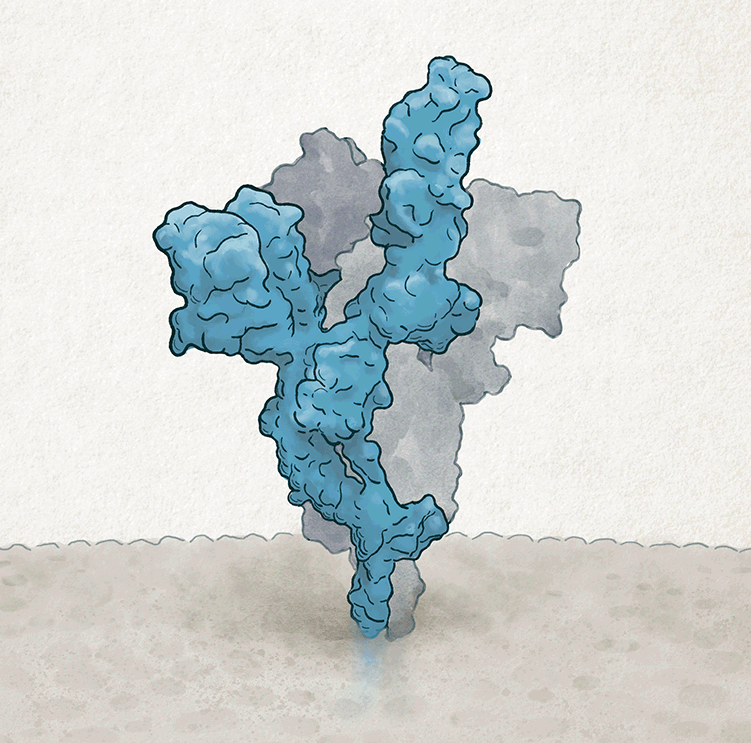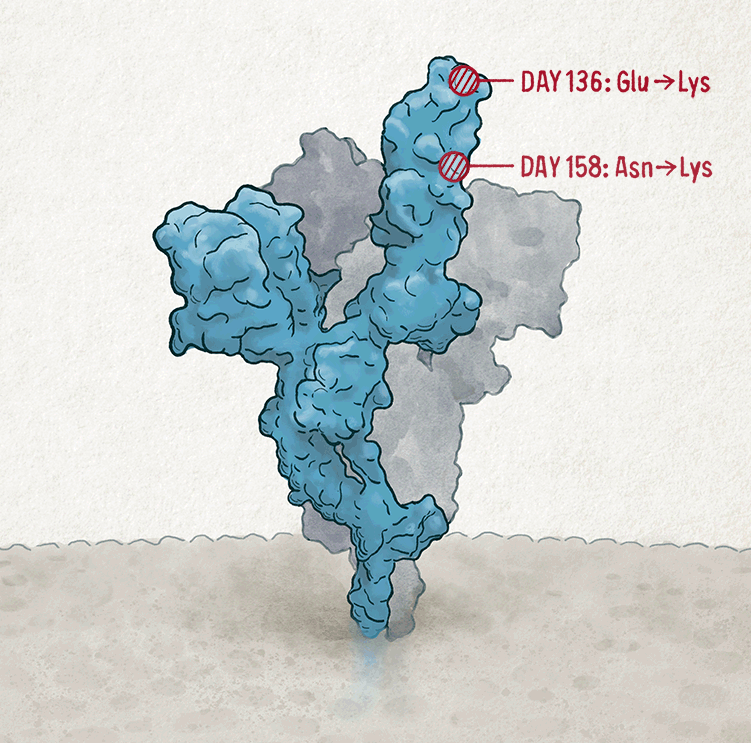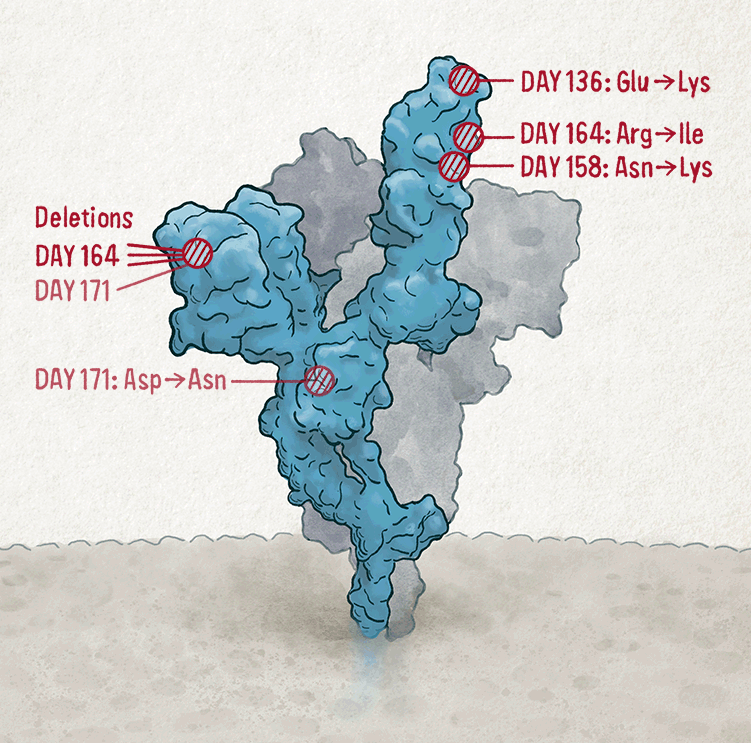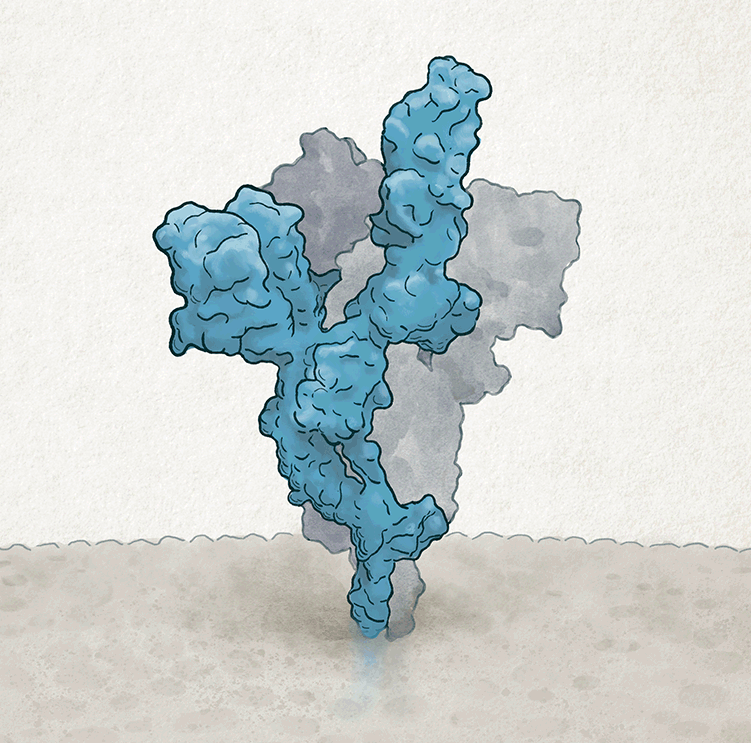
這些是在長達七個月的感染期間在 SARS-CoV-2 刺突蛋白中積累的突變。致謝:Nik Spencer/《自然》雜誌插圖
其中一個突變稱為 D796H,賦予了病毒對抗體的抵抗力——但這種益處是以病毒為代價的。當研究人員設計了一種非複製型“假型病毒”來攜帶 D796H 突變,並測量其在實驗室中感染細胞的能力時,他們發現這種突變本身就使假型病毒的傳染性顯著降低。但是,當假型病毒還包含在同一人身上發現的第二個突變(位點 69 和 70 的兩個氨基酸缺失)時,傳染性幾乎完全恢復。Gupta 說,這種補償性突變有更多的時間在慢性感染中出現,使病毒能夠實現進化飛躍。“當病毒在宿主之間快速跳躍時,它們很難做到這一點。”
在某些情況下,突變只有在事後看來才有意義。2020 年末,馬薩諸塞州波士頓布萊根婦女醫院的醫生科學家 Jonathan Li 和他的同事釋出了第一份關於慢性 SARS-CoV-2 感染的詳細報告:一名患有罕見自身免疫性疾病的 45 歲男性最終死亡的病例。該病毒產生了與抗體耐藥性相關的突變,包括 E484K,以及另一種稱為 N501Y 的刺突突變,實驗室研究表明,該突變可以提高病毒與宿主細胞受體結合的能力,從而可能提高傳染性。
當 N501Y 變化在後來被命名為 Alpha、Beta 和 Gamma 關注變異株 (VOC) 的三個快速增長的譜系中檢測到時,其重要性變得顯而易見。奧密克戎也帶有這種突變,以及在該男子的感染中發現的其他幾個突變。“他真的是未來趨勢的先兆,”Li 說。
尋找變異株起源
Alpha 於 2020 年底在英國被發現,是第一個被懷疑從慢性感染中出現的 SARS-CoV-2 變異株。但 Rambaut 說,這不是唯一的可能解釋。該變異株可能出現在一個地區——可能在英國境外——該地區幾乎沒有能力對 SARS-CoV-2 進行基因組監測。或者,Alpha 可能是在動物宿主中進化的(該變異株的 N501Y 突變使其能夠感染小鼠、大鼠和水貂)。
然而,一次偶然的發現表明,慢性感染是 Alpha 最可能的來源。Rambaut 和愛丁堡大學的進化生物學家 Verity Hill 在 3 月份的一份預印本中報告說,在英國測序資料中發現了一個 Alpha 的中間版本。該序列是從 2020 年 7 月在英格蘭東南部的一人身上採集的,比 Alpha 首次在同一地區檢測到早兩個月。
該病毒已經獲得了 N501Y 突變,以及 Alpha 的其他幾個標誌,但它缺少全套變化。“它正在積累這些突變。它可能不太擅長傳播,”Hill 說。她認為,只有在 Alpha 中間體獲得更多突變後,它才具有爆發的能力。
在奧密克戎中也看到了突變的組合。該變異株——包括幾個具有許多重疊突變的亞譜系——充滿了與免疫逃逸和傳染性相關的基因變化,這些變化之前已經被發現。但 Martin 注意到的是,引發大多數國家奧密克戎浪潮的 BA.1 亞變異株擁有一組 13 個刺突突變,科學家們很少單獨看到這些突變,更不用說全部集中在一個病毒中。
Martin 和他的同事假設,在這組獨特的突變中,有一些突變有助於抵消與加速奧密克戎傳播的突變相關的進化成本。“在我看來,這些權衡需要很長時間才能解決,並且需要慢性感染,”Martin 說。他補充說,這些可能發生在人類或動物身上。
奧密克戎的另一個特徵——疾病嚴重程度降低——也可能是慢性感染的產物。實驗室研究表明,奧密克戎相對溫和可能是因為它傾向於感染上呼吸道細胞,而不是肺部細胞。該變異株可能從一種擅長感染上呼吸道和下呼吸道的毒株進化而來。Gupta 懷疑奧密克戎的這種轉變可能取決於病毒在一個人體內停留數月時發生的協調進化。但他補充說,尚不清楚推動這種轉變的進化力量是什麼。
密切關注
慢性感染可能是解釋奧密克戎和 Alpha 等變異株如何進化的最佳解釋。但大多數變異株的定義特徵之一——它們在人與人之間像野火一樣蔓延的能力——如何在個體中進化出來尚不清楚。“這是一個真正的謎,”Bloom 說。“當某些東西不受選擇時,你通常會失去它。在慢性感染期間,不再存在對傳播性的選擇。”
一種可能的解釋是,幫助 SARS-CoV-2 感染一個人的氣道、肺部和其他器官的相同分子機制對於使病毒傳播給他人也很重要。“當它在你體內時和當它從一個人傳播到另一個人時,所需的傳播動力學是相同的,”Martin 說。
但是,僅僅保留傳播能力的病毒與像奧密克戎或 Alpha 這樣會導致全球病例激增的病毒之間存在差異。Rambaut 說,傳播性的大幅提高或感染以前免疫人群的能力可能是區分危險 VOC 的因素。“並非所有慢性感染都會產生 VOC。這將是百萬分之一。”

隔離長期感染者可能不會抑制新的關注變異株。致謝:Ina Fassbender/法新社/蓋蒂圖片社
這意味著監測不太可能在其出現時檢測到變異株。在 5 月份的一份預印本中,研究人員發現了一種奧密克戎毒株,該毒株在免疫功能低下個體的慢性感染期間獲得了其他刺突突變,並表明它已傳播到同一家醫院的幾個人以及當地社群。但這種感染的更廣泛傳播似乎極其罕見。2 月份一份記錄了 27 名慢性感染者的預印本報告稱,沒有證據表明任何人都將病毒傳播給了其他人。以色列特拉維夫大學進化病毒學家 Adi Stern 領導了這項研究,他說,如果 VOC 如此罕見地從慢性感染中出現,那麼如果不降低全球範圍內的總體感染率,將很難預防它們。
然而,迫切需要了解導致慢性感染的病毒因素。“我們需要超越病例報告,瞭解病毒在這段時間內實際進化了什麼,”Sigal 說。
Sigal 和他的團隊正在追蹤患有晚期 HIV 的人,他們的免疫系統可能嚴重受損,以識別與慢性 SARS-CoV-2 感染相關的因素。HIV 感染稱為 CD4+ T 細胞的免疫細胞,這些細胞也支援產生對抗 SARS-CoV-2 等病毒的抗體。在未發表的研究中,Sigal 和他的同事發現,低水平的 CD4+ T 細胞與慢性 SARS-CoV-2 感染的風險相關,並且許多病例是輕微的,幾乎沒有或沒有呼吸道症狀。
Otto 說,根據全球近 4000 萬 HIV 感染者的龐大數量,以及大多數人可能已經感染了 SARS-CoV-2 的可能性,永續性感染的一些病例似乎很可能正在導致新變異株的出現。“從奧卡姆剃刀原理來看,我們知道這應該是一個來源。”
免疫系統受損的人並非變異株的唯一潛在來源。研究人員已經記錄了健康免疫系統的人持續數週的 SARS-CoV-2 感染。Martin 說,從自然選擇的角度來看,即使是相對較短的三週感染也為病毒進化提供了比持續一週的急性感染呈指數級增長的機會。
Hill 說,與免疫反應受損的個體相比,免疫系統相對健康的人也可能為病毒提供更大的選擇壓力。但是,如何識別容易發生這種感染的人或他們的症狀可能是什麼樣子仍然是一個懸而未決的問題。“我懷疑它們比我們意識到的要常見得多,”Hill 說。
去年,巴西里約熱內盧 Oswaldo Cruz 研究所的病毒學家 Gonzalo Bello 和他的同事在巴西 Amazonas 州發現了幾種正在傳播的 SARS-CoV-2 毒株。這些毒株攜帶了在 Gamma 變異株中發現的一些突變(但並非全部),Gamma 變異株推動了該地區 2021 年的第二波猛烈疫情。但每個類似 Gamma 的毒株也都有自己獨特的突變:Bello 說,這證明 Gamma 可能不是從單一慢性感染進化而來,而是從涉及相對健康人群的中等長度感染的傳播鏈進化而來。
Bello 認為,這種傳播鏈可能促成了奧密克戎譜系的多樣性。“也許這些個體是 VOC 起源的某些步驟發生的地方,”他說。Hill 補充說,如果健康人群的慢性感染是 VOC 的一個可能來源,那麼提高全球疫苗接種率可能有助於預防新的 VOC 出現。“當你遇到這些大規模不受控制的感染浪潮時,你就是在為下一次浪潮播下種子。”
在慢性感染期間服用的抗病毒藥物和其他治療方法也可能在病毒進化中發揮作用。科學家正在關注的一個特徵是對 Paxlovid(奈瑪特韋/利托那韋)和莫努匹韋等 COVID-19 藥物的耐藥性。(在慢性感染中已經記錄了對抗病毒藥物瑞德西韋的耐藥性。)這些藥物影響高度保守的病毒蛋白——藥物耐藥性的屏障很高——但表徵慢性感染的進化飛躍可能會為病毒爭取時間來找到繞過該屏障的方法,Gupta 說。
在未發表的實驗室實驗中,紐約市哥倫比亞大學病毒學家 David Ho 領導的一個團隊發現,SARS-CoV-2 可以透過多種途徑產生 Paxlovid 耐藥性。有些途徑涉及獲得補償性突變,使病毒能夠克服 Paxlovid 耐藥性的成本,從而至少在實驗室中茁壯成長。Ho 說,這些突變不太可能是 Paxlovid 治療後 SARS-CoV-2 症狀復發的傳聞報告背後的原因(Ho 自己也經歷過這種反彈)。但是,如果正常情況下服用五天的療程延長以治療慢性感染,則很可能會出現耐藥性。
迫切需要確定慢性感染的有效治療方法——特別是對於免疫系統受損的人,他們通常對疫苗沒有強烈的反應。大多數已批准的單克隆抗體藥物對奧密克戎及其分支無效,研究人員在一份預印本中表明,當使用這些療法治療慢性感染時,可能會出現對這些療法的耐藥性。
約翰·霍普金斯大學彭博公共衛生學院的微生物學家 Arturo Casadevall 說,恢復期血漿應該比單克隆抗體療法創造更高的進化屏障。含有高水平多樣化抗體的血漿已被證明可有效治療 COVID-19,一些醫生現在正在將其用於免疫系統受損的人。
Sigal 指出,靶向 HIV 的抗逆轉錄病毒藥物也可以幫助 HIV 感染者清除慢性 SARS-CoV-2 感染,但堅持用藥可能是一個挑戰。
去年 10 月,英國臨床醫生報告了一個病例,其中一名患者在接種 COVID-19 疫苗後清除了慢性感染。對於 Sonnleitner 和她的同事研究的奧地利婦女,她在接種疫苗後也結束了為期七個月的感染。但不可能知道疫苗是否幫助她康復。
然而,對於慢性感染者來說,這種結果很少見;許多報告都以死亡告終。Stern 說:“這些真的是令人心碎的病例。”隨著世界許多地區試圖擺脫疫情,一些健康人對“輕微”奧密克戎感染聳聳肩,Stern 說我們必須做更多的事情來保護那些最容易感染慢性 SARS-CoV-2 的人。“這對他們來說是危險的——對我們整個社會來說也是危險的。”
本文經許可轉載,並於 2022 年 6 月 15 日首次發表。