來自《量子雜誌》 (Quanta Magazine) (在此處查詢原始報道)。
當醫生和科學家埃米爾·盧 (Emil Lou) 十年前在紀念斯隆·凱特琳癌症中心擔任腫瘤學研究員時,他經常被他的癌細胞培養物中一些小而無法辨識的東西所困擾。他說,透過顯微鏡觀察,他“不斷發現這些細長的半透明線”,寬度約 50 奈米,長度 150 至 200 微米,在培養物中的細胞之間延伸。他請他所在大樓的世界一流的細胞生物學家解釋這些觀察結果,但沒有人確定他們看到的是什麼。最後,在深入研究文獻後,盧意識到這些線條與海德堡大學的漢斯-赫爾曼·格爾德斯小組 (Hans-Hermann Gerdes) 在 2004 年《科學》雜誌 (2004 paper in Science) 上發表的一篇論文中描述的“奈米管高速公路”或“隧道奈米管”(TNT) 相符。
盧擔心他注意到的線條可能是虛幻的,因此他檢查了癌症中心患者的腫瘤標本檔案。 瞧,腫瘤中也存在相同的長細胞過程,因此他著手調查它們的相關性。 從那時起,作為明尼蘇達大學的教員,他發現證據表明腫瘤細胞使用這些 TNT 以微小 RNA(稱為 microRNA 的短 regulatory 片段)的形式共享分子資訊,使對化療藥物具有抗性的癌細胞能夠將相同的抗性賦予其鄰居。
支援科學新聞事業
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞事業 訂閱。 透過購買訂閱,您正在幫助確保未來能夠繼續講述關於塑造我們當今世界的發現和想法的具有影響力的故事。
隧道奈米管是如何在如此長的時間內未被注意到的? 盧指出,在過去的幾十年裡,癌症研究主要集中在檢測和治療性地靶向癌細胞中的突變,而不是它們之間的結構。“它就在我們眼前,但如果這不是人們關注的焦點,他們就會錯過它,”他說。

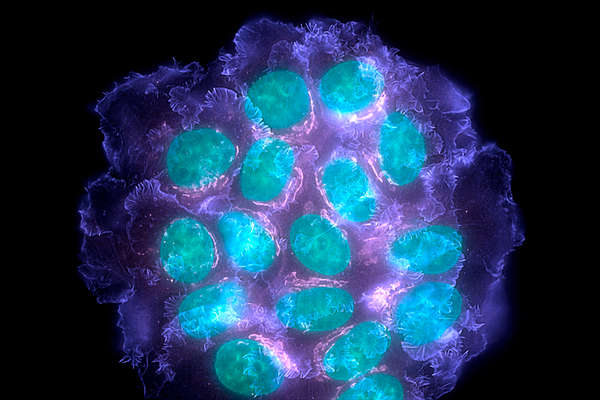
培養中的乳腺癌細胞形成管狀互連。 在此影片中,可以看到分子有效載荷(藍色圓圈內)沿著這些膜性奈米管和微管移動,說明它們如何傳遞給需要它們的細胞。 這種連線可能有助於癌細胞共享它們對治療藥物的抗性。 來源:Ian Smith
這種情況現在正在改變。 在過去的幾年裡,研究 TNT 並弄清楚它們作用的研究人員數量急劇增加。 研究團隊發現,TNT 除了 microRNA 之外,還轉移各種貨物,包括信使 RNA、蛋白質、病毒,甚至整個細胞器,如溶酶體和線粒體。
“這只是冰山一角,”盧說。 “現在是研究這些東西的非常激動人心的時刻。”
這些脆弱的結構不僅出現在癌症、艾滋病和神經退行性疾病等疾病背景下,也出現在正常的胚胎髮育中。 健康的成人細胞通常不產生 TNT,但受壓或患病的細胞似乎會透過發出訊號尋求幫助來誘導它們產生。 然而,尚不清楚健康細胞如何感知到它們的鄰居需要幫助,或者它們如何在生理上“知道”要傳送哪些特定的貨物。
眼見為實
TNT 的發現是一個意外的驚喜。 當時是 Gerdes 小組成員,現在仍然是海德堡大學研究員的阿明·魯斯托姆 (Amin Rustom) 回憶說,這發生在因為他正在使用一種新的熒光染料來標記感興趣的細胞特徵。 使用染料的方案要求進行幾個連續的洗滌步驟,但他跳過其中一些步驟,還是看了看他的細胞。 那時他發現了長管狀結構,染料使這些結構更加可見(他認為洗滌步驟會破壞它們)。
利用顯微鏡技術,該小組進一步檢查了這些結構,並確定它們是開放通道,細胞器和膜囊泡透過這些通道從一個細胞移動到另一個細胞。 魯斯托姆解釋說,那時人們清楚地認識到,膜管是“一種全新的細胞間通訊機制”。 然而,要說服其他人並不容易——一些研究人員懷疑這些 TNT 是實驗人為產物,而不是自然產生的結構。 他說,由於人們對這些發現持強烈的懷疑態度,該小組花了四五年時間才發表論文。
確認 TNT 確實是細胞間通訊的途徑仍然是一個重大挑戰。 細胞有其他交換分子的選擇,最顯著的是稱為間隙連線和外泌體的結構。
如果 TNT 類似於空中走廊,即連線獨立建築物的封閉式人行天橋,那麼間隙連線(穿過相鄰細胞膜的門控孔)就像相鄰房間之間的門道。 外泌體是細胞脫落的小囊泡,長期以來被認為是攜帶碎片的細胞垃圾袋,但科學家現在認識到它們是細胞之間(有時是遠距離)攜帶 microRNA 和其他訊號分子的載體。 確定 TNT 作用的挑戰在於,很難在不干擾其他通訊通道的情況下抑制其中任何一個。
最近的許多努力也集中在尋找 TNT 的生物標誌物,以將它們與外觀相似的結構(如絲狀偽足,用於感知和運動的長細胞突起)區分開來。 絲狀偽足不是開放式的,它們不將貨物從一個細胞轉移到另一個細胞,但僅憑形狀很難將它們與 TNT 區分開來。 使問題複雜化的是,TNT 出現在多種細胞型別中,並且形態多樣,尺寸範圍很廣。 在某些情況下,它們足夠大,可以被認為是微管而不是奈米管,一些研究人員認為,較小的 TNT 在功能上與微管不同。 目前正在努力表徵奈米管和微管的不同亞型。
但是,許多科學家仍然可以理解地對 TNT 的假定功能持懷疑態度。 巴黎巴斯德研究所細胞生物學和感染部門負責人 Chiara Zurzolo (Chiara Zurzolo) 從事 TNT 研究,但也承認這種困難。 “它們尚未完全表徵,所以我怎麼能相信一些可能無所不能的東西呢?” 她問道。
然而,有用的答案正在出現,因為新興的 TNT 研究領域正受益於顯微鏡和其他技術的進步。 伊爾文加利福尼亞大學研究 TNT 的 Ian Smith (Ian Smith) 專門研究成像方法,例如晶格光片顯微鏡,這種顯微鏡足夠溫和,可以用於觀察活細胞數小時甚至數天。 這種方法使研究人員能夠看到活細胞中 TNT 的精細結構,並跟蹤在它們之間移動的單個分子。 “對我來說,能夠看到你研究的東西,正是我一直對顯微鏡感興趣的主要驅動力,”史密斯說。
加爾·海莫維奇 (Gal Haimovich) 現在是以色列魏茨曼科學研究所的研究員,他於 2012 年加入阿爾伯特·愛因斯坦醫學院羅伯特·辛格實驗室 (Robert Singer) ,擔任博士後研究員,對研究 RNA 的細胞間轉移感興趣。 當時,RNA 轉移的標準模型是分子被包裝到外泌體中,然後在外泌體之間擴散。 但這尚未被直接觀察到; 這是從生化實驗中推斷出來的。
海莫維奇想使用辛格實驗室開發的成像方法,因為它們可以視覺化運輸中的 RNA,並收集更多關於它的定量資料。 他在同一個培養皿中培養了兩種細胞株——只有一種細胞株可以表達特定的 mRNA——並觀察發生了什麼。 在他眼前,mRNA 分子透過連線不同細胞的 TNT 遷移。 “我實際上可以看到 mRNA 存在於膜奈米管中,而且如果我抑制膜奈米管的形成……我就會消除 RNA 轉移,”他說。
為了瞭解細胞是否主動調節這些轉移,海莫維奇用熱休克和氧化應激挑戰它們。 他解釋說,如果環境條件的變化改變了 RNA 轉移的速率,那麼“這將表明這是一種生物學調節機制,而不僅僅是 RNA 的偶然擴散”。 他發現氧化應激確實導致轉移速率增加,而熱休克導致轉移速率降低。 此外,海莫維奇透過電子郵件澄清說,如果在受體細胞上施加應激,則會觀察到這種效果,但如果在共培養之前也在供體細胞上施加應激,則不會觀察到這種效果。 “這表明受體細胞向供體細胞傳送訊號,‘請求’來自鄰居的 mRNA,”他說。 他的研究結果於去年發表在《美國國家科學院院刊》 (reported in the Proceedings of the National Academy of Sciences) 上。
癌症中的 TNT
癌細胞通常處於應激狀態——這些快速分裂的細胞在缺氧、營養應激、氧化應激等條件下存活。 因此,毫不奇怪,它們像海莫維奇的受壓細胞一樣,會誘導 TNT 的產生。 事實上,盧的研究表明,導致多種癌症的細胞形成的 TNT 數量是正常健康成人細胞的 5 到 100 倍。
海德堡大學的神經學家、腫瘤學家和癌症研究員弗蘭克·溫克勒 (Frank Winkler) 發現,稱為神經膠質瘤的腦癌充滿了腫瘤微管(TNT 的較大表親)。 他在觀察活體小鼠大腦中單個腫瘤細胞生長時注意到了這些結構,但他沒有意識到它們的意義。 與他合作的病理學家將它們歸因於標本製備中的缺陷。 直到溫克勒和病理學家在活細胞中看到這些微小的管子,他們才意識到這些結構是真實的。
“知道要尋找什麼……我們看到這是這些腫瘤的顯著特徵,”溫克勒說。 “但是你需要知道要尋找什麼才能理解你所看到的東西。”
溫克勒注意到,當他對患者的腫瘤進行化療或放療時,孤立的癌細胞死亡了,但那些透過腫瘤微管和 TNT 相互連線的癌細胞卻存活了下來。 他說,網路化細胞“是該疾病的耐藥性支柱”。
他解釋說,為了應對化療或放療的壓力,癌細胞會形成更多的腫瘤微管和更強的網路。 現在,他和他的團隊正在使用網路理論來解碼連線的癌細胞之間的通訊模式。 他的工作假設是,存在通訊層級,某些細胞(可能是那些具有強大的發育特性(如干細胞)的細胞)充當網路的“主謀”。 它們可能會指導其他細胞如何行為,並驅動腫瘤生長的進展及其對療法的抗性。
溫克勒還發現,神經膠質瘤腫瘤細胞與鄰近的健康細胞形成連線——這至少為與大腦組織進行某種雙向通訊提供了可能性。 斯坦福大學的兒科腫瘤學家米歇爾·蒙傑 (Michelle Monje) 已經表明,大腦活動驅動神經膠質瘤的腫瘤進展,溫克勒懷疑腫瘤微管和 TNT 可能在其中發揮作用。 “腫瘤影響大腦,大腦也影響腫瘤,”溫克勒說。 “這是一個幾乎令人恐懼的複雜程度。”
但好訊息是,這些微管和奈米管也代表了一個全新的治療靶點,溫克勒說。 “我希望我們能找到更好的東西,在那裡我們開發新的治療策略。 除了理解所有這些瘋狂的生物學之外,這是我的主要希望之一。”
一種方法是嘗試開發抑制微管和奈米管形成的藥物,以使癌症更容易受到化療和放療的影響。 為此,溫克勒目前正在努力表徵這些微小管的尺寸和功能多樣性。 另一種策略是利用管狀網路傳播藥物:2015 年,FDA 批准了第一種溶瘤病毒,這是一種針對黑色素瘤患者的基因療法 (approved the first oncolytic virus, a form of gene therapy)。 盧發現這種治療性病毒可以透過 TNT 從一個細胞移動到另一個細胞 (move from cell to cell through TNTs)。
製藥巨頭葛蘭素史克 (GlaxoSmithKline) 發現了一個充滿機遇的領域,於 2016 年 9 月召集了一次 TNT 專家會議 (a meeting of TNT experts in September 2016) ,探討 TNT 的作用——以及如何破壞或利用它們進行治療應用。
免疫細胞的新花招
TNT 在免疫系統中也發揮著重要作用。 它們的功能涉及樹突狀細胞,匹茲堡大學的免疫學家 Robbie Mailliard (Robbie Mailliard) 將其稱為“免疫系統的四分衛”。 樹突狀細胞透過 TNT 相互連線,這個過程稱為網狀化。
“樹突狀細胞在網狀化時以如此快速而戲劇性的方式做到這一點。 這就像一群小蜘蛛俠,他們只是射出這些網,”馬亞德說。 “他們在很短的時間內花費了大量的精力來建立這些聯絡,所以我認為它們在免疫反應中確實起到某種重要的作用。”
馬亞德和他的同事喬瓦娜·拉波喬洛 (Giovanna Rappocciolo) 和查爾斯·里納爾多 (Charles Rinaldo) 發現,HIV 和其他病毒可以利用這些 TNT 在樹突狀細胞中傳播。 馬亞德說,抑制 TNT 似乎可以抑制 HIV 的傳播。 此外,研究人員發現,那些感染 HIV 但能夠無需任何抗逆轉錄病毒療法即可控制病毒的極其罕見的人(所謂的“長期非進展者”)的樹突狀細胞形成 TNT 的能力存在缺陷。 這似乎是一種與細胞膽固醇水平相關的遺傳特徵。 現在,研究人員正在調查通常用於降低膽固醇水平的藥物是否可以透過限制網狀化來重新用於控制病毒感染。
HIV 並不是唯一利用樹突狀細胞形成 TNT 能力的感染。 Zurzolo 解釋說,朊病毒(例如,透過食用患有瘋牛病的牛的牛肉獲得)和其他錯誤摺疊的蛋白質也會劫持這些細胞通訊網路。 在大腦中聚集並催化健康蛋白質轉化為錯誤摺疊蛋白質的錯誤摺疊蛋白質是神經退行性疾病的主要原因。 這些錯誤摺疊蛋白質的例子包括 tau 蛋白、α-突觸核蛋白和亨廷頓蛋白,它們分別與阿爾茨海默病、帕金森病和亨廷頓病的發生密切相關。 直到幾年前,尚不清楚這些傳染性蛋白質如何從細胞傳播到細胞,因為與病毒或細菌不同,錯誤摺疊的蛋白質沒有明顯的傳播途徑。
2004 年,當漢斯-赫爾曼·格爾德斯小組發表論文時,Zurzolo 正在巴斯德研究所研究朊病毒。 倫敦帝國學院的研究人員不久後發表的另一篇論文表明,免疫系統的細胞可以透過 TNT 連線 (cells of the immune system could connect via TNTs),這促使她調查朊病毒是否可以透過這種方式傳播。 2009 年,Zurzolo 發表了一項研究,表明樹突狀細胞可以透過 TNT 與神經元通訊 (dendritic cells could communicate with neurons through TNTs),並且當她用朊病毒感染樹突狀細胞時,朊病毒被轉移到神經元。 她說,這是朊病毒引起的疾病可以透過 TNT 在細胞之間傳播的觀點的開始。
Zurzolo 說,樹突狀細胞從腸道獲取朊病毒,它們不斷在腸道巡邏以尋找感染。 然後,運動性樹突狀細胞在全身迴圈,並透過 TNT 將朊病毒傳播到脾臟和淋巴結(免疫系統器官)以及周圍神經。 一旦進入神經系統,朊病毒很容易透過 TNT 從一個神經元傳遞到另一個神經元,從而到達大腦。 Zurzolo 說,發現錯誤摺疊的蛋白質如何在細胞之間移動“真是一個突破”。
在過去的十年裡,她已經證明,與阿爾茨海默病和帕金森病有關的錯誤摺疊蛋白質也透過 TNT 從神經元傳播到神經元。 “我們相信,如果我們嘗試透過殺死細胞之間的 TNT 來阻止這些蛋白質的擴散,我們就可以治癒其中一些疾病,”她說。
魯斯托姆解釋說,儘管如此,必須取得平衡,因為神經膠質細胞透過 TNT 與神經元通訊來支援神經元。 因此,阻斷 TNT 也可能會干擾大腦的正常生理機能。
Zurzolo 還完善了她關於 TNT 如何以及為何形成的觀點。 “我們的一般假設是,當細胞處於危險、垂死或受到壓力時,細胞會嘗試實施一種通常在發育過程中使用的通訊方式,因為我們認為這些 TNT 更適合在發育中的生物體中進行快速通訊,”她說。 “然而,當細胞受到疾病影響或感染病毒或朊病毒時,細胞會受到壓力,它會發出這些突起,試圖從健康細胞獲得幫助——或排出朊病毒。”
鑑於 TNT 在癌症、HIV 和神經退行性疾病傳播中的作用,研究人員和製藥公司有興趣尋找破壞它們的方法也就不足為奇了。 但是,如果這些結構也可以用於治療目的呢?
再生醫學中的意外作用
巴黎蒙多生物醫學研究所的研究員安妮-瑪麗·羅德里格斯 (Anne-Marie Rodriguez) 發現,TNT 有助於受損的心臟細胞從心臟病發作中恢復 (TNTs help injured heart cells recover from heart attacks)。 心臟病發作後,當心肌細胞因缺氧而受損時,它們受損的線粒體會釋放稱為活性氧的分子。 這些分子向附近的間充質幹細胞發出警報,間充質幹細胞開始產生更多的線粒體,並將 TNT 指向它們患病的鄰居。 然後,幹細胞透過 TNT 連線捐贈健康的替代線粒體。 羅德里格斯解釋說,透過這種方式,幹細胞既是受損組織的感測器,也是救援者。
加利福尼亞大學聖地亞哥分校的再生醫學和幹細胞研究員斯蒂芬妮·切爾基 (Stephanie Cherqui) 偶然發現 TNT 在她正在開發的胱氨酸病治療中起著關鍵作用,胱氨酸病是一種由單個缺陷基因引起的罕見疾病。 這種缺陷會導致氨基酸胱氨酸在全身組織中積累到有毒水平,尤其對腎臟造成損害。
切爾基治療該疾病的策略(她正在小鼠模型中開發)是從骨骼中提取造血(產生血液的)幹細胞,並將缺陷基因的功能複製插入其中。 然後,她可以用化療清除骨髓中原有的幹細胞,並引入工程幹細胞,以便它們能夠重新建立自己。
“我的同行懷疑骨髓幹細胞是否會對組織損傷有任何作用,”切爾基說。 “我也非常驚訝地看到,血液幹細胞可以在胱氨酸病小鼠模型的餘生中修復組織損傷。”
工程幹細胞究竟是如何拯救小鼠的? 切爾基解釋說,首先,它們分化成稱為巨噬細胞的免疫細胞,並遷移到受損的腎臟組織。 到達那裡後,巨噬細胞與受損細胞形成 TNT,並將溶酶體(裝滿健康酶的小包裹)轉移到患病細胞。 患病細胞也透過相同的通道將它們有缺陷的溶酶體送回巨噬細胞。
“這是我們展示的一種新的作用機制,現在我們認為我們可以將這種治療方法應用於比我們想象的更多的疾病,”切爾基說。
她正在使用類似的方法來治療一種稱為弗裡德賴希共濟失調的線粒體疾病。 她說:“我們真的很驚訝地看到,我們可以完全拯救該疾病的小鼠模型”。 在初步的細胞培養研究中,她表明,工程治療性幹細胞可以變成巨噬細胞,透過 TNT 傳遞健康的線粒體。 她現在正在研究包括大腦、心臟和肌肉在內的組織中的這個過程。
“令人驚歎的是,研究進展如此之快,以及我們現在對 TNT 參與健康或疾病的多少個不同方面瞭解了多少,”切爾基說。 “我真的相信這些細胞質突起是人類健康和疾病狀態的關鍵。”
基本功能
雖然許多科學家對 TNT 及其闡明健康和疾病許多方面的潛力感到興奮,但其他人仍然持懷疑態度,因為對 TNT 的基本生物學知識瞭解得還不夠透徹。
研究它們的研究人員一致認為,迫切需要了解觸發這些微小管形成的細胞訊號通路,確定可用於更清晰地標記它們的生物標誌物,並表徵奈米管和微管的結構和功能多樣性。
“我們需要優秀的細胞生物學家來研究所有亞型。 我們現在不知道分子機制是否真的相似,”溫克勒說。 “還有很多東西要學習。”
Zurzolo 同意,需要對這些結構的本質和作用進行嚴格的科學論證,以推動該領域向前發展。 儘管如此,她仍然相信 TNT 很重要。 “我確信它們 [TNT] 將有很多功能,並且它們將與許多疾病有關,因為歸根結底,它是細胞間通訊,”她說。 “這是細胞的基本功能。”
經《量子雜誌》 (Quanta Magazine) 許可轉載,該雜誌是西蒙斯基金會 (Simons Foundation) 的編輯獨立出版物,其使命是透過報道數學、物理和生命科學的研究進展和趨勢來增進公眾對科學的理解。