卡特琳每天有六次會暫停手頭的工作,從口袋裡拿出一小塊磁鐵,觸控到她鎖骨下方一塊凸起的皮膚。60秒內,她會感到喉嚨裡傳來輕微的震動。如果她說話,聲音會顫抖。然後,這種感覺就會消退。
磁鐵啟動了一個植入式裝置,該裝置會發出一系列電脈衝——每個脈衝約一毫安,類似於典型助聽器所消耗的電流。這些脈衝刺激了她的迷走神經,這是一束從腦幹向下延伸到幾個主要器官(包括心臟和腸道)的纖維。
迷走神經刺激技術自 1990 年代以來一直用於治療癲癇,自 2000 年代初以來一直用於治療抑鬱症。但卡特琳是一位 70 歲的阿姆斯特丹健身教練(她要求在此報道中使用化名),她用它來控制類風溼性關節炎,這是一種自身免疫性疾病,會導致關節周圍和其他組織中的軟骨破壞。她五年前參加的一項臨床試驗是同類試驗中的首例人體試驗,它代表了二十年來研究神經系統和免疫系統之間聯絡的成果。
支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道: 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們當今世界的發現和想法的具有影響力的故事的未來。
對於紐約州曼哈塞特范斯坦醫學研究所的神經外科醫生凱文·特雷西來說,迷走神經是這種聯絡的主要組成部分,他說電刺激可能代表治療自身免疫性疾病(如狼瘡、克羅恩病等)的更好方法。
幾家製藥公司正在投資“生物電子藥物”——可以調節神經的裝置——以治療心血管和代謝疾病。但如果特雷西用這種裝置控制炎症的目標取得成功,那將是一個重大的飛躍。
肯特州立大學的神經科學家黛安·洛頓說,他是一位先驅,“他讓很多人加入進來並在這個領域進行研究”,她花了 30 年時間研究滲透到淋巴結和脾臟等免疫器官的神經。但她和其他觀察家警告說,抗炎作用的神經迴路尚未得到充分理解。
特雷西承認這種批評,但仍然看到了電刺激的巨大潛力。“在我們有生之年,我們將看到裝置取代某些藥物,”他說。他認為,對迷走神經或其他周圍神經進行電擊可以治療從糖尿病到高血壓和出血等多種疾病。“這是一個領域的開始。”
電擊價值
特雷西最初走上神經免疫學之路純屬偶然。1998 年,他正在研究一種實驗性藥物 CNI-1493,該藥物透過降低一種名為腫瘤壞死因子-α (TNF-α) 的強效免疫蛋白水平來抑制動物的炎症。CNI-1493 通常透過血液給藥,但有一天,特雷西決定將其注射到大鼠的大腦中。他想看看它是否會降低中風期間大腦中的 TNF-α 水平。但發生的事情讓他感到驚訝。
大腦中的 CNI-1493 降低了動物全身 TNF-α 的產生。其他實驗表明,與直接注射到血液中相比,它的效力高出約 100,000 倍1。特雷西推測該藥物作用於神經訊號。
他的後續實驗支援了這一觀點。在將 CNI-1493 注射到大腦幾分鐘後,特雷西看到一股活動波紋沿著大鼠的迷走神經向下傳播2。這條神經高速公路調節一些非自主功能,包括心率、呼吸和將食物推入腸道的肌肉收縮。特雷西認為它也可能控制炎症。當他切斷神經並且藥物的強大作用消失時,他確信了。“那是一個遊戲規則改變者,”特雷西說。這一發現意味著,如果可以刺激迷走神經,甚至不需要藥物。
因此,他嘗試了一個關鍵的實驗。他給一隻大鼠注射了致命劑量的內毒素,內毒素是細菌細胞壁的一種成分,它會使動物陷入炎症、器官衰竭和死亡的惡性迴圈。該藥物的效果大致反映了人類的感染性休克。然後,特雷西使用電極刺激動物的迷走神經。與未治療的動物相比,接受治療的大鼠血液中的 TNF-α 含量僅為四分之一,而且它們沒有出現休克3。
特雷西立即看到了迷走神經刺激作為阻斷 TNF-α 和其他炎症分子激增的一種方式的醫療潛力。公司已經開始銷售用於治療癲癇的植入式刺激器。但是,要將該技術擴充套件到炎症性疾病,特雷西需要更清楚地說明其工作原理以及可能產生的副作用。
在接下來的 15 年裡,特雷西的團隊進行了一系列動物實驗,以確定迷走神經刺激的作用部位和作用方式。他們嘗試在不同位置切斷神經4,並使用阻斷特定神經遞質的藥物5。這些實驗似乎表明,當迷走神經受到電擊時,訊號會沿著它向下脈衝到腹部,然後透過第二根神經進入脾臟。
脾臟有點像免疫學的卡車停靠站,迴圈免疫細胞會在那裡定期停留一段時間,然後再返回血液。特雷西的團隊發現,進入脾臟的神經會釋放一種稱為去甲腎上腺素的神經遞質6,它直接與脾臟中稱為 T 細胞的白細胞進行通訊。神經和 T 細胞之間的連線實際上類似於兩個神經細胞之間的突觸;特雷西說,T 細胞幾乎就像神經元一樣在發揮作用。當受到刺激時,T 細胞會釋放另一種神經遞質,稱為乙醯膽鹼,然後乙醯膽鹼與脾臟中的巨噬細胞結合。正是這些免疫細胞通常會在動物接受內毒素時將 TNF-α 噴射到血液中。然而,暴露於乙醯膽鹼會阻止巨噬細胞產生炎症蛋白(參見'免疫系統的衝擊')。
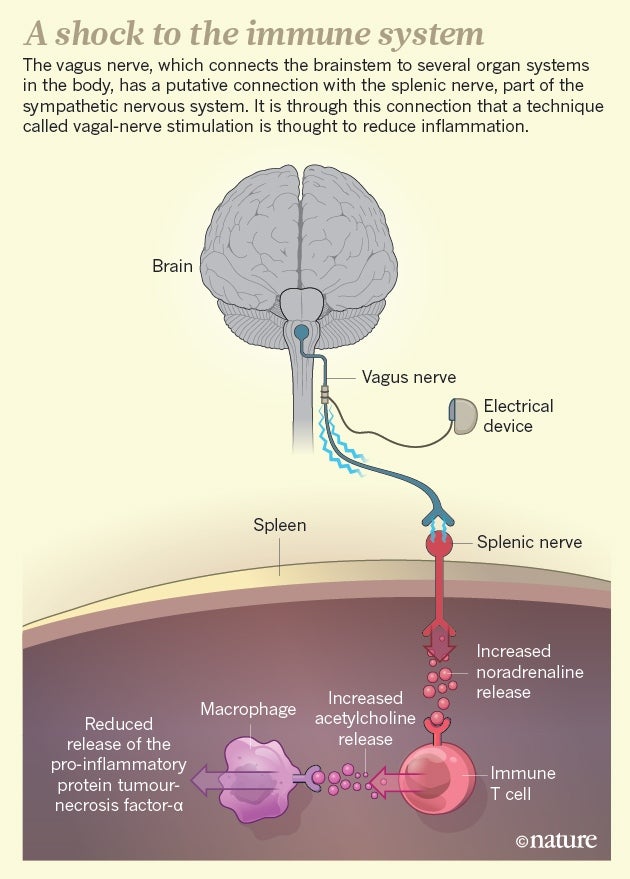
特雷西的發現為幾十年來一直在進行的研究賦予了新的意義。在 1980 年代和 1990 年代,當時在紐約羅切斯特大學擔任神經解剖學家的戴維·費爾頓捕捉到了各種動物體內混合神經元-T 細胞突觸的顯微影像7——不僅在特雷西看到的脾臟中,而且在淋巴結、胸腺和腸道中也發現了。這些神經元屬於所謂的交感神經系統,該系統調節身體對某些應激源的反應。正如特雷西在脾臟中發現的那樣,費爾頓觀察到這些交感神經元透過分泌去甲腎上腺素來刺激其 T 細胞夥伴——而且,這種刺激通常有助於減輕炎症。
2014 年,日本大阪大學的神經免疫學家中井明子報告說,有證據表明交感神經對 T 細胞的刺激會限制它們離開淋巴結並進入迴圈系統,否則它們可能會在身體其他部位引起炎症8。但在許多自身免疫性疾病中,這種神經訊號傳導被破壞了。
洛頓和她的雙胞胎姐妹、加利福尼亞州洛馬琳達大學的神經科學家丹尼斯·貝林格發現,在自身免疫性疾病的大鼠模型中,交感神經通路發生了改變9。人類也觀察到同樣的情況。交感神經因去甲腎上腺素過度釋放而受損,這導致它們從本應調節的免疫細胞中撤出。隨著疾病的進展,這些神經又會回到它們放棄的組織中——但它們以異常的方式這樣做,並與不同的免疫細胞亞群建立聯絡。這些重組的神經通路實際上維持了炎症,而不是抑制炎症9。貝林格說,這種情況發生在脾臟、淋巴結和關節等部位,並導致了大量的病理。
但她、洛頓和其他人對特雷西關於迷走神經刺激降低炎症的途徑的說法持懷疑態度。澳大利亞墨爾本大學的神經科學家羅賓·麥卡倫一直在尋找迷走神經與刺激脾臟中 T 細胞的神經之間的聯絡——但到目前為止,他還沒有找到。
貝林格說,迷走神經刺激“是透過其他神經間接起作用的”。她說,在轉向人體治療之前,正確繪製這些神經迴路圖非常重要。“解剖結構對於你可能會看到的副作用型別有很大影響。”
然而,即使是這些懷疑論者也看到了特雷西方法的潛力。貝林格指出,在許多自身免疫性疾病中,不僅交感神經在重組成促炎迴路時變得過度活躍,而且與之相對的迷走神經也變得不活躍。迷走神經刺激可能部分恢復這兩個神經系統之間的平衡。“這是第一步,”她說。“我相信他們會將其引入臨床,並且他們會顯示出顯著的效果。”
患者方法
接受迷走神經刺激治療癲癇或抑鬱症的人會出現一些副作用——例如喉部疼痛和緊繃,或聲音嘶啞;卡特琳在刺激迷走神經時會感到輕微的版本。電擊這條神經還會降低心率或增加胃酸等其他影響。
在這方面,特雷西有理由感到樂觀。人類的迷走神經包含大約 100,000 根獨立的神經纖維,這些纖維分支出來到達各個器官。但是,觸發神經活動所需的電量在不同的纖維之間可能會相差 50 倍之多。
特雷西的前研究生雅科夫·萊文已經計算出,參與減少炎症的神經纖維具有較低的啟用閾值。只需 250 毫微安(安培的十億分之一)即可將其開啟——這只是通常用於抑制癲癇發作的電量的八分之一。儘管接受癲癇發作治療的人每天需要長達數小時的刺激,但動物實驗表明,單次短暫的電擊就可以長時間控制炎症10。萊文說,受到乙醯膽鹼衝擊的巨噬細胞在長達 24 小時內都無法產生 TNF-α,他現在在曼哈塞特的 SetPoint Medical 公司工作,該公司成立的目的是將迷走神經刺激商業化為一種醫療方法。
到 2011 年,得益於動物研究和萊文的最佳化努力,SetPoint 準備在人體中嘗試該技術。首次試驗由阿姆斯特丹大學和英國製藥公司葛蘭素史克公司的風溼病學家保羅-彼得·塔克監督。在幾年時間裡,包括卡特琳在內的 18 名類風溼性關節炎患者植入了刺激器。
她和其他 11 名參與者在 6 周的時間內症狀有所改善。實驗室測試表明,他們血液中炎症分子(如 TNF-α 和白細胞介素-6)的水平降低。當裝置關閉 14 天后,這些改善消失了——然後在重新開始刺激後又恢復了。
卡特琳從此以後一直在使用刺激器,她仍然每週注射一次抗風溼藥物甲氨蝶呤,以及每天服用一次名為雙氯芬酸的抗炎藥——但她能夠停止服用大劑量免疫抑制類固醇,她的關節也得到了足夠的改善,可以重返工作崗位。這項試驗的結果於去年 7 月發表在《美國國家科學院院刊》上11。
另一項迷走神經刺激試驗的結果也在同一時間左右發表12。法國格勒諾布林大學醫院的胃腸病學家布魯諾·博納茲將刺激器植入到七名克羅恩病患者體內。在六個月的時間裡,其中五人報告說症狀有所減輕,對他們腸道的內窺鏡檢查顯示組織損傷減少。SetPoint 也正在進行一項針對克羅恩病的迷走神經刺激治療的臨床試驗,目前已進行到一半。
特雷西和博納茲並不是唯一希望利用神經迴路治療炎症的人。加利福尼亞大學聖地亞哥分校的創傷外科醫生勞爾·科因布拉正在研究它作為治療感染性休克的方法,感染性休克每年影響數十萬人。許多死於這種疾病的人都被一個單一事件推到了不歸路:腸道內壁的迅速惡化,這會將細菌釋放到體內——從而引發炎症,損害包括肺和腎臟在內的器官。
與特雷西一樣,科因布拉也透過刺激迷走神經,無論是透過電刺激13還是透過施用一種名為 CPSI-121 的實驗性藥物(參考文獻14),成功地抵消了動物體內的這種致命序列。科因布拉希望將這項工作帶入臨床試驗。但他的研究也揭示了迷走神經刺激必須克服的另一個主要挑戰:與大鼠不同,有些人可能對該技術具有抵抗力。
人類基因組編碼了一種在其他動物中未發現的額外的、非功能性乙醯膽鹼受體蛋白。科因布拉的合作者託德·科斯坦蒂尼也在加利福尼亞大學聖地亞哥分校,他發現如果這種異常受體產生量足夠大,它會破壞訊號傳導,並使巨噬細胞對乙醯膽鹼無反應。即使受到迷走神經刺激,它們也可能繼續釋放 TNF-α15。科斯坦蒂尼說,人們產生的這種蛋白質的數量範圍相差 200 倍。他計劃對人們進行測試,以確定高水平是否真的會阻斷迷走神經刺激的抗炎作用。軼事證據表明,情況可能確實如此。
迄今為止進行的小型臨床試驗表明,有些人對迷走神經刺激沒有反應。可能是測試可以確定哪些人會從治療中受益,然後再給他們植入植入物。
然而,儘管存在不確定性,生物電子藥物領域正開始獲得動力。去年 10 月,美國國立衛生研究院宣佈了一項名為“刺激周圍活動以緩解疾病 (SPARC)”的計劃,該計劃將在 2021 年之前提供 2.38 億美元的資金,以支援研究更新胸腔和腹腔神經迴路圖。
葛蘭素史克公司也表現出興趣。它已投資 SetPoint,並於去年宣佈與谷歌成立一家合資企業——名為 Galvani Bioelectronics——將開發一系列疾病的療法,包括炎症性疾病。
迷走神經刺激是否能達到預期效果還有待觀察。迄今為止接受治療的人數微乎其微——在 2 項已完成的試驗中只有 25 人。而且治療方法在這些早期試驗中通常看起來很有希望,但在規模更大的試驗中卻會失敗。
但自身免疫性疾病患者開始注意到這一點。類風溼性關節炎和克羅恩病的治療存在一定的風險,並且並非對所有人都有幫助。卡特琳是 1000 多名諮詢迷走神經刺激試驗的人之一。“我別無選擇,”她說。“我想要它。”
編者注:本文的早期版本錯誤地暗示凱文·特雷西發起了首個人體類風溼性關節炎迷走神經刺激試驗。實際上是 SetPoint Medical,一家他共同創立的公司。此外,主持該試驗的保羅-彼得·塔克於 2011 年加入葛蘭素史克公司,而不是 2016 年。
本文經許可轉載,並於2017 年 5 月 3 日首次釋出。