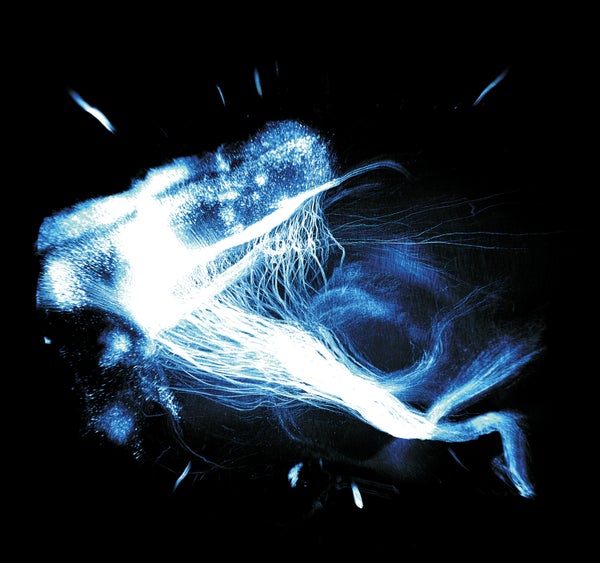
我們的神經系統就像一張掛毯,由相互連線的線編織而成。這些線,即從神經元延伸出的稱為軸突的細纖維,將電資訊從單個神經細胞傳遞到接收訊號的其他神經元。長程投射軸突,就像紡織品中的結構性“經”線,與大腦自身版本的交叉“緯”線交織在一起:軸突在短距離內來回纏繞,傳遞訊號以執行計算。
為了理解大腦的內部運作,科學家需要解讀這種神經掛毯在單個元素層面的組織方式,例如單個軸突。但是,為了理解軸突的作用,我們也希望獲得跨越整個大腦的全域性視角,並且在某種程度上不會忽視單個線狀軸突及其背景。為了獲得這樣的視角,我們需要一種特殊的工具,因為大腦不像編織布那樣是扁平的,也不是透明的。遍佈大腦的脂肪分子(脂質),尤其是在細胞膜中,會導致來自成像裝置的光散射,從而極大地阻礙我們超越最表層細胞進入大腦深處的視野。
現在,一項新技術為神經科學家開啟了令人興奮的前景,創造了一種觀察完整大腦內部的方法,既可以確定軌跡,又可以定義編織穿梭於大腦複雜內部運作的單個連線纖維的分子特性。這種方法建立在水凝膠的化學基礎上,水凝膠是一種聚合物,可形成能夠保留水分而不會溶解的連通隔室的三維網路。它用於在生物組織內建立3D聚合物內骨骼。在這個三步過程中,首先在實驗動物或死後人類大腦本身內形成透明凝膠,該凝膠與大腦的關鍵資訊豐富的分子部分(包括蛋白質和核酸(DNA和RNA))相連,從而起到保護作用。緊隨其後的是去除不感興趣或散射光的組織成分,例如脂質。最後,透過在該結構中引入大量的熒游標記物和其他標記物——除了透明之外,該凝膠還被設計為允許這些探針的快速注入——科學家可以照亮並直接視覺化整個完整大腦中各種感興趣的纖維和分子,並具有非常高的解析度。
支援科學新聞報道
如果您喜歡這篇文章,請考慮支援我們屢獲殊榮的新聞報道,方式是 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們今天世界的發現和想法的有影響力的故事的未來。
這種觀察人體主控者深處的新能力正在帶來許多見解。科學家們正在使用這種方法將物理形式與參與行動和認知的神經通路的生物功能聯絡起來,範圍從運動到記憶。該方法還有助於闡明導致帕金森病、阿爾茨海默病、多發性硬化症、自閉症、藥物濫用以及恐懼和焦慮症的過程。我們甚至幫助成立了一家公司,探索組織-水凝膠在癌症診斷中的應用。這種方法現在正被應用於大腦以外的全身各個器官和組織。
變得透明
製造透明大腦非常困難,以至於即使經過數億年的進化,大型動物的譜系中也未曾實現這一壯舉。當然,隱形可以提供巨大的優勢,一些物種經過進化選擇,具有一定程度的透明度以適應其環境(例如,為了躲避捕食者)。某些魚類甚至缺乏紅色的血紅蛋白,基本上放棄了大多數脊椎動物所知的血液,從而實現了一定程度的隱形。然而,即使是這些動物似乎也無法使其中樞神經系統透明,儘管存在巨大的進化壓力。在部分透明的魚類或蝦類中,神經系統仍然至少部分不透明;進化甚至可以放棄紅細胞,但似乎沒有任何東西可以讓光線暢通無阻地穿過大型活體大腦。
這種不透明的性質是由於光在神經組織中散射造成的。光子從脂肪和水的介面反彈(因為光在這兩種物質中傳播速度的差異),並且朝著看似隨機的方向(因為神經線路的結構複雜性)。這種效應不容易被輕易地工程化或進化掉。構成細胞膜和腦細胞內部結構的脂質屏障也起著關鍵作用,作為離子絕緣材料,離子介導沿錯綜複雜的軸突的電脈衝流動。具有諷刺意味的是,生物學家最需要保持完整以進行理解的器官,也是我們最無法使其透明的器官。
2009年,我轉向了使完整、成熟的哺乳動物大腦透明這一尚未解決的挑戰——同時仍然允許對內部各種分子進行詳細標記。那時,世界各地數百個實驗室已經開始使用我和我的同事在2004年至2009年之間開發的一項技術,該技術使用光來關閉和開啟特定的腦回路元件。這項稱為光遺傳學的技術,結合了雷射、光纖和來自藻類和細菌的光敏蛋白(稱為微生物視蛋白)的基因,以在動物奔跑、跳躍、游泳、社交和執行復雜行為時,精確控制整個活體大腦中特定細胞的神經活動。到2009年夏天,在2004年7月首次使用微生物視蛋白在神經元中進行實驗演示五年後,光遺傳學的關鍵挑戰已基本解決,該技術可以輕鬆且普遍地應用。儘管此後透過這種方法發現了數千種關於行為因果神經機制的新見解,但僅光遺傳學無法提供另一種關鍵型別的資訊:高解析度影像,可提供對受光控制的單個細胞的全腦佈線的深入瞭解。
將系統的宏觀圖景與其單個基本元件聯絡起來是許多科學領域共同的願望,儘管這個目標經常(且適當地)被犧牲。將複雜系統的各個部分分離出來進行孤立分析一直是科學必不可少的,因為從上下文中移除元件可以確定哪些屬性是內在的,並且不依賴於其他元素。但是對於大腦這樣高度互連的結構,將系統拆開,就像分離掛毯的所有線一樣,並不總是理解和欣賞宏觀圖景的最佳策略。
點選或輕觸放大

圖片來源:艾米麗·庫珀
對於視覺化和標記,成年哺乳動物大腦的不透明性長期以來決定了必須進行拆卸,通常是透過切片大腦,從而將組織的三維體積變成數百或數千個實際上是二維的切片。這個過程消耗了令人望而卻步的時間和費用,特別是當需要許多大腦來產生有意義的統計結果時(這在哺乳動物行為研究中很常見)。此外,關鍵資訊會不可逆轉地丟失。因為,透過光遺傳學,我們已經在完整的大腦中構建新的功能,所以在2009年,我開始考慮我們還可以在大腦中構建什麼來幫助我們解決這個問題。
這個想法的種子早在15年前就種下了。在1990年代中期,我對嘗試在實驗室中構建類似大腦的迴路產生了興趣,從單個細胞開始。一種方法可能是將神經幹細胞播種到聚合物支架上,在那裡可以透過生化方法誘導它們轉化為神經元。在追求這項努力的過程中,我深入研究了水凝膠的科學和工程文獻,水凝膠似乎特別適合作為支架,因為它們具有生物相容性和透明性。
在後來的幾年裡,我最終只會進行簡單的初步實驗,將幹細胞播種到聚合物支架上並將它們轉化為神經元,但我從未達到從單個細胞製造完整的大腦樣結構的地步——這是一項極其具有挑戰性的任務。儘管如此,當我從一個實驗室搬到另一個實驗室,並在我的職業生涯中一步步前進時(1998年獲得神經科學博士學位,完成精神病學住院醫師和博士後研究,並在2004年在斯坦福大學啟動我的工程實驗室),我還是盡職盡責地拖著我那越來越佈滿灰塵的資料夾,上面貼著“水凝膠”標籤的仔細裝訂的論文。但是,心理支架已經到位,這個想法紮根並最終發展,在實驗室中一些非常有才華的人的關鍵參與下,成為構建透明且可訪問的大腦的可行策略。
2010年2月,在長時間思考全腦視覺化問題後,我在辦公桌前畫了一張草圖,描繪了基本思想。這是最初概念的顛倒——我們不是從水凝膠開始並在其中構建大腦,而是從大腦開始並在其中構建水凝膠。水凝膠將充當支撐結構並保留我們關心的腦元件(如蛋白質和核酸)的空間位置,但允許去除所有其他阻止我們深入觀察的東西。與此同時,它可以防止大腦在結構性但不太有趣的成分被溶解或消化掉時塌陷成無定形的湯。
最早的實驗,跨越了不同的領域,併為原本只是可能的想法帶來了初步的雛形,幾年後,隨著時間的推移帶來的廣闊視野,才能更好地理解它們。當時在實驗室的兩名富有創造力和勇氣的研究人員——薇薇安娜·格拉迪納魯和實驗室經理查魯·拉馬克裡希南——是第一批願意承擔這個艱鉅專案的人。失敗的風險太高了,所以我決定不讓整個團隊參與;我認為這兩位經驗豐富的研究人員(已經在其他專案中取得了巨大成功)可以應對風險和失望,如果專案最終失敗了。
從2010年初開始,格拉迪納魯和拉馬克裡希南試圖使神經元免受會破壞精細組織結構和細胞膜的試劑的損害。從理論上講,用某種耐用聚合物填充腦細胞可能會奏效,如果神經元受到水凝膠的支撐,那麼神經元將保持完整。兩人嘗試了多種策略,包括引入編碼某些酶的基因,以允許神經元製造耐久聚合物,如幾丁質和纖維素。格拉迪納魯的一個創造性想法被證明是最好的方法,即在細胞內部製造另一種生物聚合物角蛋白的過程。她已經證明,培養神經元中的角蛋白可以保護細胞結構免受破壞,並推斷對於完整的腦組織(神經元用角蛋白穩定,並新增水凝膠以提供外部支撐),脂質可以用洗滌劑洗掉,以顯示懸浮在透明水凝膠中的目標腦結構。
在那時,在完整大腦中構建水凝膠還只是一個純粹的想法。我決定透過從化學工程師那裡尋求更深入的經驗來加快專案進度。儘管實驗室外沒有人知道這個專案,但我還是在我的收件箱中搜索了可能有水凝膠方面合適背景的潛在博士後研究員的電子郵件。當時在佐治亞理工學院的傑出化學工程師鄺宏勳的名字出現了。鄺宏勳聽說過我們的光遺傳學和幹細胞工作,並有興趣加入實驗室。
2010年3月初,就在我繪製上面插圖中顯示的原始草圖幾周後,我在猶他州開會時安排了我們的第一次簡短電話交談。然後我做了一件我以前從未做過(或之後)的事情,因為我非常確信這個新方向。我邀請鄺宏勳加入我們的團隊,甚至沒有進行實驗室訪問或面對面面試。對於神經科學實驗室來說,這是一個奇怪的時期——一位化學工程師不知從哪裡冒了出來。
鄺宏勳到任後,立即投入到這個秘密專案中。到2010年底,我實驗室的三人團隊創造出了透明的小鼠大腦塊,其中儲存的含角蛋白和水凝膠包埋的細胞可以清晰地看到,甚至可以深入組織內部數百微米,這比使用現有方法可能達到的深度要大得多。鄺宏勳生產的第一個完全功能的水凝膠是基於丙烯醯胺,丙烯醯胺通常在實驗室中用於分離核酸或蛋白質。從這項創造性工作中產生的凝膠-組織混合物被設計為我們可以直接引入熒游標記物和其他標記物,以視覺化儲存的蛋白質和結構,例如軸突,經過多輪標記,我們發現我們不再需要角蛋白成分來保持細胞結構到位——僅水凝膠就足夠了。儘管漢斯-烏爾裡希·多特和宮脇敦史(分別是3DISCO和Scale方法)在其他方法方面進行了開創性的工作,但此前尚未在成年哺乳動物大腦中實現如此高的透明度和可及性。
這種特定的基於丙烯醯胺的水凝膠內建組織想法的變體(現在已經有許多其他已發表的變體)被命名為CLARITY(代表clear lipid-exchanged acrylamide-hybridized rigid imaging/immunostaining/in situ hybridization-compatible tissue-hydrogel,即透明脂質交換丙烯醯胺雜交剛性成像/免疫染色/原位雜交相容組織水凝膠)。自從我們在2013年發表該技術以來,即使是這種單一版本的組織-水凝膠技術也已被用於各種基礎科學應用,並已在臨床上應用(例如,用於自閉症或阿爾茨海默病患者的死後大腦),以及用於小鼠的脊髓和大腦(例如,在發現以前未知的恐懼和焦慮行為控制通路中)。世界各地實驗室的許多論文現在已經發表,使用這種通用方法來理解神經系統的基本結構,通常與光遺傳學結合使用,併為理解適應性和適應不良的大腦回路提供新的想法。
正如微生物視蛋白光遺傳學的最初五年帶來了許多創新,使得該方法得到廣泛應用一樣,用於構建大腦內部組織-水凝膠的技術在該方法存在的最初幾年也取得了巨大的進步。例如,最早版本的水凝膠技術描述了一個步驟,該步驟使用施加的電場來加速快速清除結合到脂質的帶電洗滌劑顆粒。這個步驟需要一些練習才能掌握,如果電壓調得太高,組織可能會受損。為了解決這個問題,從2014年初開始,當時還是實驗室成員的拉朱·託默、布萊恩·許和葉禮發表了兩篇論文(一篇與我們在瑞典的同事合著),定義了該步驟的簡化版本。它被稱為被動CLARITY,因為它不使用電場。託默和團隊還描述了使用高解析度快速光片顯微鏡的專門大腦-水凝膠成像,該顯微鏡經過調整以應對快速成像大型水凝膠體積的獨特挑戰,透過掃描平面(光片)而不是光點。
格拉迪納魯和鄺宏勳當時都在各自蓬勃發展的實驗室工作(分別在加州理工學院和麻省理工學院),各自都在產生重大的新創新。事實上,隨後的發展不僅來自他們,也來自許多其他研究人員,進展迅速。格拉迪納魯獨立開發並發表了一種適用於整個生物體的CLARITY策略,稱為PARS。格拉迪納魯和鄺宏勳都發表了新的水凝膠配方,分別稱為PACT和SWITCH,現在世界各地的實驗室已經描述了各種各樣的組織-水凝膠複合材料。然而,當涉及到實驗性地探索可能的水凝膠時,我們才剛剛觸及皮毛。2013年,鄺宏勳和我公開了一份非常長的可能的水凝膠變體成分清單,從丙烯酸酯到藻酸鹽等等,我的實驗室和我們的合作者現在正在探索聚合物甚至可以變得活躍的方式——例如,用可以產生可調電導率或化學反應性的元素進行修飾,從而開闢新的可能性。
與組織-水凝膠複合材料的特性相關的另一個挑戰是,正如我們在2013年和2014年的論文中描述的那樣,它會導致水凝膠包埋的組織物理膨脹相當大。複合材料的這種特性並不總是一個問題,並且可以與高解析度成像相容,無論是在原始CLARITY還是在後來的類似腦內水凝膠配方中(每種配方都有其自己的識別首字母縮寫:從2014年開始的PACT/ePACT,以及2015年和2016年的ExM/proExM和MAP),這些配方由其他促進基本膨脹效應的組開發。但是,為了能夠將我們的透明大腦與學術大腦圖譜中的大腦進行比較,這需要精確、未受干擾地再現原始組織,我們開發了最終的可選步驟,用於將擴大的組織縮小回原始大小。
與葉禮和另一位團隊成員威爾·艾倫一起,我的實驗室還開發併發布了高速和自動化成像和分析軟體,任何人都可以下載和使用。我們同事馬克·泰西耶-拉維涅(當時在洛克菲勒大學,現在是斯坦福大學校長)的團隊也為他們的新iDISCO方法做了同樣的事情。這兩篇互補的論文於今年在同一期《細胞》雜誌上發表。我的團隊,包括艾米麗·西爾韋斯特拉克、普里亞·拉賈塞圖帕蒂和馬修·賴特,也已經能夠使用另一種組織-水凝膠配方,在完整的大腦中可靠地進行一次對多種RNA進行至關重要的熒游標記,正如我們早些時候在3月份的《細胞》雜誌論文中報道的那樣。
標記多種型別分子的能力,包括核酸(如RNA),被證明是水凝膠方法的一個特殊優勢,並開闢了基因表達分析的廣闊領域。隨著所有這些挑戰的解決——其中許多挑戰僅在今年才解決——該技術現在已經成熟到可以被世界各地的實驗室使用。
將線索彙集在一起
回顧過去,將2010年的最初簡陋草圖與僅僅六年後的完全功能實現和整合進行比較,真是令人矚目。推動組織-水凝膠願景發展的關鍵目標一直是使用完整大腦結構資訊來補充完整大腦光遺傳學——這個目標已經實現,並在幾篇論文中報道過,包括6月16日《細胞》雜誌上的一篇論文。該論文中描述的工作重點是大腦的前額葉皮層,該區域負責調節高階認知過程和情緒。科學家們希望,瞭解這種結構如何控制如此多樣化的行為,可能有助於深入瞭解自閉症和精神分裂症等精神疾病。
與當時在我團隊中的葉禮、艾倫和金·湯普森,以及其他實驗室的同事,包括斯坦福大學的駱利群和詹妮弗·麥克納布的實驗室,我的團隊首先使用光遺傳學來定義前額葉皮層中的一個細胞群,該細胞群在獎勵性體驗(如非常美味的食物甚至可卡因)期間活躍(並且還控制對獎勵性體驗的適當行為反應)。接下來,我們發現了前額葉細胞的互補群體,用於負面(厭惡)體驗。最後,使用我們最新的組織-水凝膠方法,我們能夠證明這兩個不同的細胞群體在大腦中的佈線方式各不相同——陽性群體優先向稱為伏隔核的深部大腦結構傳送連線,而陰性群體更連線到稱為外側韁核的深部結構。透過這種方式,組織-水凝膠和光遺傳學方法使科學家能夠以以前不可能的方式研究完整的生物組織,並在理解健康和疾病的基本生物學方面取得進展。
對複雜系統的最充分理解來自於在區域性和全域性尺度上交換資訊的能力,無論所討論的系統是整個大腦還是複雜的掛毯。在神經科學中,現在可以收集大量資料,其中包含豐富而多樣化的細節,闡明完整器官的結構、分子成分和細胞活動。因此,對大腦功能的廣泛而細緻的視角開始形成。
以區域性解析度實現這種全域性視角是困難且不常見的——但迎接這一挑戰非常重要。複雜系統的湧現特性通常源於區域性相互作用,就像掛毯的編織和科學過程本身一樣。只有從廣闊的視角來看,每種線的角色才能變得清晰。