1月19日,裡克·克勞斯納(Rick Klausner)和漢斯·畢曉普(Hans Bishop)聯合公開啟動了一項名為Altos Labs的衰老研究計劃,該計劃獲得了包括科技投資者尤里·米爾納(Yuri Milner)和亞馬遜創始人傑夫·貝佐斯(Jeff Bezos)在內的支持者提供的30億美元初始資金。這是近期湧現的投資熱潮中的最新舉措,這些投資旨在基於表觀遺傳重程式設計(修改DNA上的化學標記以開啟或關閉基因)的基礎研究,構建抗衰老幹預措施。12月,加密貨幣公司Coinbase的聯合創始人布萊恩·阿姆斯特朗(Brian Armstrong)和風險投資家布萊克·拜爾斯(Blake Byers)創立了NewLimit,這是一家專注於衰老的生物技術公司,獲得了1.05億美元的初始投資,加州大學舊金山分校的亞歷克斯·馬森(Alex Marson)和斯坦福大學的馬克·戴維斯(Mark Davis)擔任顧問。
“山中因子”——四種轉錄因子(Oct3/4、Sox2、c-Myc和Klf4),這些蛋白質可以將完全成熟的細胞重程式設計為胚胎樣狀態——的發現為京都大學研究員山中伸彌贏得了2012年諾貝爾獎的共享獎項。這項於2006年描述的發現,透過提供一種新的細胞來源,即類似於胚胎幹細胞的細胞,從而改變了幹細胞研究,胚胎幹細胞能夠分化成體內除性細胞外的任何型別的特化細胞。這些誘導多能幹細胞(iPSC)的獲得不需要人類胚胎。但在最近幾年,山中因子也成為另一個新興領域的焦點:讓衰老的時鐘倒轉。
所謂的“部分重程式設計”是指將山中因子應用於細胞足夠長的時間,以逆轉細胞衰老和修復組織,但不會使其回到多能性狀態,即細胞可以分化成其他細胞型別的狀態。包括斯坦福大學的維托里奧·塞巴斯蒂亞諾(Vittorio Sebastiano)、索爾克研究所的胡安·卡洛斯·伊茲皮蘇阿·貝爾蒙特(Juan Carlos Izpisúa Belmonte)和哈佛醫學院的大衛·辛克萊(David Sinclair)(見表)領導的幾個研究小組已經表明,部分重程式設計可以顯著逆轉哺乳動物培養細胞甚至齧齒動物模型中與年齡相關的特徵,方法是對抗與衰老相關的表觀遺傳變化。這些結果激發了人們將動物模型中的見解轉化為抗衰老幹預措施的興趣。“這是一場現在已經變成競賽的追求,”位於英國劍橋的Shift Bioscience執行長兼創始人丹尼爾·艾夫斯(Daniel Ives)說。
支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們今天世界的發現和想法的有影響力的故事的未來。
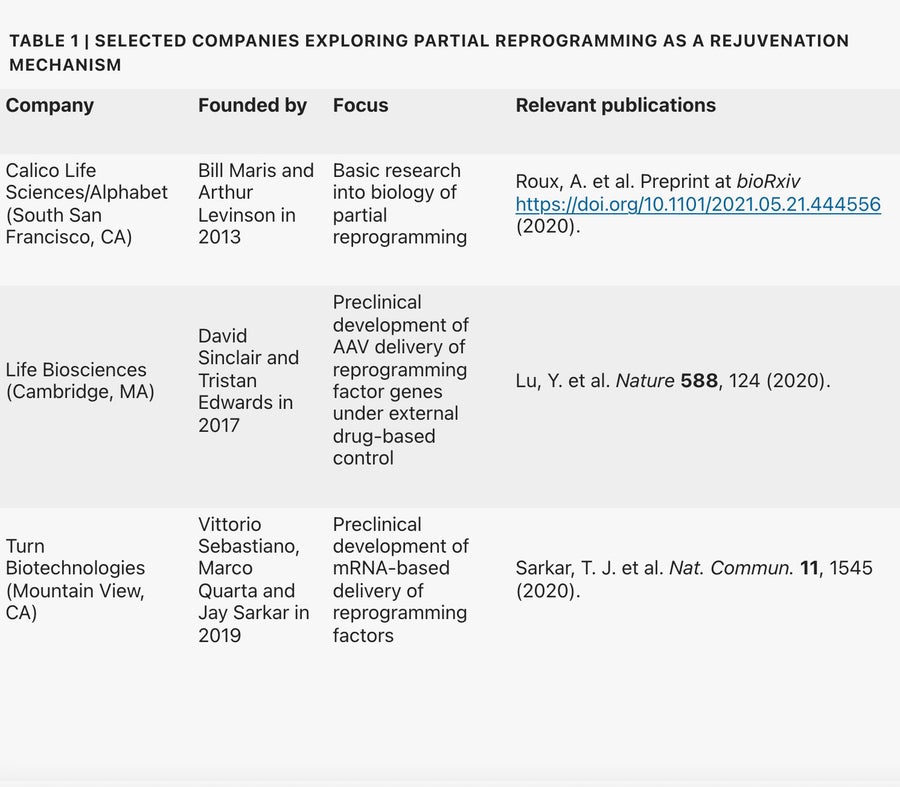
Alphabet子公司Calico Life Sciences位於加利福尼亞州南舊金山的首席研究員雅各布·金梅爾(Jacob Kimmel)解釋說:“我們之所以投資這個領域,是因為它是我們所知的少數幾種可以恢復多種細胞型別年輕功能的干預措施之一。”Life Biosciences的研發主管瓊·曼尼克(Joan Mannick)也對此表示認同,她說,當涉及到治療甚至預防與年齡相關的疾病時,部分重程式設計可能具有“變革性”的潛力。Life Biosciences是由大衛·辛克萊共同創立的初創公司,正在探索三種山中因子(Oct4、Sox2和Klf4)的再生能力。
儘管Life Biosciences和其他幾家初創公司正在研究山中因子,以期逆轉人類衰老,但透過重程式設計實現年輕化的生物學機制在很大程度上仍然神秘莫測。“這些最初的論文提出了一些令人震驚的觀察結果,”哈佛幹細胞研究所的康拉德·霍赫德林格(Konrad Hochedlinger)說。“但還需要更多的研究來深入研究正在發生的分子和機制過程。”鑑於完全重程式設計的iPSC很容易形成稱為畸胎瘤的腫瘤,科學家們必須確定細胞時鐘是否可以在人體內安全地倒轉——這意味著通往臨床的競賽很可能是一場馬拉松,而不是短跑。
山中伸彌的技術甚至可以從百歲捐贈者身上生成生物學上年輕的幹細胞,在過去的15年中得到了廣泛的研究。馬克斯·普朗克分子遺傳學研究所的亞歷山大·邁斯納(Alexander Meissner)說,大多數iPSC重程式設計都歸結為重寫表觀遺傳標記——基因組的化學修飾,例如在DNA或組蛋白蛋白質上新增甲基,組蛋白蛋白質充當DNA的包裝。這個過程影響哪些基因被啟用,哪些基因隨著細胞衰老而傾向於改變。“你抹去了所有看起來像衰老或任何異常特徵的這些標記,並且[細胞]基本上被重置為基線‘完美’表觀基因組,”邁斯納說。
這種重程式設計重新配置了基因表達網路,這些網路可以開啟和關閉基因,從而逆轉與年齡相關的細胞特徵。但一些研究人員假設,部分重程式設計可能使細胞變得更年輕,而無需將細胞完全推回到未分化的胚胎狀態,從而減少腫瘤發生的可能性。
2016年,伊茲皮蘇阿·貝爾蒙特及其同事對早衰症的小鼠模型進行了基因改造——早衰症是一種由突變的層粘連蛋白引起的過早衰老疾病,層粘連蛋白構成細胞支援結構。他們這樣做是為了表達四種山中因子。他的團隊透過用藥物多西環素治療動物來調節這些因子的表達,多西環素已被程式設計為控制基因表達的調節“開關”。這種條件開關被證明至關重要,因為當這些因子持續表達時,小鼠會在幾天內因器官衰竭而死亡。但是,透過在短暫的間隔內啟用這些因子,研究人員能夠延長早衰症小鼠的預期壽命,並在多個器官中恢復年輕的功能。
為了估計組織或細胞的年齡,加州大學洛杉磯分校的史蒂夫·霍瓦特(Steve Horvath)開發了一種“表觀遺傳時鐘”——一種使用來自不同細胞和組織的DNA甲基化來估計生物年齡的方法。2019年,愛丁堡大學的塔米爾·錢德拉(Tamir Chandra)及其團隊表明,部分重程式設計可以在細胞最終失去其身份之前撥回這個時鐘。但錢德拉警告說,“我不相信存在因果關係”,而且這個時鐘可能只是細胞年輕化更廣泛過程的讀數。邁斯納同樣指出,許多這些表觀遺傳變化似乎都位於遠離已知基因或調控元件的地方。
部分重程式設計實驗被證明是有希望的,並促使其他學術團體在不同的衰老動物模型中採用類似的方法。2020年,辛克萊的團隊重置了表觀基因組,使用腺相關病毒(AAV)載體遞送三種山中基因來恢復小鼠的視力——他們排除了c-Myc,因為它具有已知的致癌特性。轉錄因子在視網膜神經節細胞中的表達逆轉了小鼠的視力喪失,促進了老年小鼠視神經損傷或青光眼後的軸突再生。至關重要的是,即使在三種山中基因持續表達的情況下,研究人員也沒有看到細胞身份喪失的跡象。
同樣的情況會發生在人體細胞中嗎?塞巴斯蒂亞諾的團隊表明,基於mRNA的四種山中因子加上兩種輔助因子(LIN28和NANOG)的表達可以提高重程式設計效率,可以逆轉老年人的各種細胞型別(培養的成纖維細胞、內皮細胞和軟骨細胞)的表觀遺傳和炎症特徵,並恢復其再生潛力。“我們現在已經在近20種不同的人體細胞型別中看到了這一點,”塞巴斯蒂亞諾說。
多家公司湧現出來,以這些開創性的研究為基礎進行發展:塞巴斯蒂亞諾共同創立了Turn Biotechnologies,辛克萊創立了Life Biosciences,據報道,伊茲皮蘇阿·貝爾蒙特將加入Altos Labs。Calico的金梅爾以及其他初創公司,包括Shift Bioscience、Retro Biosciences、YouthBio Therapeutics和AgeX(最初是邁克爾·韋斯特(Michael West)的BioTime的子公司),也都在研究部分重程式設計的年輕化潛力。
但是,通往安全有效的人類衰老幹預措施的道路不太可能透過全身遞送山中因子來實現。直接注射的風險太高,因為可能導致細胞回到胚胎的、去分化的狀態,從而誘發惡性腫瘤。“要充分降低這種風險將非常困難,”金梅爾說。
即使是iPSC專家也不清楚重程式設計細胞何時達到“不歸路點”並恢復到完全胚胎樣狀態。在霍赫德林格的經驗中,時間範圍“可能從一週到重程式設計後僅兩三天不等”。金梅爾和Calico的衰老研究副總裁辛西婭·凱尼恩(Cynthia Kenyon)最近發表的一篇未經同行評審的預印本進一步強調了這一過程的不確定性,表明即使是短暫的山中因子啟用也可能導致人體細胞基因表達發生變化,表明細胞身份喪失。這不僅僅是一個學術問題——這種方法的根本安全性取決於答案。事實上,畸胎瘤的形成是評估重程式設計iPSC細胞多能性的常用指標。“一旦單個細胞轉化成iPSC,這個單個細胞就足以形成腫瘤,”霍赫德林格說。
目前尚不清楚在恰當的時間引入最佳的山中因子組合是否可以完全減輕畸胎瘤的風險。曼尼克說,辛克萊研究小組用c-Myc以外的三種山中因子治療的小鼠在治療後近一年半的時間裡一直沒有出現腫瘤。但是,將這項研究轉化為人體應用需要設定更高的標準。“安全是我們目前正在處理的最重要的事情,”塞巴斯蒂亞諾說。
為了最大限度地降低將細胞重程式設計為多能狀態的風險,Life Biosciences最初專注於一種經過充分研究的組織:眼睛。曼尼克說,公司的臨床前研究表明,與其他組織相比,眼睛提供了一個更安全的起點,因為該組織中很少有細胞增殖。
Turn Biotechnologies則專注於皮膚,塞巴斯蒂亞諾認為皮膚在美容適應症以及更嚴重的與年齡相關的問題(如傷口癒合受損)方面具有潛力。他補充說,皮膚的可及性和詳細的瞭解也有助於加速轉化。Turn使用基於脂質奈米顆粒的mRNA遞送來製備塞巴斯蒂亞諾研究小組的六種重程式設計因子混合物:Oct4、Sox2、Klf4、Oct-4、LIN28和NANOG。儘管這些因子無法進行外部調節,但Turn的mRNA的短半衰期應將其活性限制在幾天內。Turn正在探索的另一個選擇是在體外重程式設計細胞,這將使實驗室能夠在將細胞返回患者之前對細胞進行質量控制。
霍赫德林格認為,將c-Myc排除在重程式設計組合之外可能是有利的。但他強調,Life Bioscience的混合物中的另外兩種山中因子,Sox2和Oct4,也與癌症有關。即使是保持其身份的細胞,腫瘤也可能仍然是一種風險。衰老的細胞通常在其一生中獲得許多突變;錢德拉指出,這些突變不會因年輕化而消失,有些突變可能是因為它們賦予了細胞增殖或生存優勢而被選擇出來的。“它們已經在某種程度上朝著癌症邁進了一步,”他說。“那麼,如果它們看到山中因子會發生什麼呢?”
一些公司已經開始將目光投向山中因子之外。Shift Bioscience正在尋找替代方案,利用機器學習來識別有助於逆轉生物衰老但不會導致多能性的基因。“我們基本上認為我們已經看到了細胞重程式設計過程中的年輕化途徑,”艾夫斯說。“這些基因看起來很安全,而且它們似乎不會影響細胞身份。”他補充說,Shift仍在充實這些與年輕化相關的基因網路,然後將著手測試這些基因的不同組合在多種細胞型別中的安全性和有效性。
實際上,山中因子可能作為研究衰老和年輕化的基礎生物學的工具比作為治療手段更有價值。邁斯納說:“我懷疑在任何個體中誘導這些多能性因子是否是一個好主意。”金梅爾同樣認為,當前的重程式設計方法在臨床應用方面受到限制,並補充說,Calico主要從事這項工作是為了探索關於衰老的基本問題。“目前,這並不是我們在臨床上考慮的事情,”他說。
由於有如此多的未解之謎,該領域的公司需要為長期投資做好準備。擁有億萬富翁支援的資金雄厚的公司——如Altos,該公司正在舊金山灣區、聖地亞哥和英國劍橋建立研究所——可能在這方面具有優勢。錢德拉說,已經與該公司簽約的同事“沒有被施加任何壓力去交付任何東西,除了在最初的五到十年裡做好科學研究”。
最重要的是,那些追求年輕化療法的人知道需要管理期望。“這個資訊需要明確——這不是關於延長壽命,”塞巴斯蒂亞諾說。“我們關心的是提高人們的健康壽命……這樣你就不用在虛弱的狀態下活很長時間。”
本文經許可轉載,並於2021年1月19日首次發表。