我熱愛黃石國家公園。我曾到訪遠東的日本,追尋羅馬人的足跡,仰望比薩斜塔,遠距離和近距離地體驗火山,並觸控冰川。然而,我一次又一次地回到黃石公園,凝視瀑布和湖泊,尤其著迷於公園裡許多溫泉、間歇泉、泥漿池和噴氣孔的鮮豔彩虹色。
這些色彩吸引著我。它們是由數百萬個緊密排列的細菌細胞組成的,這些細胞被包裹在粘液基質中。雖然單個細菌肉眼不可見,但在這層粘液中,它們形成了容易看到的群落,被稱為微生物墊或“生物膜”。透過顯微鏡觀察,這些膜顯示出顯著的三維結構,微生物相互粘連,形成多層細絲、蜿蜒的通道和類似微型塔樓的結構。在我看來,它們就像粘液城市,一個脈動的都市,有街區和摩天大樓,街道比東京或紐約的主要大道還要繁忙。你也見過生物膜:它們在你家排水溝裡形成又厚又粘的堆積物,以及浴缸周圍頑固的汙垢圈。
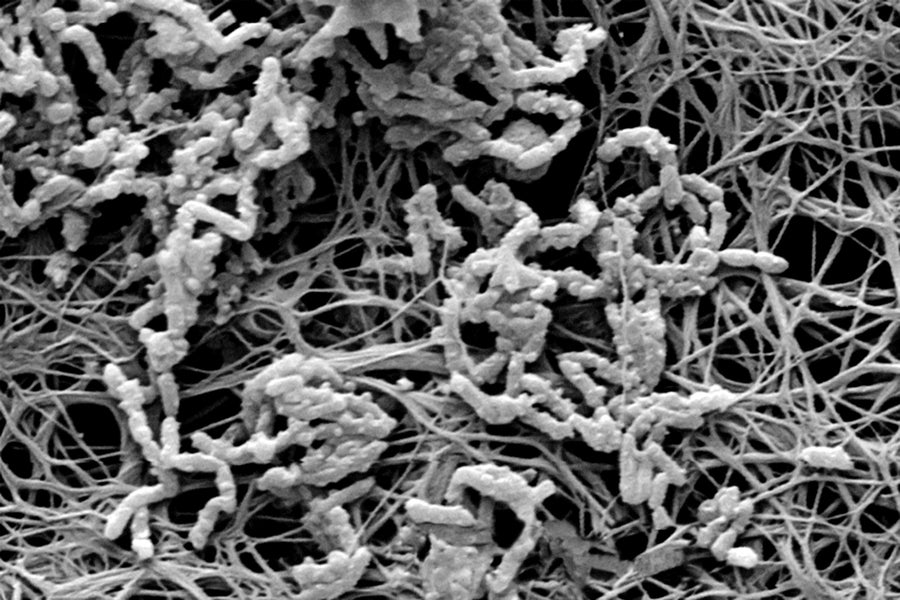
微觀威脅:醫用導管內部覆蓋著細菌生物膜(顯微照片),可能導致血液感染。圖片來源:Getty Images
支援科學新聞報道
如果您喜歡這篇文章,請考慮訂閱以支援我們屢獲殊榮的新聞報道。 訂閱。透過購買訂閱,您將有助於確保未來繼續有關於塑造我們當今世界的發現和想法的具有影響力的報道。
雖然這種堆積物令人討厭,但在醫學上,生物膜對我們的健康構成嚴重威脅。當細菌成功在人體內形成生物膜時,它們會抵抗抗生素,並可能成為手術部位、肺部和泌尿道慢性感染的罪魁禍首。生物膜可以定植於醫療裝置和植入物,如導管、人工關節和心臟瓣膜。總體而言,65%的醫院獲得性感染是由以生物膜形式生長的細菌引起的。僅在美國的醫院,每年就有170萬例此類感染,並有9.9萬例相關死亡,造成的危害巨大。據認為,生物膜每年奪去的生命與癌症一樣多——這確實是一個令人沮喪的統計數字。
為什麼生物膜在醫學上如此棘手?傳統的治療方法旨在治療單個細菌引起的感染,但已被證明在治療許多(如果不是大多數)生物膜感染方面是不夠的。這是因為以生物膜形式生長的細菌不僅具有逃避宿主防禦和免疫反應的極端能力,而且還表現出對抗生素的非凡耐受性。生物膜的這種韌性與細菌獲得耐藥性或變成我們經常聽到的“超級細菌”無關。相反,正是三維結構使生物膜如此頑強且難以消除。在生物膜內部,細菌相互交流、合作和交換物質,不僅組織它們的結構特徵,還製造蛋白質和其他物質來相互支援和保護。
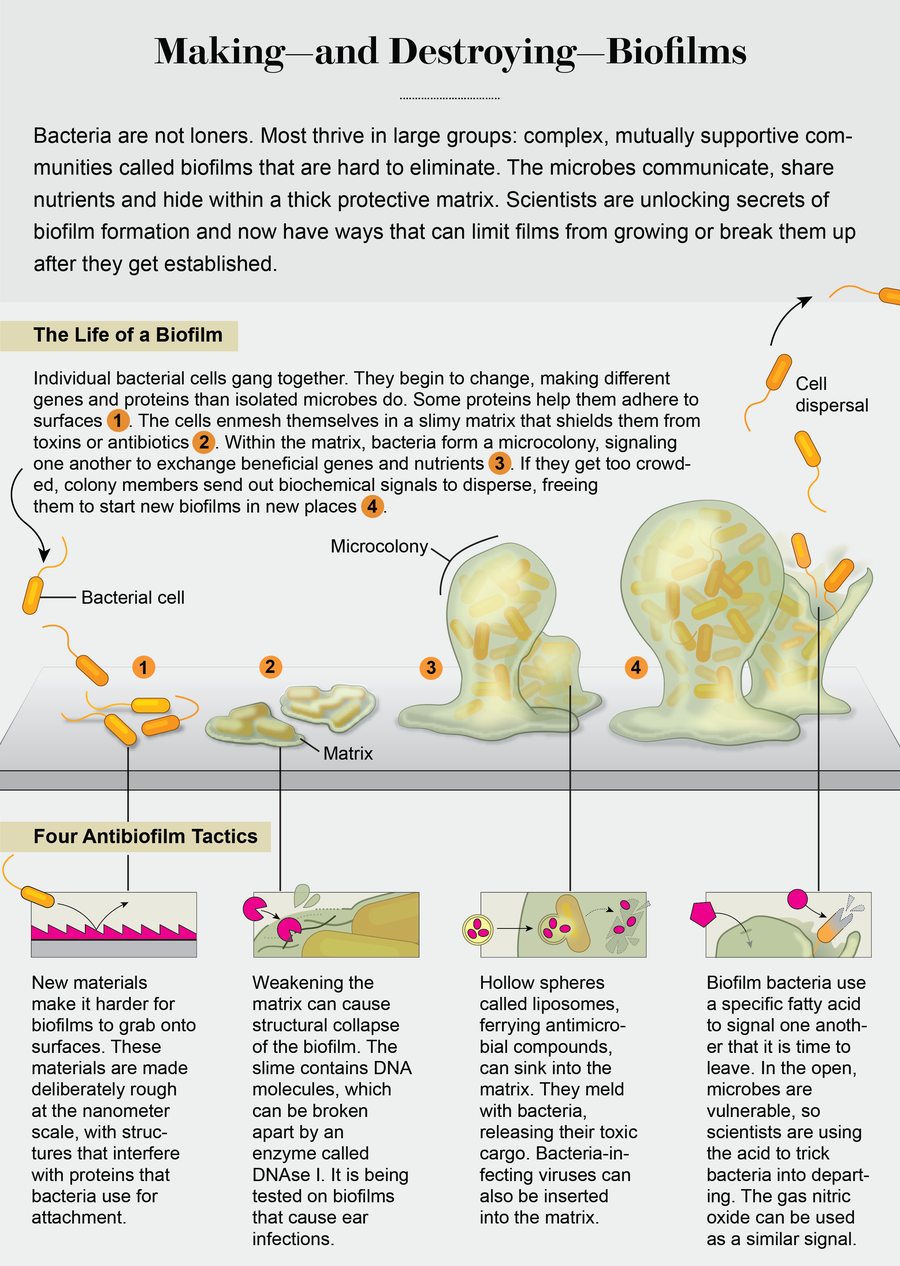
早期有線索表明,生物膜內的細菌與單個細胞變得根本不同。1998年,研究人員喬治·A·奧圖爾和羅伯託·科爾特證明,土壤細菌熒光假單胞菌形成生物膜需要合成新的蛋白質以及24個基因的存在。大多數基因的功能尚不清楚,儘管有些基因編碼用於表面附著的蛋白質,如粘附素。這些神秘基因表明,成為一個附著細胞意味著承擔一種新的細菌生理學。然後,在2002年,我和我的同事證明,細菌不僅在表面接觸時發生變化,而且隨著生物膜從幾個附著細胞發展成三維群落,它們會不斷轉變和適應,在每個階段產生不同的蛋白質組。進一步的研究表明,這些蛋白質能夠按設定的順序實現從一個生物膜階段到下一個階段的轉變。
這些發現表明,生物膜就像城市一樣,一塊磚一塊磚地建造起來,它們的建造遵循總體規劃,一次一個建造階段和一個街區。瞭解生物膜是如何建造的意味著我們已經開始瞭解如何幹預總體規劃。在實驗室中,透過新增抑制或增強其中一些蛋白質的化學物質,我們可以將生物膜阻止在特定的發育階段,甚至可以重塑它們,使它們恢復到早期階段。一些策略正在走向臨床應用。
不健康的附著
首先防止細菌附著是一個好的起點。這項研究的大部分都集中在開發能夠接觸殺死細菌的表面材料或塗層。這可以透過使用表面塗層或浸漬表面來實現,這些表面能夠以高濃度區域性遞送抗菌劑。幾種這樣的表面在醫院中已經很常見,包括浸漬抗生素的縫線和含有浸漬抗生素珠子的骨水泥,以及塗有膠體銀或銀奈米顆粒的導管、傷口敷料和氣管插管。銀離子接觸殺死細菌。殺滅機制尚未完全瞭解,但我們確實知道銀離子會造成氧化損傷(其中氧原子從微生物的重要生物分子中奪走電子),從而導致細菌細胞死亡。除了銀,金屬氧化物和金屬鹽——鐵、汞、碲、鋅、鈦——也在為臨床目的進行測試。
然而,表面塗層和浸漬表面有一個致命弱點,因為塗層中的抗菌物質最終會耗盡。再加上人們對過度使用旨在殺死細菌的藥物和化合物(包括銀)以及隨之而來的細菌耐藥性出現的擔憂,這促使人們開發新的表面材料,以更機械的方式控制附著。這些表面的靈感來自大自然,模仿鯊魚皮的紋理,或荷葉中發現的自清潔紋理,或貽貝用於排斥細菌的化學功能。仿生表面不一定能阻止細菌附著,而是干擾它們用作附著平臺的蛋白質。這個過程透過在微觀層面改變表面粗糙度來起作用。這可以透過新增奈米結構來實現,例如由聚合物製成的刷子、晶體和小管,這些聚合物被水分子吸引,例如聚乙二醇(PEG,靈感來自貽貝),以及被稱為兩性離子聚合物的化合物,這些化合物的靈感來自血細胞的防汙特性。
圖片來源:Jen Christiansen
奈米結構可以以不同的距離排列,以不同程度地減少細菌附著。其中一些仿生表面現在已在臨床上廣泛使用。其他一些仍處於概念驗證階段,仍有製造限制和毒性問題等障礙需要克服。
攻擊基質
儘管抗菌生物膜表面對於醫療植入物來說很有前景,但治療克服了這種抗附著策略並在危險場所(在沒有人造表面的情況下)形成的生物膜(如傷口或肺部中的生物膜)需要非常不同的策略。在這種情況下,包圍生物膜的粘液基質成為目標。這種基質由稱為多糖的長鏈糖分子、蛋白質和DNA組成,以多種方式幫助微生物片層。首先,基質充當保護層。它阻止或限制一些抗生素或被稱為抗體的免疫系統標記物到達生物膜結構內的細菌。此外,基質充當結構框架,將細菌群落粘合在一起並粘附到表面。因此,去除這個框架可能導致結構完整性喪失和隨後的崩潰,因為大的細菌團伙分解成較小的細胞簇或單個細胞。當這種情況發生時,被釋放的細菌細胞再次變得容易受到藥物和免疫系統的攻擊。
靶向結構框架的缺點是生物膜基質的組成,更具體地說,基質中存在的蛋白質和多糖的型別,在不同細菌之間差異很大,每種型別都需要特定的降解酶。因此,旨在降解蛋白質和多糖的治療方法需要根據形成生物膜的細菌型別進行定製。德克薩斯理工大學的肯德拉·倫巴赫和同事最近的發現表明,使用糖苷水解酶可能克服這個障礙,糖苷水解酶靶向多糖中存在的常見的高度保守的糖苷鍵。該團隊證明,糖苷水解酶有效地破壞了金黃色葡萄球菌和銅綠假單胞菌的單培養和共培養生物膜,使崩解的生物膜細胞更容易受到傳統抗菌藥物的影響。動物的後續測試表明,這種療法可能對具有不同基質組成的多種病原體有效。
另一個常見的基質成分可能是DNA,它似乎普遍存在於生物膜中。基質DNA容易被一種酶降解:DNA酶I。幾項臨床試驗正專注於使用這種物質;它正在評估與抗生素聯合用於治療慢性中耳炎(中耳炎)和其他生物膜感染。DNA酶I已用於治療早期肺部疾病的囊性纖維化患者,治療與肺功能顯著改善同時發生。(然而,在這種情況下,酶似乎正在降低痰液的粘性,從而增強肺部清除和抗生素療效,而不是誘導生物膜的崩潰。)
發出撤退的訊號
另一種不同性質的策略是從觀察生物膜的發育方式中獲得的。在細菌形成這些膜後,它們可以透過一個稱為分散的過程來分解它們。當生物膜內部的資源(如營養物質)耗盡,或者當生物膜變得過於擁擠,或者當外部環境變得不穩定時,分散就會發生。分解可以幫助生物膜成員生存並在其他位置產生新的群落。
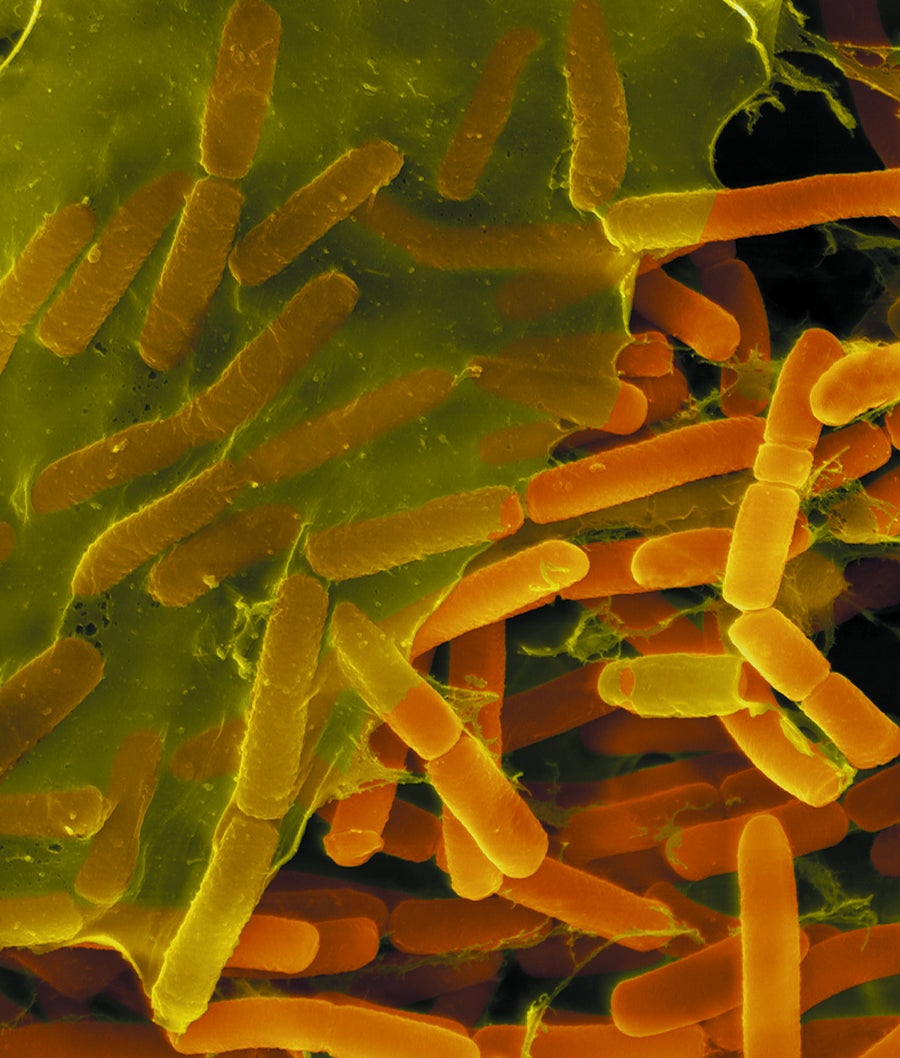
團結一致:芽孢桿菌(顯微照片中的長方形)將自己覆蓋在保護性基質中。圖片來源:Dennis Kinkel Science Source
然而,離開生物膜的單個細胞正是我們擅長用藥物治療的那種未受保護的細菌。那麼,我們如何引導成膜細菌改變其生活方式並逃離生物膜呢?研究人員已經確定了幾種能夠誘導這種轉變的環境生長條件和化合物,包括暴露於重金屬、營養物質和氧氣的可獲得性,以及訊號分子(如一氧化氮和一種名為順式-2-癸烯酸(順式-DA))的存在。雖然這些分散觸發因素非常多樣化,但它們都具有一個共同點,即它們透過降低一種名為環二鳥苷酸的通用細胞內訊號分子的水平來誘導分散。環二鳥苷酸的水平決定了細菌對錶面的粘性,高水平與表面相關的生物膜生長和基質產生有關,而低水平與細菌作為單細胞生長有關。雖然對這些觸發因素的反應而引起的環二鳥苷酸水平的變化與 80% 或更多的生物膜生物量被去除有關,但並非所有分散觸發因素都適合在醫療環境中使用。
一氧化氮這種無色氣體成為一個可行的候選者。我們自身的免疫系統利用一氧化氮來抵禦細菌入侵者,它已經用於醫學上以改善患有各種形式肺動脈高壓(例如,慢性阻塞性肺疾病)的患者的氧合作用。實驗室研究表明,一氧化氮介導了多種細菌的生物膜分散。單獨使用一氧化氮平均可減少 63% 的生物膜。當與粘菌素等抗菌化合物結合使用時,一氧化氮能夠在實驗室實驗中幾乎完全去除生物膜。
儘管如此,儘管結果很有希望,但一氧化氮仍帶來一些臨床挑戰。如果它擴散到身體的不同區域,可能會有毒,因此遞送和限制在特定感染部位非常重要——而對於氣體來說很難做到。為了更好地解決一些擔憂,已經開發了各種製劑和裝置。一個例子是頭孢菌素-3'-二氮烯二醇鹽。這種複方藥物由抗生素(頭孢菌素)和僅在接觸含有稱為β-內醯胺酶的酶的細菌細胞時才啟用的一氧化氮產生物質組成。對青黴素和氨苄西林等抗生素具有抗性的細菌通常具有這種酶。
對銅綠假單胞菌(一種生物膜形成的模式細菌,也是大量醫院獲得性和慢性感染的病因)的研究表明,細菌有自己的方式告訴生物膜群落中的成員分散。這種細菌產生順式-DA,使該生物能夠向其群落成員發出訊號,表明是時候離開了。順式-DA發出分散訊號的能力不僅限於銅綠假單胞菌生物膜。相反,人們發現順式-DA也向由其他細菌以及酵母——而不是銅綠假單胞菌——形成的生物膜發出訊號,使其分解。還有證據表明,其他細菌產生這種脂肪酸的不同版本,這意味著生物膜細菌可能使用特定的“方言”來告訴成員分散。儘管仍處於實驗室測試階段,但在未來治療策略中,將此類訊號和通訊分子與抗生素聯合使用很可能具有代表性。
最近的一項研究進一步表明,丙酮酸(幾種代謝途徑中的關鍵中間體)的可用性可以充當浮游生活方式和生物膜生活方式之間的切換開關——高水平的丙酮酸似乎增強生物膜的形成,而丙酮酸的耗盡會誘導分散。在實驗室實驗中,研究人員使用酶來消耗丙酮酸,導致兩種病原體銅綠假單胞菌和金黃色葡萄球菌分散。此外,當與抗菌化合物結合使用時,這種丙酮酸消耗條件增強了妥布黴素等抗生素殺死生物膜的潛力。當在感染銅綠假單胞菌的燒傷傷口上進行測試時,該聯合策略也被發現對動物研究有效。事實上,人們發現聯合治療在根除燒傷傷口中存在的生物膜方面比更常用的抗菌霜磺胺嘧啶銀更有效。
檢測和感染
對抗生物膜的另一種策略是引起對其細菌成分的致命感染。像人一樣,細菌也容易受到病毒的感染,在這些微生物的情況下,病毒被稱為噬菌體。然而,雖然人不受噬菌體的影響,但細菌要麼被永久感染,要麼被殺死。自1996年早期研究噬菌體與生物膜相互作用以來,研究旨在鑑定能夠殺死生物膜內細菌的噬菌體。此外,進入但不殺死細菌細胞的噬菌體仍然可以用作貨運卡車,將抗生素或基質降解劑(如DNA酶I)遞送到生物膜內的每個細菌。噬菌體療法目前在美國境外用於治療囊性纖維化患者的生物膜來源的肺部感染。
但與其他策略一樣,這種療法也帶來自身的一系列問題。由於噬菌體以高特異性感染和殺死細菌,特定的噬菌體僅感染特定型別的細菌,這意味著它們不能用作廣譜殺傷劑。而且,細菌可能對噬菌體攻擊產生耐藥性,就像它們對抗生素產生耐藥性一樣。
為了克服潛在的耐藥性,研究人員開發了脂質體,或脂質包裹的囊泡,作為替代的貨物載體。由於其尺寸小,被稱為奈米顆粒,這些微型運輸器背後的想法是將殺死生物膜細胞或破壞生物膜穩定性的化合物(如抗生素、抗菌化合物或基質降解酶)直接遞送到它們需要的地方,進入生物膜或細菌本身。靶向機制基於脂質體中模仿細菌細胞膜上脂質的脂質。這種相似性使它們能夠擴散到基質中。這就是該系統的優點所在。匹配的脂質使脂質體能夠與細菌融合,從而使運輸系統能夠以類似於注射的方式將其貨物直接傾倒入微生物中。這種策略的一個優點是靶向方法,因為抗菌和抗生物膜化合物僅遞送到生物膜,而不遞送到其他任何地方。脂質體已經是一種非常廣泛使用的抗菌藥物遞送系統。
制勝組合
這裡描述的策略僅僅觸及了全球實驗室中正在測試的大量策略的表面,其中一些策略處於早期開發階段,另一些策略處於臨床前階段。但這些努力不僅表明了生物膜控制的重要性,也表明了真正控制粘液是多麼具有挑戰性,主要是因為並非所有生物膜都是相同的。每個細菌物種以略有不同的方式製造和逃離生物膜,使用通訊分子的變體,產生不同的蛋白質等等。然而,正如這些方法所表明的那樣,我們越來越接近可以幫助人們的治療方法,儘管這種治療方法可能需要利用抗生物膜策略的組合來摧毀威脅我們生命的細菌城市。

