米歇爾·博耶額外獲得了六年的生命。凱倫·科勒經歷了六年幾乎無症狀的生活,她以為自己已經戰勝了疾病。道格·奧爾森在自認為無藥可救的十年多後,被正式宣佈“治癒”。在過去的十年裡,數千人體驗到了透過操縱免疫系統來治療癌症的方法所帶來的希望和挑戰,這些人就是其中的三個例子。免疫療法不是從外部攻擊癌症——切除腫瘤或用有毒化學物質或放射線灌注身體——而是啟用其防禦網絡的複雜且高度互動的細胞和分子訊號,從而從內部完成這項工作。
與那些較老的方法一樣,免疫療法已成為血液癌症(如奧爾森和科勒的癌症)和黑色素瘤(如博耶的癌症)以及膀胱癌、乳腺癌和肺癌(後者是美國最大的癌症殺手,2021年導致超過13萬人死亡)等癌症治療的支柱之一。
這種轉變是巨大的,從十年前剛進入腫瘤學家的視野,到五六年前開始流行。“癌症研究和臨床腫瘤實踐的重心都發生了180度的轉變,”加州基因泰克公司癌症免疫學副總裁艾拉·梅爾曼說。免疫療法“已成為肺癌的標準療法,而不久前肺癌還只能透過手術或化療,或兩者兼施來治療。”到目前為止,結果令人鼓舞,但遠非普遍適用,而且進展並沒有“我們許多人預期的或希望的那麼快,”西雅圖弗雷德·哈欽森癌症研究中心的免疫療法研究員斯坦利·裡德爾說。“治癒癌症並不容易。”現在,數以萬計的患者接受了這種治療,在某些情況下,治療創造了近乎奇蹟的效果,而在另一些情況下,希望破滅。
支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道: 訂閱。透過購買訂閱,您正在幫助確保有關塑造我們當今世界的發現和想法的具有影響力的故事的未來。
醫生們仍然處於理解免疫療法將幫助哪些患者以及哪些患者不會被幫助的早期階段。起作用的因素似乎包括有多少T細胞已經進入腫瘤微環境,免疫系統識別癌細胞有多困難,甚至包括患者的腸道微生物組成,裡德爾說。美國前總統吉米·卡特在2015年8月宣佈他的黑色素瘤(最致命的皮膚癌)已擴散到肝臟和大腦時,已經快91歲了。新聞媒體準備好了訃告。但卡特接受了放射治療,然後接受了一種免疫療法藥物,這種藥物可以解除癌症對免疫系統的抑制,稱為檢查點抑制劑。到當年12月,他體內所有腫瘤的證據都消失了,此後他慶祝了97歲生日。他很可能看到了如此驚人的益處,因為他的癌症是由多年的陽光照射引起的,這引發了各種各樣的突變。突變和放射損傷使他的癌細胞更容易被他的免疫系統識別,一旦免疫療法解除了抑制。
博耶是西雅圖居民,20多歲時被診斷出患有晚期黑色素瘤,因此她的癌症可能是較少突變的產物。2013年,她開始接受一系列革命性的治療——其中一些治療在2011年首次問世——這些治療促使她的免疫系統識別、攻擊和縮小腫瘤。但即使釋放了免疫系統,也不足以引發全面的攻擊,她於2019年去世,享年32歲。
除了個體癌症的突變負荷外,醫生們對誰將在這些藥物上表現良好或不良知之甚少。多年來,他們一直在尋找可以預測的分子標記物,但他們沒有取得多大成功。在繼續尋找的同時,研究人員正在測試藥物組合和其他方法,例如疫苗接種,以將益處擴充套件到更多患者。之所以需要這樣的組合,既是因為癌症很複雜,是各種基因突變的產物,也是因為正如免疫學家所瞭解的那樣,免疫系統具有多層防禦和攻擊。“你需要真正結合、協同不同的作用模式,”癌症免疫療法先驅厄茲勒姆·圖雷奇說,她與人共同創立了BioNTech,該公司現在因與輝瑞合作開發新冠疫苗而聞名。“具有非冗餘、部分重疊作用模式的不同任務部隊被結合在一起。這就是免疫系統自然進化的方式。”
液體的成功
利用免疫系統對抗癌症的夢想至少可以追溯到125年前的紐約市的威廉·科利,這位醫生將一些細菌注射到他的癌症患者體內,試圖啟動他們身體的自然癒合能力。科利的方法被其他一些醫生採用。但在他1936年去世後,這種方法逐漸失寵,被化療的進步以及後來的激素和抗體療法所取代,後者在更多患者身上顯示出更一致的效果。
然而,增強免疫系統的想法從未完全失去吸引力,部分原因是紐約市的癌症研究所推動了這一想法,該研究所是科利的女兒於1953年創立的慈善機構。圖雷奇說,這個領域在幾十年裡一直沒有受到重視,但在最近幾年,隨著艾滋病毒研究加深了對免疫系統的理解,遺傳學使人們能夠更深入地瞭解腫瘤,癌症研究人員已經用強大的免疫武器充實了他們的武器庫。
這些武器中最具吸引力的目標是迴圈系統和淋巴系統的癌症,如白血病和淋巴瘤。這些疾病發生在各種祖細胞(稱為幹細胞)身上,這些幹細胞通常會產生紅細胞和白細胞(以及其他組織),當它們發生突變並失控生長時,會擠佔健康細胞並剝奪身體的重要功能。許多所謂的液體腫瘤是在稱為B細胞的免疫系統的一部分出現問題時形成的。正常情況下,B細胞產生對抗細菌和病毒的抗體。(B細胞還與其他一組細胞T細胞一起,幫助協調各種其他免疫反應。)但是,當B細胞癌變時,它們會從內部摧毀身體。
在20世紀後期,研究人員開發出一種生物等效的制導導彈,它可以附著在B細胞蛋白(CD20)上,這種蛋白存在於細胞表面的特定晚期階段。這種單克隆抗體被稱為利妥昔單抗,它向T細胞發出訊號,讓它們做一些它們通常不做的事情:攻擊和摧毀這些較老的、攜帶CD20的B細胞。然而,CD20不是癌症特異性標記物,它也出現在正常B細胞以及危險的B細胞上,因此該藥物既殺死了健康的B細胞,也殺死了癌變的B細胞。然而,事實證明,大多數人可以在沒有B細胞的情況下生存。(對於T細胞來說並非如此,數百萬感染了靶向T細胞的艾滋病毒的人的死亡悲劇性地證明了這一點。)並且在藥物失效後,大多數患者最終又開始從骨髓中的幹細胞儲備中自行產生B細胞。20世紀90年代的臨床試驗表明,化療和利妥昔單抗的組合對基於B細胞的癌症特別有效。
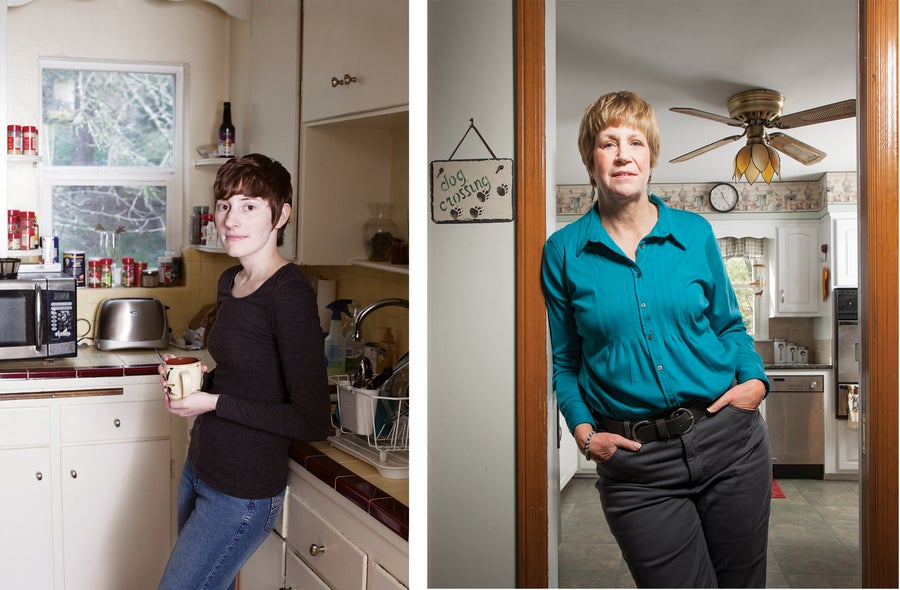
米歇爾·博耶(左圖)在2013年得知自己患有晚期皮膚癌。六個療程的免疫療法讓她多活了六年,直到2019年去世,享年32歲。凱倫·科勒(右圖)在接受了自體免疫細胞輸注後,無癌六年,這些免疫細胞經過基因工程改造,可以根除她的白血病。(照片拍攝於2016年。)圖片來源:安妮·瑪麗·穆塞爾曼(左圖),艾米·埃克特(右圖)
對於來自新澤西州帕克裡奇的退休特殊教育教師科勒來說,白血病起源於突變的B細胞,但利妥昔單抗使她病情非常嚴重,而且似乎只有部分有效,因此她停止服用。此外,測試表明她的癌症會對標準化療產生抵抗力。由於她的惡性腫瘤迅速惡化,她的醫生建議採用當時仍在實驗中的免疫治療,該治療是為對抗她的白血病型別而專門設計的。她同意了。目標是像利妥昔單抗那樣摧毀科勒的所有B細胞,但有兩個關鍵區別。B細胞上的不同蛋白質CD19是標記物。醫生們沒有使用藥物在蛋白質上塗上靶點,吸引科勒體內已經存在的殺傷性T細胞,而是採取了更直接的方法。他們取出了一些她的T細胞,並對其進行基因工程改造,使其無需任何提示即可攻擊CD19。
研究人員將這些增強型細胞稱為嵌合抗原受體T細胞,或CAR-T細胞。它們表現出一些T細胞和B細胞的特徵,這與古代神話生物喀邁拉被認為是不同動物組成的非常相似。美國食品和藥物管理局迄今已批准了一些CAR-T細胞,它們針對CD19或其他細胞表面標記物。以前,CAR-T細胞主要在其他療法失敗後作為最後的手段使用,但現在它們正在疾病早期階段被推廣,此時患者——以及他們的免疫系統——可能更健康,反應更靈敏。裡德爾說,他對透過更早地治療患者,或許透過使用旨在同時靶向CD19和CD20以及其他抗原的CAR-T細胞組合來取得改進持樂觀態度。他指出,在最近針對複發性淋巴瘤患者的三項試驗中,接受CAR-T細胞治療的患者比目前的標準護理骨髓移植患者表現更好。
奧爾森也在CAR-T細胞療法獲批之前很久就自願參加了一項CAR-T細胞試驗。作為2010年在賓夕法尼亞大學報名參加實驗療法的前三名患者之一,他認為這是他戰勝他已經患病14年的慢性淋巴細胞白血病的最後機會。在輸注幾周後,他最終因流感樣症狀住院,這是該療法的三大主要副作用之一。如此多的癌細胞迅速死亡,以至於它們的清除損害了他的腎臟。三天後,他的病情穩定下來,他的腫瘤學家大衛·波特給他帶來了一個好訊息:他骨髓中已經有19%的T細胞是由靶向CD19的CAR-T細胞組成的。在輸注一個月後,它們佔他T細胞的100%,並且完全沒有癌症跡象殘留。
奧爾森說,他再也沒有受到該療法的副作用困擾,儘管他的CAR-T細胞一直在殺死他健康的B細胞,因此他需要每月輸注IVIG(靜脈注射免疫球蛋白),這是一種有助於抵抗疾病的抗體。在2022年2月發表在《自然醫學》雜誌上的一項研究中,賓夕法尼亞大學的研究人員表明,他的一些T細胞以及另一位在同一時間接受治療的患者(此後死於新冠肺炎)的T細胞,在近十年後仍然帶有CAR-T細胞的特徵,並且能夠在實驗室培養皿中殺死白血病細胞。奧爾森體內殘留的CAR-T細胞已經從殺傷性T細胞轉變為更像哨兵的CD4+ T細胞。這表明像奧爾森這樣的患者對CAR-T細胞的反應有兩個不同的階段:一個階段是殺傷性T細胞攻擊腫瘤細胞,第二個階段是這些CD4+ T細胞透過巡邏尋找任何殘留的癌症來維持長期緩解。
這種演變可能不會發生在每個人身上。也許這就是為什麼科勒的緩解並沒有導致她被治癒。到2016年,在單次輸注源自她自身、經過改造的細胞的CAR-T細胞一年多後,當時59歲的科勒確信自己中了免疫療法的頭彩。在她接受治療的一個月內,掃描顯示她體內沒有癌症跡象。但她已經遭受了CAR-T細胞可能產生的另一種嚴重副作用。在她接受重新設計的細胞的當晚,一場所謂的細胞因子風暴讓她住進了重症監護室。當比平時多得多的T細胞一次性被啟用時,就會發生這種反應,從而引發免疫系統用來交流的大量化學訊號(稱為細胞因子)。結果可能是危及生命的活動狂潮,其中免疫細胞破壞健康組織,導致多器官衰竭。裡德爾將其比作體內炎症的爆發。科勒在重症監護室住了八天,其中一半時間她處於昏迷狀態,完全沒有反應。她對那段時間沒有任何記憶,但在某個時候,狂熱的高爾夫球手科勒是如此的語無倫次,以至於她要求護士幫忙為兩位著名的高爾夫球手準備午餐。
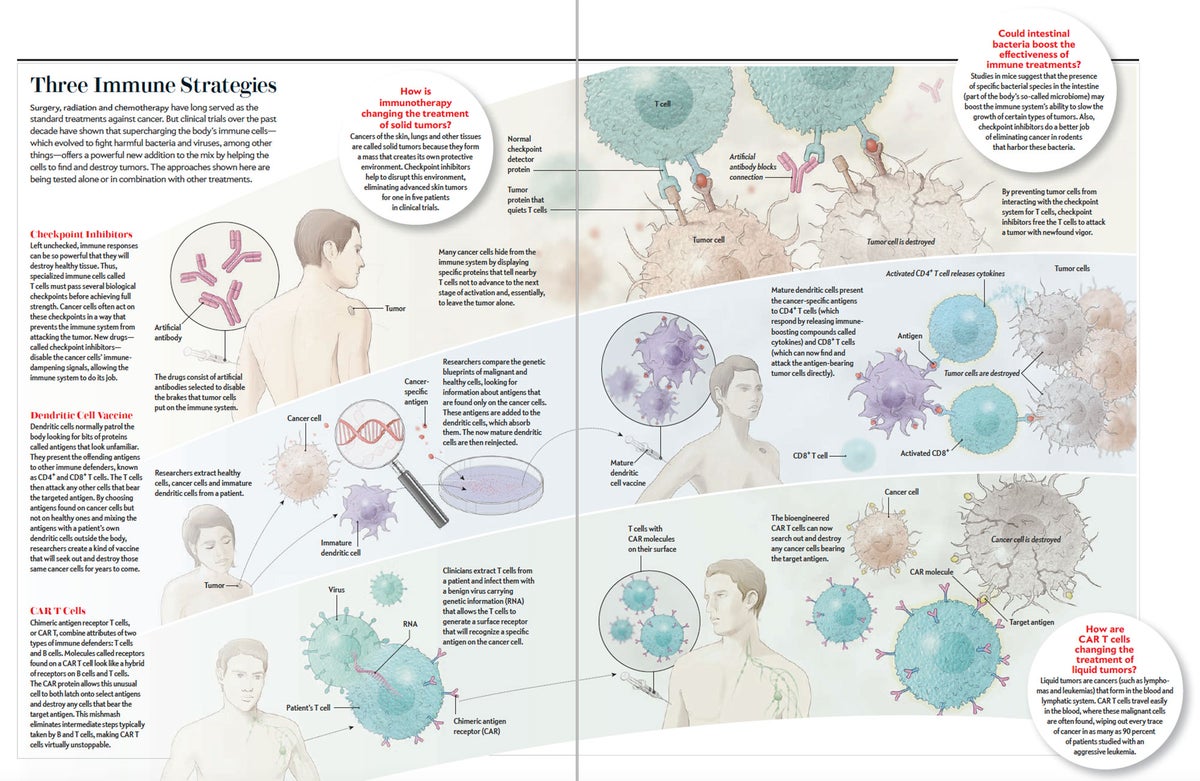
圖片來源:Shizuka N. Aoki
到2015年3月初她出院時,科勒非常虛弱,但正在迅速恢復。骨髓測試顯示沒有癌症的證據,三週後她又回到了高爾夫球場。科勒是最早忍受這種戲劇性的、危及生命的細胞因子風暴的臨床試驗志願者之一。她說,她也是她的醫生最後一位最終進入重症監護室的患者。今天,作為一名志願者,科勒在為即將接受CAR-T細胞治療的患者提供諮詢時,她告訴他們,他們將住在醫院對面的一間公寓裡,可能需要住院幾天。但“沒有人真的會生病,”她說。“沒有人會像她在妄想期間那樣,認為自己身處懷俄明州。”
CAR-T細胞的另一個挑戰是其驚人的價格標籤。這種療法的常規費用為37.5萬美元至47.5萬美元。賓夕法尼亞大學的卡爾·瓊在宣佈2022年2月《自然醫學》雜誌上奧爾森參與的研究時表示,成本很高,但比試圖用其他效果較差的療法維持一個人的生命要便宜。降低成本的工作也在進行中。到目前為止,CAR-T細胞主要在學術醫療中心的小型研究實驗室製造後給予。但140家生物技術公司和每家大型製藥公司都對這種療法的成功印象深刻,已經開始參與其中,並應很快根據改進的製造技術和市場競爭,以更低的成本大規模生產這些細胞,紐約市紀念斯隆-凱特琳癌症中心細胞工程中心主任米歇爾·薩德蘭說。
奧爾森的結果表明,只有少數細胞克隆——在他的案例中,只有三個克隆佔多數——是持久的。薩德蘭說,如果研究人員能夠弄清楚這些稀有細胞的特殊之處,並只提供這些細胞,而不是數百萬其他細胞,那麼治療成本將大幅下降。研究人員還在嘗試開發不太個性化、更現成的細胞治療方法,但仍然有效,這可能會大大降低成本。
CAR-T細胞治療面臨的另一個主要挑戰是將液體癌症的成功經驗轉化為實體腫瘤——即在乳房、前列腺、肺、皮膚和其他組織中形成腫塊的那種腫瘤。梅爾曼解釋說,CAR-T細胞可能很難離開血液去尋找實體腫瘤。在血液中,液體腫瘤細胞相對容易被CAR-T細胞定位。更重要的是,液體癌症的CAR-T細胞可以特異性和安全地靶向受影響的細胞譜系。實體腫瘤中沒有可比的細胞譜系;它們不表達正常組織也表達的表面分子。但梅爾曼看到了這種免疫系統操縱的巨大長期潛力。“與我認為當你可以將細胞工程的全部力量用於解決問題時可能實現的目標相比,我們現在看到的CAR-T細胞仍然是初步的,幾乎是粗糙的方法,”他說。
固態
實體腫瘤對免疫治療提出了其他困難。它們通常被結締組織和其他組織的基質包圍,這阻礙了細胞進入惡性腫塊。此外,實體腫瘤的內部壓力通常高於周圍環境的壓力,這往往會沖走免疫系統用來標記異常細胞的化學訊號——更不用說許多藥物了。
然而,這些腫瘤已經顯示出一定的脆弱性。2011年,FDA批准了一種名為伊匹單抗的單克隆抗體來治療晚期黑色素瘤。與傳統療法不同,伊匹單抗並非旨在直接殺死腫瘤;相反,它釋放了某些癌症能夠抑制免疫系統的生物制動器,從而解放身體的防禦能力,使其更好地發揮作用。(卡特接受了第二代檢查點抑制劑帕博利珠單抗的治療。)
黑色素瘤有一種欺騙免疫系統細胞的惡習。癌細胞團塊的表面有各種各樣的畸形蛋白質,T細胞應該發現這些蛋白質,蜂擁而至並摧毀它們,以防止異常生長有機會變得更大。但每隔一段時間,一個新生腫瘤就會發展出一種方法來發出化學訊號,告訴T細胞一切安好並停止行動。
實際上,癌細胞劫持了免疫系統的正常功能:一種安全機制,可以在身體的橫衝直撞的防禦細胞開始破壞健康組織之前將其抑制住。更具體地說,這種安全機制由一系列檢查點或關卡組成,這些檢查點或關卡根據存在的化學訊號,要麼集結防禦細胞進行攻擊,要麼關閉它們。(如果檢查點卡在“開啟”位置,那麼隨之而來的免疫反應可能會比任何惡性生長更快地殺死一個人。)
癌細胞有變通方法,使它們能夠透過停用可能殺死它們的T細胞來躲避免疫系統。用伊匹單抗或其他檢查點抑制劑阻斷這種虛假訊號會重新喚醒免疫細胞,使它們能夠再次鎖定目標。伊匹單抗很快被證明對肺癌以及黑色素瘤有效,製藥公司開始開發其他使用相同策略的藥物。
2015年《新英格蘭醫學雜誌》上的一項研究表明,與僅使用一種檢查點抑制劑相比,使用兩種檢查點抑制劑的黑色素瘤患者效果更好。儘管如此,醫生們仍然不擅長預測誰會對哪種檢查點抑制劑或治療組合產生反應,因此一些患者不得不不斷嘗試不同的療法。今天,大約一半接受聯合檢查點抑制劑治療的人在治療後至少存活了六年。更令人困惑的是,一些似乎沒有吸引到多少T細胞的腫瘤仍然對檢查點抑制劑有反應,而這些藥物有時對含有大量T細胞的其他腫瘤無效——這表明癌症正在玩其他花招。
正如博耶的經歷所表明的那樣,這使得為特定個體選擇有效的實體腫瘤治療成為一種反覆試驗的過程。在切除背部癌變的痣兩年後,博耶得知黑色素瘤復發並擴散到她的肺部和胸部。由於腫塊太大無法切除,博耶聽從了醫生的建議,同意在2013年初參加一項臨床試驗,她將在其中注射高劑量的白細胞介素-2 (IL-2),這是一種有助於增強免疫系統對抗癌症能力的數十種不同化學訊號之一。起初,這種藥物似乎阻止了博耶腫瘤的生長,但在三個月後,掃描顯示癌症再次轉移。
博耶選擇了第二次臨床試驗,這次是將最近批准的檢查點抑制劑伊匹單抗與另一種免疫訊號分子IL-21配對。然而,在幾周內,IL-21治療的副作用(噁心、腹瀉和難以忍受的疼痛)變得非常嚴重,以至於博耶不得不停止注射,儘管她繼續接受伊匹單抗治療。到2013年底,一些癌變部位開始擴大,因此她的醫療團隊選擇放射治療以試圖限制生長。到第二年春天,其中一些腫瘤變小了,但新的腫瘤出現在她的頭部和乳房中。
手術切除了她乳房中的腫塊,另外兩種增強免疫力的療法似乎在一段時間內控制住了她其餘的腫瘤。然而,到2015年1月,很明顯她需要另一個行動計劃——新的病灶開始在她的腦部、乳房和腹部生長。一個月後,她參加了一項臨床試驗,該試驗將另一種檢查點抑制劑與一種旨在減緩腫瘤生長的藥物結合使用。博耶的癌變部位在一段時間內保持穩定,但最終惡化。
這些治療摧殘了博耶的身體。到2016年末,她晚上和白天的大部分時間都在豪華的沙發椅上休息背部。在她第六輪治療期間,她能夠每天上午在結構工程師的崗位上工作。否則,她就透過玩影片遊戲來消遣——《使命召喚》是她最喜歡的。她並不後悔她的醫生正在用她的癌症玩打地鼠遊戲。“在我看來,這些療法中的一些療法可能稍微減緩了生長速度,”她在2016年說。博耶記得她的一位醫生“說黑色素瘤遊戲的一部分不一定是現在找到正確的治療方法,而是讓自己活得足夠長,直到他們找到正確的治療方法。”
不幸的是,對於博耶來說,他們沒有找到。她的2019年6月13日的訃告指出,她參加了臨床試驗,“希望能為未來的患者找到治療方法。”她非常感謝她在西雅圖癌症護理聯盟和華盛頓大學醫療中心接受的傑出醫療護理,並且她“希望人們知道她對自己的死亡感到平靜。”
展望未來
免疫療法可能為博耶爭取了更多時間。這對癌症研究人員來說是有希望的,即使結局並不像童話故事那樣完美。研究人員不再需要擔心他們的研究最終是否會幫助某人;現在他們可以花時間使有效的治療方法變得更好。“我們需要找到邊界和侷限性”,並弄清楚如何與免疫系統合作,從而更有效地對抗更廣泛的癌症型別,梅爾曼說,但“這是一種非常鼓舞人心和激動人心的方式來做科學。”
梅爾曼認為,最終,基於患者腫瘤的特徵性免疫學特徵,選擇免疫治療的過程將變得更加合乎邏輯。患有實體腫瘤的患者將首先進行活檢,以檢查是否存在T細胞。如果腫瘤中有足夠的T細胞,這個人很可能會接受單一檢查點抑制劑或幾種抑制劑。(目前,FDA已批准八種檢查點抑制劑,還有更多正在開發中。)如果腫瘤尚未吸引許多T細胞,或者T細胞無法進入腫瘤,科學家將不得不尋找其他方法來產生、吸引或促進腫瘤特異性T細胞的進入。
研究人員還在考慮如何使用標準癌症護理,包括放射治療、靶向藥物(如突變型K-Ras抑制劑)和化療,以增強免疫反應。用較低劑量的化療或放射治療殺死大量腫瘤細胞應該會釋放大量來自腫瘤的細胞碎片,從而提醒免疫系統向任何殘留的異常生長髮送T細胞。(正確地掌握平衡可能很棘手,因為過多的化療和放射治療也已被證明會抑制免疫系統的某些部分。)然後,新增檢查點抑制劑可能能夠有效地對抗虛弱的癌症,使其沒有機會恢復。
其他組合方法可能很快包括癌症疫苗。圖雷奇的BioNTech等公司一直在研究實驗性疫苗,這些疫苗有一天將能夠刺激免疫系統攻擊癌症。到目前為止,BioNTech在治療接受過手術但復發風險高的結腸癌患者以及旨在攻擊個體黑色素瘤的個性化疫苗方面取得了最佳進展。圖雷奇說,疫苗可以觸發身體產生更大的T細胞軍隊,然後檢查點抑制劑使這些T細胞能夠在體內自由漫遊並攻擊殘留的腫瘤細胞。
圖雷奇說,新增疫苗也可能幫助那些對檢查點抑制劑有一定反應(如博耶)但沒有長期獲益的患者。信使RNA(mRNA)是BioNTech強大的新冠疫苗中使用的相同載體,是免疫療法的天然工具,她補充說。它透過觸發比早期癌症疫苗(被證明太弱)更強的免疫反應來放大抗原的作用。它也適用於個性化疫苗,因為可以輕鬆地將一種mRNA換成另一種。“疫苗現在進入了一個新時代,”她說。
其他研究人員正在操縱T細胞受體(TCR)以鼓勵它們攻擊癌細胞,或者使用腫瘤浸潤淋巴細胞(TIL),這些淋巴細胞從體內取出,在實驗室中擴增數量,然後重新輸注。美國國立衛生研究院的史蒂文·羅森伯格已經表明,大約15%到20%的患者從TIL獲得顯著反應,到目前為止,治療後存活期長達15年。“問題是,我們如何使這個比例更大?”裡德爾問道。
研究人員正在更多地瞭解T細胞衰竭,這是一種免疫戰士似乎只是放棄戰鬥的狀態。單細胞測序正在以前所未有的精細程度提供見解。裡德爾說,基因編輯使科學家能夠將這些新知識投入到實際應用中。因此,新的進展勢必會到來。正如他指出的那樣,化療最佳化花了50年時間,而檢查點阻斷和CAR-T細胞療法才出現十年。“免疫系統根除癌症的潛力確實非常顯著,”裡德爾說。如果癌症是一座山脈,“我們已經攀登了第一座高峰,但還有更多高峰。”
當然,所有這些新的療法和組合療法都將是昂貴的。據醫療保健資料公司 IQVIA 稱,到 2025 年,全球腫瘤藥物市場預計將超過每年 2500 億美元。保險公司和公眾不願意也無法無限期地組合那些可能使每位患者花費數十萬美元或更多的藥物。因此,各公司正在研究生產改進、降低劑量和縮短治療時間等方法,以降低治療成本。但是,更多治癒所能提供的價值是無可辯駁的。
現年 65 歲的科勒從她的基因工程 T 細胞中獲得了六年美好的時光。除了靜脈注射免疫球蛋白和定期檢查外,她能夠過上正常的生活。“我感覺棒極了,”她說。而且它持續了這麼長時間,以至於她“有點自負”,認為她的癌症日子已經結束了。但 2021 年底的掃描顯示,她的白血病又捲土重來。截至撰寫本文時,她仍在等待她的醫生完成血液分析並推薦下一步的治療方案。
她說:“如果我們能再次進行 CAR T 療法,我現在就開車去醫院。”醫生仍然保留著她的細胞,但 CAR T 療法尚未獲準二次使用,而且目前尚不清楚她目前的癌細胞表面是否具有相同的 CD19 受體。科勒最終可能會服用一種名為伊布替尼的藥物,這是一種常用於治療慢性淋巴細胞白血病的免疫療法——但她必須終生服用。她告訴她的醫生,她寧願再接受一輪 CAR T 療法:“我不想維持治療。我想讓你再次擊退它。”癌症醫生希望免疫療法很快就能讓他們為更多患者延長高質量的生命。