在她一歲生日時,艾瑪·拉爾森還不會走路或站立,但很多其他同齡的孩子也不會。她喜歡父母在她位於紐約長島的家中安裝的搖椅,並且充滿活力地爬行。然後在 13 個月大時,艾瑪的腿停止了工作。她的母親黛安·拉爾森打了個響指說:“就像那樣。”艾瑪停止了彈跳。當她把自己拉起來站立時,她的腿彎曲了。她爬行的變化比較微妙,但是當她的父母看了一段舊影片時,差異很明顯——艾瑪現在覆蓋的地面更少,並且難以抬起頭。
經過一連串的測試,2014 年 7 月,拉爾森一家得知艾瑪患有脊髓性肌萎縮症 (SMA),這是一種可能致命的神經退行性疾病,主要侵襲兒童,剝奪他們行走、說話的能力,最壞的情況下,還會剝奪呼吸的能力。她的運動神經元正在死亡,原因是體內嚴重缺乏一種名為 SMN(運動神經元存活)的蛋白質。“你會經歷最黑暗的時期,”黛安說。但是這個家庭決心“奮力反擊”,艾瑪的父親馬特·拉爾森說。“我們願意做幾乎任何事情來對抗這種可怕的疾病。”
在離拉爾森家不遠的冷泉港實驗室,生物化學家和分子遺傳學家阿德里安·克雷納也在進行同樣的鬥爭。自 2000 年以來,他一直在研究 SMA 的遺傳基礎,並且知道問題在於缺失或突變的關鍵基因 SMN1。但他也明白,人們攜帶該基因的一種非活性且可能可挽救的類似物 SMN2。到 2004 年,他與 Ionis Pharmaceuticals 的弗蘭克·貝內特聯手,試圖開發一種能夠改變 SMA 患者體內 SMN2 的藥物,使其最終能夠產生功能性 SMN 蛋白,目的是改善疾病的進展。為此,研究人員轉向了一種叫做反義寡核苷酸的東西。
支援科學新聞報道
如果您喜歡這篇文章,請考慮透過以下方式支援我們屢獲殊榮的新聞報道: 訂閱。透過購買訂閱,您將幫助確保有關塑造我們當今世界的發現和想法的具有影響力的故事的未來。
反義寡核苷酸 (ASO) 的概念最早在 40 多年前提出,它是化學修飾的 DNA 或 RNA 短鏈(希臘語中 oligo 的意思是“少”,核苷酸是構成 DNA 和 RNA 的結構單元)。 ASO 旨在靶向問題基因產生的 RNA 鏈並改變基因的表達。也就是說,ASO 與靶向 RNA 的一部分結合,以產生(或者,在某些情況下,停止產生)蛋白質,這些蛋白質的缺失(或存在)會導致疾病。幾十年來,科學家們一直努力證明,這種策略可以產生一種能夠治療或預防疾病的藥物,但他們發現毒性和遞送方面存在嚴重問題,許多人因此放棄了它。然而,少數堅持下來的研究人員克服了障礙,及時從基因組學革命揭示的有關遺傳疾病的詳細資訊中獲益。“反義療法是為有遺傳原因的疾病量身定製的,”Ionis 執行長佈雷特·莫尼亞說,他於 1 月份從創始人斯坦利·克魯克手中接任。“它是精準醫學的縮影。”
克雷納、貝內特及其同事將他們的 SMA 藥物稱為 nusinersen。當注射到腦脊液中時,它會誘導非活性運動神經元基因產生 SMN。他們與 Biogen 合作,於 2011 年開始在人體臨床試驗中測試該藥物。拉爾森一家在艾瑪滿兩歲符合資格的那天就讓她入組了。那時她已經完全不能爬了。她的第一劑藥是在 2015 年 3 月注射的,隨後又快速連續注射了兩劑。
2015 年 5 月,黛安在臥室裡,而艾瑪在附近的起居室裡。“我聽到她在叫我,而且聲音越來越近,”黛安回憶道。“接下來,她就從起居室爬到我的臥室了。”黛安問自己,“我剛才真的看到了嗎?”她抱起女兒,把她抱回走廊。然後她回到臥室,喊道:“艾瑪,過來。”小女孩爬到她母親的懷裡。黛安哭著想,“我們有進展了!”
的確,他們有進展了。nusinersen 的臨床試驗非常成功,以至於提前一年結束。美國食品藥品監督管理局於 2016 年 12 月批准了該藥物,品牌名為 Spinraza。目前,40 個國家的 8,400 多名患者正在服用該藥物。25 名患有最嚴重 SMA 突變的新生兒在出生時就接受了該藥物。他們現在四歲了——並且發育正常。“如果我除了開發 Spinraza 之外什麼都沒做,那就足夠了,”克魯克說。

黛安和馬特·拉爾森與他們七歲的女兒艾瑪合影。“我們有進展了!”2015 年,黛安哭著說道,當時患有脊髓性肌萎縮症 (SMA) 的艾瑪在接受反義藥物 nusinersen(品牌名 Spinraza)後幾個月內就能爬到她身邊。圖片來源:伊桑·希爾
但 Spinraza 也是支援 ASO 最終充分發揮其潛力的論點的有力證據。它是第一個取得如此戲劇性成果和商業成功的 ASO。該藥物為克雷納和貝內特贏得了數百萬美元的 2019 年突破獎。它還觸及了一系列誘人的神經系統靶點,例如亨廷頓病和肌萎縮側索硬化症 (ALS)。“我們在 20 世紀 90 年代發現了這些疾病的大多數遺傳基礎,”貝內特說。“我們花了 25 年的時間才將這些非常重要的科學發現轉化為潛在的療法。[對於 Spinraza,] 幾乎令人歎為觀止地意識到,我們擁有一種技術,可以對沒有可用療法的患者產生如此廣泛的影響。”
就像在高海拔地區訓練的長跑運動員一樣,反義科學家們付出了艱苦的努力來最佳化寡核苷酸的化學性質和遞送。現在他們處於海平面,正在衝刺。100 多種藥物正在研發中,用於治療從阿爾茨海默病到高血壓等各種疾病。並非所有藥物都能到達終點線,但包括 Spinraza 在內,迄今為止已有 8 種藥物在美國和歐洲獲得批准,全部用於罕見疾病。用於治療亨廷頓病和 ALS 的藥物正處於臨床試驗的最後階段。在歷史上尚屬首次的情況下,波士頓兒童醫院的一位醫生在不到一年的時間內為一位患有超罕見疾病的小女孩定製了一種反義藥物。“人們談論生物療法已經 30 年了,而令人驚奇的是,它開始發生了,”馬薩諸塞大學醫學院的神經學家羅伯特·布朗說,他是 ALS 研究的領導者。(生物藥物是由活生物體制造的藥物。)“這真是一場遊戲規則的改變者。”
正義與反義
DNA 為生命提供了基本藍圖,但它必須被讀取和翻譯成行動,透過蛋白質的產生,蛋白質執行體內的大部分工作。由於 DNA 中編碼的指令非常關鍵,因此翻譯過程內建了保護機制。有很多重複,首先是兩條核苷酸鏈,它們拉鍊在一起形成 DNA 的雙螺旋結構。其中一條鏈充當模板,鋪設構成 DNA 分子的四種鹼基的序列:腺嘌呤 (A)、胸腺嘧啶 (T)、鳥嘌呤 (G) 和胞嘧啶 (C)。另一條鏈讀取該模板並鋪設一組互補的鹼基。一條鏈上的每個鹼基始終與其特定的夥伴相對:A 始終與 T 配對,C 始終與 G 配對。為了確保準確性,RNA 僅編碼非模板鏈中的指令,用於蛋白質的產生。生物學家用各種名稱稱呼這兩條鏈,包括正義鏈和反義鏈,這賦予了 ASO 技術名稱。
有時,最終結果——蛋白質——並不正確。它們可能過度生產或生產不足,從而導致疾病。小分子藥物是市場上大多數藥物的主要成分,它們靶向與疾病相關的蛋白質。單克隆抗體是另一種主要的藥物類別,通常與蛋白質結合並刺激患者的免疫系統攻擊它們。相比之下,反義藥物的目標是更早地中斷該過程。它們旨在透過根據標準鹼基配對規則卡入到位,從而在轉錄過程中替換錯誤的 RNA,從而調整蛋白質的產生。
一項並行的努力側重於所謂的 RNA 干擾或 RNAi。這項技術是在反義療法被放棄的時候才被發現的,因此其支持者避免使用該術語,但源自這兩種方法的藥物是相關的。“我認為反義療法是屬,而 RNAi 是種,”貝內特說。區別在於 RNAi 藥物有兩條鏈,而 ASO 只有一條鏈。但是任何短鏈——通常為 15 到 20 個核苷酸——都被認為是寡核苷酸。
寡核苷酸藥物技術的通用性源於它分離了兩個關鍵要素:決定藥物遞送和分佈到組織中的平臺或分子特性,以及靶向特定基因所需的鹼基序列。不同的鹼基序列使藥物中包含的資訊有所不同,但具有相同化學修飾的反義藥物在體內往往表現相似。“這就是一旦建立平臺以遞送到感興趣的組織,我們就能快速行動的原因,”馬薩諸塞大學醫學院的核酸化學家喬納森·沃茨說。“透過洗牌鹼基序列,我們可以使用來自罕見疾病患者的基因組測序實驗或來自基因組資料庫的資訊,撥入完全不同的靶點。能夠直觀且合理地使用該資訊非常強大。”
長跑
自 1978 年以來,就有人提出了使用遺傳資訊來製造可以與 RNA 結合的藥物的想法。但是仍然存在許多未解答的問題:如何將寡核苷酸製成藥物?為什麼與 RNA 結合會產生效果?儘管如此,這個想法還是非常吸引克魯克,以至於他在 1989 年辭去了 SmithKline(現在的葛蘭素史克)研發主管的職位,成立了一家致力於反義技術開發的公司。他的妻子羅桑妮(也是一位藥理學家)以及包括貝內特和莫尼亞在內的同事也加入了他的行列。(該公司最初名為 Isis,但最終因顯而易見的原因更名為 Ionis Pharmaceuticals。)
大約在同一時間,其他幾家公司也開始追求反義療法,但大多數公司一家接一家地放棄了這項研究。有一段時間,毒性、脫靶效應和缺乏效力的問題似乎無法克服。*
但克魯克和他的同事們堅持不懈地逐個解決了科學問題。Ionis 聖地亞哥總部一堵長長的專利牆證明了他們的工作。首先,他們必須開發必要的化學物質。例如,透過修飾 ASO 的 RNA 和 DNA 中核糖糖中的關鍵位置 (2'),他們能夠增強 ASO 對 RNA 受體的親和力,從而顯著降低必要的劑量。其他化學修飾提高了安全性和耐受性。他們還發現,當藥物直接遞送到培養物中的細胞時,它們不會被組織吸收,但 Ionis 的科學家們還是大膽地在動物身上測試了這些藥物。莫尼亞曾負責 Ionis 的藥物開發,他生動地記得,當他檢視他用來測量特定 RNA 水平的化學測試時,幾乎沒有看到任何痕跡——藥物已進入大多陣列織中的細胞,並且他們已成功敲低了 RNA 的表達。
貝內特說,在癌症方面花費的時間並沒有取得太大的成果。(然而,更有希望、更精心設計的實驗正在進行中。)真正有效的是具有特定靶點的藥物,通常用於罕見疾病,對於這些疾病,概念驗證更容易建立。最早的 ASO 用於眼部疾病,後來用於肝臟疾病,在這些疾病中,攝取效果特別好。這些藥物是有效的,但最終在商業上不可行,因為更好的解決方案出現了。
最新的寡核苷酸藥物旨在解決罕見疾病。其中一種是 Exondys 51,它靶向杜氏肌營養不良症,這是一種由產生肌營養不良蛋白的基因突變引起的嚴重、進行性退行性疾病。荷蘭萊頓大學醫學中心的 Annemieke Aartsma-Rus 是寡核苷酸治療學會主席,她是杜氏肌營養不良症的專家,並幫助開發了這種藥物。它不如 Spinraza 那麼引人注目,但憑藉早期顯示肌營養不良蛋白水平升高的結果,該藥物獲得了加速監管批准。銷售該藥物的公司(Aartsma-Rus 在其中持有股份)需要在 2021 年之前證明它對患者的功能有意義的影響。
第一種 RNAi 藥物 Onpattro 由總部位於波士頓的生物技術公司 Alnylam Pharmaceuticals 生產,於 2018 年獲得批准,用於治療一種遺傳性神經損傷。一種名為 Tegsedi 的已獲批准的 Ionis ASO 藥物也治療相同的疾病。現在所有寡核苷酸療法的重點是將更多的藥物更高效地遞送到身體的更多部位。“很多人都處於觀望模式,”Aartsma-Rus 說。“他們現在看到,如果他們不開始,他們就會錯過機會。”

艾瑪在她家附近的鞦韆上玩耍。由於包括她和其他人在內的 nusinersen 臨床試驗的成功,全球超過 8,400 名 SMA 患者現在正在服用該藥物。這一突破推動了反義療法領域的發展,這種療法對於遺傳性神經系統疾病似乎特別有效。圖片來源:伊桑·希爾
大腦的希望
長期以來,反義公司基本上忽略了神經系統靶點,因為寡核苷酸通常無法穿過血腦屏障。但貝內特認為,透過腰椎穿刺將它們直接遞送到腦脊液中可能會奏效。他力勸持懷疑態度的克魯克讓他嘗試。“我有很多保留意見,但想法是要說‘是’,”克魯克說。“‘不’永遠不會製造出藥物,‘不’也永遠不會讓任何人變得更好。”他們開始使用亨廷頓病小鼠模型進行探索性研究,亨廷頓病是 ASO 的明顯候選者,因為它與特定的突變直接相關。亨廷頓病患者攜帶 CAG 三聯體鹼基對的重複序列,這會導致毒性水平的亨廷頓蛋白,並導致腦細胞的進行性分解。在小鼠中,貝內特和他的同事發現他們可以降低突變蛋白的水平。“小鼠實際上有所改善,”貝內特說。
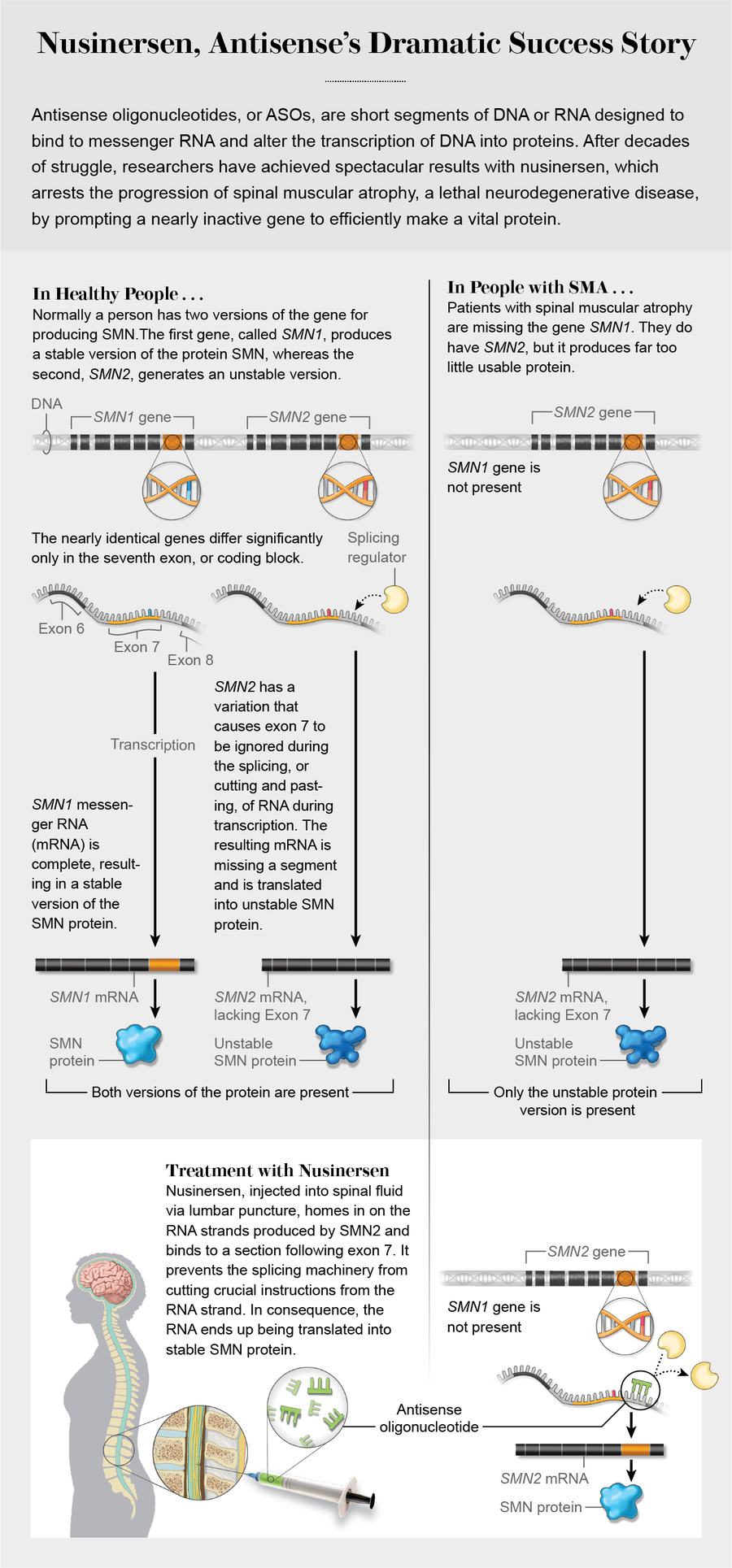
與此同時,克雷納正在研究 SMA。其他人發現,健康人有兩種版本的關鍵運動神經元基因,SMN1 和 SMN2,但後者產生的有功能 SMN 蛋白很少。SMA 患者沒有功能性 SMN1 基因,而他們損壞的 SMN2 副本本身無法完成這項工作。DNA 片段包括“外顯子”(表達的編碼序列,因此名稱中帶有“外”字)和“內含子”(外顯子之間的非編碼片段)。一個稱為 RNA 剪接的過程將外顯子連線在一起並丟棄內含子。SMN2 基因有一種變異,它透過導致特定的編碼塊,外顯子 7 被忽略,從而使其失活。克雷納和貝內特推測,ASO 可以迫使包含該指令塊。到 2008 年,他們已經證明,他們建立的 ASO 在小鼠中透過修復剪接缺陷而發揮作用。隨後進行了人體臨床試驗。
“這就是所謂的疾病修飾療法,”克雷納在談到 Spinraza 時說。“它不僅僅是處理一些症狀。它深入到疾病的根源並改變其程序。”早期干預至關重要。像艾瑪·拉爾森這樣出現症狀的人已經失去了一些運動神經元,這些神經元無法恢復。但治療可以防止剩餘的神經元死亡並改善運動功能。在治療嬰兒方面取得的成功促使人們推動新生兒 SMA 篩查,現在 16 個州都在進行篩查。“相對於出生或疾病發作,你越早開始治療,你就能取得越多的成就,”克雷納說。
Spinraza 的臨床成功表明,與預期相反,反義療法可能對腦部疾病特別有效。神經系統靶點已“成為唾手可得的果實”,Aartsma-Rus 說。例如,幾種基於 ASO 的療法正在開發用於治療亨廷頓病。其中一種名為 RG6042 的藥物由 Ionis 和 Roche 開發,目前正處於 3 期臨床試驗階段。Roche 全球亨廷頓病 ASO 專案的臨床科學負責人斯科特·肖貝爾說,早期的安全性和耐受性研究表明,有可能降低突變蛋白的水平,但“現在重要的是它的臨床意義是什麼?”當前的試驗應該可以回答這個問題。“我們認為,即使減緩 30% 的衰退也是一場勝利,”肖貝爾說。這相當於在患者仍然有功能的情況下,每年給他們爭取回三到四個月的時間。
ALS 也被稱為盧伽雷氏症,它更為複雜,因為最多 10% 的病例具有明顯的遺傳原因,並在家族中遺傳。最常見的遺傳形式是由一種名為 C9orf72 的基因突變引起的;另一種基因 SOD1 導致約 20% 的家族性病例。這些僅佔所有病例的一小部分,但反義療法的希望為以前幾乎沒有希望的地方注入了新的希望。“我的心情非常高漲,”ALS 研究員布朗說,他領導的團隊在 1993 年鑑定了 SOD1。用於治療 C9orf72 和 SOD1 形式疾病的反義藥物的臨床試驗正在進行中。這些藥物已被證明是安全且耐受性良好的,並且可以抑制突變蛋白的活性。
讓布朗等臨床醫生如此興奮的部分原因是,反義療法還使得為個體患者開發藥物成為可能。一位名叫賈西·赫姆斯塔德的年輕愛荷華州婦女,她患有一種非常罕見的 ALS,由一種名為 FUS 的基因突變引起,她於 2019 年夏天開始服用為她量身定製的藥物。到目前為止,她的耐受性良好,並且出現了一些小的改善,例如她重新獲得了移動手臂的能力。
米拉的藥物
在波士頓兒童醫院的神經學家蒂莫西·於在不到一年的時間(創紀錄的時間)內為現年九歲的米拉·馬科韋克創造了一種藥物之前,僅為一個人的藥物是科幻小說。米拉患有一種超罕見的疾病,稱為巴滕病,它實際上是一系列疾病,其中突變導致蛋白質和脂質在細胞中積聚。患有巴滕病的兒童很少能活到青春期。
像許多巴滕病患者一樣,米拉早期非常協調且口齒伶俐。但在三歲時,她的腳趾開始向內轉。在四歲到五歲之間,她變得笨拙,並開始失去視力。科羅拉多州兒童醫院的醫生最終將米拉的症狀與她攜帶的一種巴滕病基因突變聯絡起來。
但巴滕病需要兩個基因突變。米拉的母親朱莉婭·維塔雷洛開始尋找能夠完全測序米拉基因組的人,以確認診斷。她和米拉的父親也想知道他們的幼子阿茲蘭是否有風險。2017 年 1 月,她的請求透過社交媒體傳達到了於的妻子那裡。
於的團隊進行了測序,並找到了缺失的第二個突變。它是由跳躍基因或轉座子引起的,轉座子是一段核苷酸序列,它複製並移動到基因組中不屬於它的位置。這一發現意味著阿茲蘭是安全的。這也給了於一個想法:有可能為米拉創造一種藥物。“我們意識到我們可以使用 Spinraza 的技巧,”於說。“但是,我們不是使用反義寡核苷酸來迫使被忽略的外顯子包含在內,而是使用反義寡核苷酸來關閉阻礙的外顯子。”
在幾家製藥公司拒絕後,於親自監督了藥物的生產。維塔雷洛為尋找治療方法籌集的 300 萬美元中的一部分用於該專案(她不願具體說明金額)。於將該藥物命名為米拉森,僅供唯一一位患者使用,米拉在 2018 年 1 月接受了她的第一劑藥物。那時她已經失明,每天發作 20 到 30 次癲癇,有些持續數分鐘。對米拉身體造成的損害已經無法修復,但經過治療,她的癲癇發作很快就緩解了。四五個月後,癲癇發作持續的時間只有幾秒鐘,而不是幾分鐘。維塔雷洛說,最近,在她的幫助下,米拉甚至可以交替雙腳走上樓梯。
當於在 2019 年末在《新英格蘭醫學雜誌》上報道米拉的故事時,它成為了頭條新聞。它也引發了人們對為一個人開發藥物的成本和倫理的擔憂。(於的機構審查委員會和 FDA 都批准了米拉森。)生物倫理學家薩拉·戈爾德金德曾是 FDA 工作人員,也是罕見疾病專案的顧問和米拉森的顧問,她說,在這種不尋常的情況下,該過程至關重要。仍然必須進行安全性和有效性測試,但也存在許多減輕情況——這些是罕見、致命且快速進展的疾病,沒有治療方法——這可能允許 FDA 依賴一項充分且對照良好的研究,而不是通常需要的兩項研究。“在如何應用法規方面需要一些靈活的思維,”戈爾德金德說。
克魯克已經從 Ionis 的日常運營中退下來,他成立了一個基金會,以支援為影響人數太少而無法在商業上生存的超罕見疾病開發定製的反義藥物。維塔雷洛和於也希望讓個人化治療對所有像米拉這樣的孩子都可用。反義療法的一大優勢是,儘管在 Spinraza 和米拉森上花費了大量資金,但這種個性化藥物不僅可以快速建立,而且成本相對較低。
火烈鳥艾瑪
像米拉一樣,艾瑪·拉爾森也沒有被治癒。她失去的神經元沒有被替換,而且她的骨骼變化可能是永久性的。在拉爾森家,有大片未鋪地毯的木地板,這更適合剛滿七歲的艾瑪在她稱為賽車的輪椅上飛馳。她上一年級,她一天中最喜歡的部分是課間休息,那時她喜歡玩滑梯和蹺蹺板。
當輪椅停好後,她的父母會把她從一個房間抱到另一個房間。她在她的遊戲室裡爬來爬去,炫耀她最喜歡的玩具,一個波莉口袋購物中心。但是,當她的助行器和支具連線到一雙閃亮的粉紅色運動鞋時,艾瑪可以靠自己的力量走幾步。在餐廳裡,她一隻手扶著桌子,像火烈鳥一樣站在靠牆的長凳上,並喊道:“嘿,看,單腿站立!”
拉爾森夫婦承認,生活仍然很艱難,但他們不再絕望。他們希望艾瑪能夠獨立生活。他們對服用 Spinraza 的新生兒狀況良好感到非常興奮。“這讓我的內心充滿了喜悅,”黛安眼眶溼潤地說。“在某些方面,這對艾瑪來說有點晚了,但她為那些小嬰兒鋪平了道路。”
圖片來源:梅薩·舒馬赫
*編者注(20 年 4 月 17 日):此段已在釋出後經過編輯,刪除了對一家追求反義療法的公司的錯誤引用。

