弗朗西斯科·莫吉卡並不是第一個看到 CRISPR 的人,但他可能是第一個被它迷住的人。他記得 1992 年的那一天,他第一次瞥見了這種將引發生物技術革命的微生物免疫系統。他當時正在審查嗜鹽微生物地中海鹽桿菌的基因組序列資料,並注意到 14 個不尋常的 DNA 序列,每個序列長 30 個鹼基。它們的正向和反向讀取大致相同,並且每隔約 35 個鹼基重複一次。很快,他又看到了更多。莫吉卡被迷住了,並將這些重複序列作為他在西班牙阿利坎特大學的研究重點。
這不是一個受歡迎的決定。他的實驗室多年沒有獲得資金。在會議上,莫吉卡會抓住他能找到的最大人物,詢問他們對這些奇怪的小重複序列的看法。“不要太在意重複序列,”他說他們會警告他。“許多生物體中都有許多重複序列——我們已經瞭解它們多年了,但仍然不知道其中有多少在起作用。”
今天,人們對賦予 CRISPR 其名稱的成簇的、有規律間隔的短迴文重複序列以及 CRISPR-Cas 微生物免疫系統如何摧毀入侵病毒的瞭解要多得多。但是,儘管生物醫學領域的大多數人已經開始敬畏該系統的機制(特別是稱為 CRISPR-Cas9 的版本)因為它能被用來編輯基因,但莫吉卡和其他微生物學家仍在研究有關該系統及其工作原理的一些基本問題。它是如何進化的,它又是如何塑造微生物進化的?為什麼一些微生物使用它,而另一些微生物不使用?它是否在其基本的生物學中具有其他尚未被認識到的作用?
關於支援科學新聞
如果您喜歡這篇文章,請考慮透過 訂閱來支援我們屢獲殊榮的新聞報道。透過購買訂閱,您正在幫助確保未來對塑造我們當今世界的發現和想法進行有影響力的報道。
“媒體對 CRISPR 系統的關注大多集中在它作為一種技術上的應用——這是有充分理由的。我們正在看到驚人的影響和機會,”加州大學伯克利分校的分子生物學家 Jennifer Doudna 說,她是第一批揭示 CRISPR-Cas 作為基因編輯工具的敏捷性的科學家之一。“與此同時,還有許多有趣的關於基礎生物學的研究要做。”
它從何而來?
像 CRISPR-Cas 這樣的東西的生物學優勢是顯而易見的。原核生物——細菌和鮮為人知的單細胞生物,稱為古菌,其中許多生活在極端環境中——面臨著遺傳入侵者的不斷襲擊。病毒的數量是原核生物的十倍,據說每兩天殺死世界上一半的細菌。原核生物還會交換稱為質粒的 DNA 片段,這些質粒可能是寄生的——耗盡宿主的資源,如果宿主試圖驅逐它的分子搭便車者,就會迫使其自我毀滅。似乎沒有安全的地方:從土壤到海洋,再到地球上最不適宜居住的地方,都存在著遺傳入侵者。
原核生物已經進化出大量武器來應對這些威脅。例如,限制性酶是蛋白質,可以在特定序列處或附近切割 DNA。但是這些防禦措施是遲鈍的。每種酶都被程式設計為識別特定序列,只有當微生物具有正確的基因副本時,它才能受到保護。CRISPR-Cas 更具動態性。它會適應並記住特定的遺傳入侵者,類似於人類抗體在感染後提供長期免疫的方式。“當我們第一次聽到這個假設時,我們認為對於簡單的原核生物來說,這太過複雜了,”荷蘭瓦赫寧根大學的微生物學家約翰·範德·奧斯特說。
當莫吉卡和其他人看到 CRISPR 迴文重複序列之間的 DNA 有時與病毒基因組中的序列匹配時,他們推斷出 CRISPR-Cas 的功能。此後,研究人員已經弄清楚,某些 CRISPR 相關(Cas)蛋白質會在細菌和古菌暴露於特定病毒或質粒後,將這些間隔序列新增到基因組中。由這些間隔序列製成的 RNA 會引導其他 Cas 蛋白質吞噬任何與該序列匹配的入侵 DNA 或 RNA(請參閱'持久保護')。
細菌和古菌是如何擁有如此複雜的免疫系統的?這個問題尚未得到解答,但主要的理論是該系統來源於轉座子——可以在基因組中從一個位置跳到另一個位置的“跳躍基因”。美國馬里蘭州貝塞斯達美國國立衛生研究院的進化生物學家尤金·庫寧和他的同事們發現1一類編碼 Cas1 蛋白質的移動遺傳元件,該蛋白質參與將間隔子插入基因組。他認為,這些“casposons”可能是 CRISPR-Cas 免疫的起源。研究人員現在正在努力瞭解這些 DNA 片段是如何從一個位置跳到另一個位置的,然後追蹤這種機制是如何導致 CRISPR-Cas 的複雜性的。
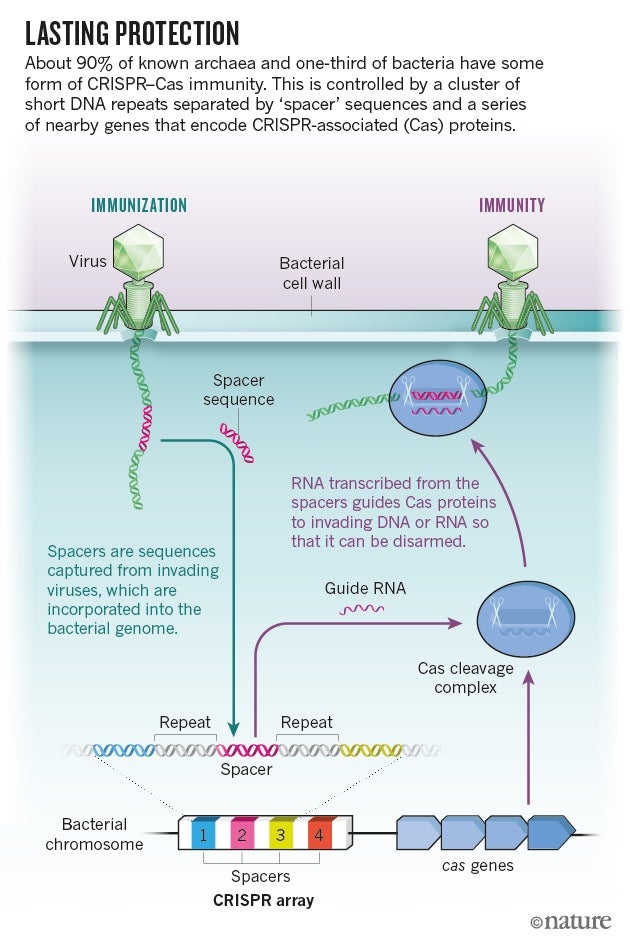
圖片來源:NIK Spencer/Nature
它是如何工作的?
近年來,Cas 蛋白質如何新增間隔子的許多分子細節已被精細地研究出來2。但是,病毒 DNA 在化學上與宿主 DNA 幾乎相同。在細胞中充滿了 DNA 的情況下,這些蛋白質如何知道要將哪些 DNA 新增到 CRISPR-Cas 記憶中?
風險很高:立陶宛維爾紐斯大學的生物化學家 Virginijus Siksnys 說,如果細菌添加了它自己的 DNA 片段,它可能會因自身免疫攻擊而自殺。“這些酶是一把雙刃劍。”
北卡羅來納州立大學羅利分校的微生物學家 Rodolphe Barrangou 說,細菌和古菌種群可能會吸收一些錯誤。如果其他細胞在病毒攻擊後能夠茁壯成長,那麼一些細胞的自殺可能無關緊要。
事實上,當病毒滲透到細菌生態系統中時,通常只有約 1000 萬個細菌中的一個會獲得一個能夠讓它自我防禦的間隔子。這些機率使得很難研究是什麼驅動了間隔子的獲取,也很難了解為什麼一個細胞成功了,而其他細胞失敗了。“當它真正發生時,很難抓住那個細菌,”紐約市洛克菲勒大學的微生物學家盧西亞諾·馬拉菲尼說。
弄清楚如何識別合適的間隔子——並提高它們被整合的速率——可能會很有用。一些研究表明,含有 CRISPR-Cas 機制的細胞可以作為一種記錄裝置,記錄它們遇到的 DNA 和 RNA 序列3。這可能使研究人員能夠追蹤細胞的基因表達或長期接觸環境化學物質的情況。
研究人員還想了解如何從集合中修剪舊記憶。大多數具有 CRISPR-Cas 系統的微生物包含幾十個間隔子;有些只有一個。相比之下,古菌託氏硫化葉菌將其基因組的 1% 用於其 5 個 CRISPR-Cas 系統,其中包括 458 個間隔子。
保留舊的間隔子可能沒有多少動力:如果病毒發生突變以避免 CRISPR-Cas,那麼間隔子就會過時。而且微生物保留額外的 DNA 可能是一種負擔。“細菌不可能永遠膨脹它的基因組,”以色列雷霍沃特魏茨曼科學研究所的遺傳學家羅滕·索雷克說。
它還能做什麼?
一些間隔子的起源提出了另一個謎團。到目前為止觀察到的間隔子中,只有不到 3% 與 DNA 資料庫中的任何已知序列匹配。
這可能反映了對病毒的瞭解甚少。大多數測序工作都集中在那些感染人類、牲畜或農作物的病毒上。“我們對細菌的敵人,特別是瘋狂古菌的敵人知之甚少,”佐治亞大學雅典分校的 RNA 生物學家邁克爾·特恩斯說。
還有可能一些間隔子是已經不存在或突變到無法識別的病毒的幽靈。但第三種可能性讓該領域議論紛紛。研究人員已經發現了 CRISPR-Cas 系統除了抵禦遺傳入侵者之外的其他作用的例子。在一些細菌中,CRISPR-Cas 成分控制著 DNA 修復、基因表達和生物膜的形成。它們還可以決定細菌感染其他生物的能力:引起軍團病(退伍軍人症)的嗜肺軍團菌必須具有 Cas 蛋白質 Cas2 才能感染其天然宿主阿米巴。“一個主要的問題是,除了防禦之外,還有多少生物學,”馬薩諸塞大學醫學院伍斯特分校的分子生物學家埃裡克·桑特海默說。“在未來幾年裡,仍然會有很多令人驚訝的事情發生。”
桑特海默補充說,這與發現 RNA 干擾(一種在植物、動物和其他非原核生物中沉默基因表達的系統)形成了一個誘人的平行。RNA 干擾早期也被主要認為是防禦機制,只是後來研究人員才注意到它在調節宿主基因表達中的作用。
荷蘭代爾夫特理工大學的微生物學家斯坦·布勞恩斯說,這也可以解釋為什麼一些間隔子與已知的病毒或質粒不匹配。“這些系統並非旨在做到完美:它們會抓住病毒 DNA 以及它們自己的 DNA,”他說。“一旦它們開始拉入新的 DNA 片段,它們就可以獲得新的功能——如果它們沒有死亡的話。”
為什麼只有一些微生物使用它?
無論 CRISPR-Cas 還有其他什麼功能,很明顯,一些微生物比其他微生物使用它的頻率更高。庫寧說,超過 90% 的古菌具有基於 CRISPR 的免疫力,而只有大約三分之一的已測序細菌會費心使用它。而且,沒有非原核生物,即使是單細胞生物,也被發現使用 CRISPR-Cas。
一種名為微型古菌的古菌,以寄生的形式生活在近沸騰水中的另一種古菌上,並且已經放棄了許多與其能量產生和一般細胞維護相關的基因。然而,在其微小的 49 萬個字母的 DNA 指令手冊中,微型古菌保留了一個包含約 30 個間隔子的 CRISPR-Cas 系統。“它基因組的很大一部分仍然致力於 CRISPR,”英國聖安德魯斯大學的分子生物學家馬爾科姆·懷特說。“CRISPR 一定非常重要,但我們真的不知道為什麼。”
埃克塞特大學佩恩林校區的微生物學家埃德澤·韋斯特拉表示,這些差異表明,存在一些關鍵的生態因素有利於CRISPR-Cas系統,這些因素會優先考慮病毒防禦或其他好處,而不是細胞自殺的風險。極端環境似乎有利於CRISPR-Cas系統,但韋斯特拉指出,這種系統的頻率在更適宜棲息地的細菌中也存在差異。例如,鳥類病原體雞敗血支原體在從雞轉移到野生雀類時,就拋棄了它的CRISPR-Cas裝置。韋斯特拉說,為什麼該系統在雞身上有用,而在雀類身上卻沒用,這誰也說不準。
數學模型和一些早期的實驗室實驗表明,當需要對抗的病毒型別很少時,CRISPR-Cas可能更具優勢4, 5。CRISPR-Cas間隔序列可以在新增DNA成為基因組負擔之前記錄有限數量的病毒序列。庫寧說,如果環境中病毒的多樣性大大超過了可能的間隔序列的數量,那麼CRISPR-Cas系統可能就沒什麼用處。另一種可能性是,極端環境中的古菌不能過分依賴其他防禦手段。細菌擊退入侵者的一種常見方法是突變其自身外殼(稱為包膜)中的蛋白質。然而,一些古菌可能沒有太多的自由來調整這些包膜,因為包膜的結構對於生物在惡劣條件下的生存至關重要。莫吉卡說:“這使得像CRISPR這樣的替代系統更加重要。”
CRISPR-Cas有多少種類型?
人類傾向於關注CRISPR-Cas9系統,該系統因其在基因組編輯中的簡單性和多功能性而備受推崇,但微生物卻不會偏愛任何一種。相反,它們傾向於混合搭配不同的系統,從其他細菌中快速獲取新的系統並拋棄舊的系統。
研究人員已經正式認可了6種不同型別的CRISPR系統,以及19種亞型。“而且我們實際上只知道其中一小部分的實際工作原理,”馬拉菲尼說。
揭開這些機制的謎團可能會成為尋找CRISPR-Cas系統新生物技術應用的關鍵。例如,備受青睞的CRISPR-Cas9是一種II型系統,它利用從間隔序列轉錄的RNA分子來指導酶切割入侵的病毒或質粒DNA。但去年發現的VI型系統中的酶6會切割RNA,而不是DNA。而IV型系統包含一些與CRISPR-Cas相關的基因,但缺乏插入間隔序列所需的重複序列和機制。
III型系統是自然界中最常見的CRISPR-Cas系統之一,也是最不為人所知的系統之一。迄今為止的證據表明,它們不是對入侵的DNA或RNA本身作出反應,而是對DNA轉錄成RNA的過程作出反應。如果事實證明是這樣,這將是一種新的調控形式,可以擴充套件用於基因組編輯的CRISPR-Cas工具箱,杜德納說。
隨著研究人員將搜尋範圍從在培養基中生長的微生物擴充套件到包括來自環境DNA樣本的遺傳序列,可能會出現其他系統。“我們已經幾次說我們已經到了終點,”範德奧斯特說,但結果每次都被新的CRISPR-Cas系統出現而感到驚訝。
對莫吉卡來說,探索這種多樣性並回答有關CRISPR系統的基本問題比它們引發的革命更有吸引力。他說,這讓他的許多同事感到困惑。他已經沉浸在CRISPR-Cas生物學研究中四分之一個世紀了,雖然對於那些希望編輯基因組的人來說,有很多資金可供使用,但對於他所做的那種工作,資金則少得多。
“我知道這是一個偉大的工具。它非常棒。它可以用來治療疾病,”莫吉卡說。“但這不是我的業務。我想知道這個系統從頭到尾是如何運作的。”
本文經許可轉載,並於2017年1月19日首次發表。